茯苓–聚乙烯醇抑菌膜的制备及生物可降解动力学评价
邹鹏鹏,刘宇琴,陈亚楠,蔡俊
茯苓–聚乙烯醇抑菌膜的制备及生物可降解动力学评价
邹鹏鹏,刘宇琴,陈亚楠,蔡俊
(湖北工业大学 生物工程与食品学院,武汉 430068)
以可降解材料聚乙烯醇为基材,通过添加茯苓溶液,制备出复合抑菌薄膜,研究不同浓度茯苓对共混膜理化性能和功能性能的影响。采用溶剂浇铸法制备茯苓/PVA共混膜。对共混膜的物理力学性能,以及溶解度、透光率、抑菌性、可降解性进行检测。利用红外光谱、扫描电镜对其结构进行分析表征。茯苓的添加削弱了PVA分子间作用力,显著提高了断裂伸长率,由202.77%增加到398.82%,降低了拉伸强度,并且茯苓与PVA之间形成氢键,减少了水分对薄膜的溶解,薄膜溶解度由100%降到38.21%。随着茯苓质量分数的增加,薄膜的透光率下降,抑菌性得到增强。土壤降解实验表明茯苓/PVA共混膜具有良好的生物降解性。制备的茯苓/PVA共混膜的力学性能和耐水性均得到提高,并且复合膜具有一定的抑菌性和可降解性。文中制备的复合膜为食品包装提供了理想选择。
茯苓;聚乙烯醇;力学性能;耐水性;生物降解性
近50年来,合成石油聚合物已广泛应用于各种包装材料,由于它们的可生物降解性差,已成为产生垃圾的主要来源。为了解决这一问题,很多研究都致力于获得一种环保的包装材料[1-2]。在过去的20年里,生物可降解材料作为石油衍生塑料的替代品受到了关注[3-8],包括对淀粉、纤维素和壳聚糖在内的天然生物聚合物单独或与合成聚合物结合进行了测试,以制备部分或者完全可生物降解的薄膜。
聚乙烯醇(PVA)是一种主要由C−C键组成的亲水性可生物降解聚合物。它具有良好的成膜性、稳定的化学性质、高强度的力学性能以及对人体没有毒害并且可以降解在土壤之中等特点[9],PVA已经被用于很多领域。聚乙烯醇薄膜由于耐水性太差,力学性能受环境中湿度影响较大,在很大程度上限制了它的生产、推广和应用[10]。聚乙烯醇之所以不耐水,是由于分子中含有大量亲水性基团羟基,很容易与环境中水分子产生亲和作用,影响PVA薄膜的阻隔能力。想要提升其耐水性,必须把PVA上游离的羟基掩蔽起来或与其他物质结合起来生成难溶于水的物质。常用改性的方法有化学交联和共混改性,化学交联由于所用试剂具有一定刺激性气味和毒性,限制其在食品包装上应用,因此,国内外学者常用共混改性来提 高PVA薄膜耐水性以及阻湿阻氧等性能,包括添加淀粉[11]、壳聚糖[12]、聚乳酸[13]、β–羟基丁酸[14]等。茯苓是一种寄生与松科植物树根上的真菌,主要分布在我国云南、贵州、湖北和湖南等地药理实验表明,茯苓具有抑菌抗氧化等功能[15]。通过流延法制备出茯苓/PVA共混膜,研究茯苓质量分数对共混膜物理性能影响,并探讨膜对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌抑制效果,最后对共混膜的降解动力学进行评价,以便更好应用于食品包装材料。
1 实验
1.1 仪器和材料
主要材料:茯苓购自中国云南省;聚乙烯醇1788,分析纯(AR)型,购自中国上海阿拉丁生化科技有限公司,醇解度为87.0%~89.0%;甘油、尿素、NaOH、氯化钠、琼脂为分析试剂级(AR),购自中国国药集团化学试剂有限公司(上海);牛肉膏、蛋白胨均为生物试剂(BR),购自中国国药集团化学试剂有限公司(上海)。
主要仪器:ZSD–1270全自动生化培养箱,上海智城分析仪器有限公司;ZHWY–2102C恒温培养箱振荡器,上海智城分析仪器有限公司;320–SpH计,上海崇明仪器厂;GW–2000型可见分光光度计,上海精密科学仪器有限公司;TA. XT Plus质构仪,英国SMS公司;SC 502电子显微镜,日本东京日立公司;W3/031水蒸气透过率仪,济南兰光有限公司;VERTEX 70傅里叶红外光谱,德国布鲁克有限公司。SC502扫描电子显微镜,日本东京JEOL公司。
1.2 方法
1.2.1 茯苓溶液和PVA溶液制备
将茯苓块用粉碎机粉碎成茯苓粉,分别称取2、6、10、14 g溶解在NaOH/尿素/H2O质量比为4∶6∶90的水溶液中,用磁力搅拌器在25 ℃恒定搅拌2 h, 得到茯苓粗溶液。茯苓粗溶液离心(8 000 r/min、10 min),去除不溶杂质和气泡,得茯苓溶液。同时,将6 g聚乙烯醇(PVA)粉末溶解在100 g水中,制成质量分数为6%的透明PVA溶液。
1.2.2 共混膜制备
采用溶液浇铸法制备茯苓/PVA薄膜。将制备好不同浓度的茯苓溶液与PVA溶液以质量比3∶17混合,在室温下搅拌3 h。将这些成膜液倒入聚苯乙烯培养皿(直径为18 cm)上。为控制成膜厚度,每个成膜液质量均为18 g,薄膜在室温通风橱中干燥24 h。所有薄膜样品在测试前都在温度为(25±1)℃、相对湿度为(57±2)%下处理72 h。选择这些条件来模拟中等水分食品在高相对湿度和室温下的储藏条件。将混合溶液分别命名为茯苓/PVA–2、茯苓/PVA–6、茯苓/PVA–10、茯苓/PVA–14。
1.3 力学性能分析
薄膜样品的测量按照ASTM D882–09标准方法进行。用质构分析仪测试了薄膜的拉伸强度(S)和断裂伸长率(1)。将薄膜切割成10 mm×50 mm大小的条状进行测量,并夹在夹具之间。初始握把长度为50 mm,十字头速度设置为0.5 mm/s。使用Texture Expert软件记录力随变形的曲线,薄膜厚度用手动千分尺测量。这些测量是在室温下进行的,每个浓度共混膜重复15次。S(MPa)和1(%)的计算见式(1)和式(2)。
式中:为最大力,N;为薄膜厚度,μm;为薄膜宽度,μm。

式中:0为薄膜初始长度,mm;为薄膜拉伸长度,mm。
1.4 红外光谱分析
薄膜的ATR–FTIR光谱用VERTEX 70光谱仪采集,该光谱仪配备了氘化硫酸甘氨酸(DTGS)检测器。每个光谱的采集分辨率为4 cm−1,范围为4 000~500 cm−1,共64次扫描。背景光谱是扫描空气得到的,并从样品光谱中减去。在进一步分析之前,使用PE OPUS软件对所有光谱进行基线校正和归一化处理。
1.5 溶解度分析
在水中溶解度定义为薄膜在水中浸泡24 h后溶解的干物质的百分比。将尺寸为20 mm×20 mm的薄膜样品在65 ℃烤箱中干燥24 h,将薄膜称量(1),在25 ℃的水中浸泡24 h,然后在100 ℃下重新干燥24 h,记录质量(2)。用式(3)计算薄膜的水溶性[16]。
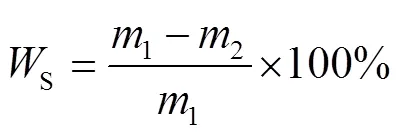
式中:1和2分别为初始和最终干膜样品的质量,g。
1.6 透光率测定
用紫外–可见分光计记录薄膜样品在600 nm波长处紫外–可见吸收光。将每个薄膜样品切割成矩形块(10 mm×45 mm),直接放入测试室,以空气为参照物进行测量[17]。
1.7 抑菌性测试
圆形薄膜片的制作:共混膜用打孔器裁成直径为10 mm的圆形片,并在紫外灯下照射2 h,获得无菌薄膜片。在无菌操作台中将金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌接种至液体培养基中,在38 ℃的恒温摇床中培养24 h进行活化。然后将金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌稀释,各吸取0.2 mL菌悬液,分别涂布在已灭菌的固体培养基平板上,同时将灭菌后的薄膜样品放置在涂布好的固体培养基上,然后放入培养箱,培养24 h后进行观察,每个样品做3个平行。使用十字交叉法记录抑菌圈的大小,并分析共混膜的抑菌性能。
1.8 可降解实验
薄膜样品被裁剪成30 mm×30 mm正方形,埋在土壤5 cm处。花盆放在露天阳台上,定期浇水保持花盆的湿度,土壤湿度保持在20%~50%,将多余水分从花盆底部孔洞排出。在土埋试验中,用试样质量损失随时间的变化来表征降解速率。共混膜的降解以定期的时间间隔(15 d)进行测定。将花盆中的样品通过一个0.9 mm的筛子,并用蒸馏水轻轻地清洗残留的薄膜,并在真空下干燥至恒量。根据质量损失率,计算出15 d内平均每天质量损失速率。

式中:1为前15天质量损失率;2为后15天质量损失率。
2 结果与分析
2.1 茯苓/PVA共混膜力学性能
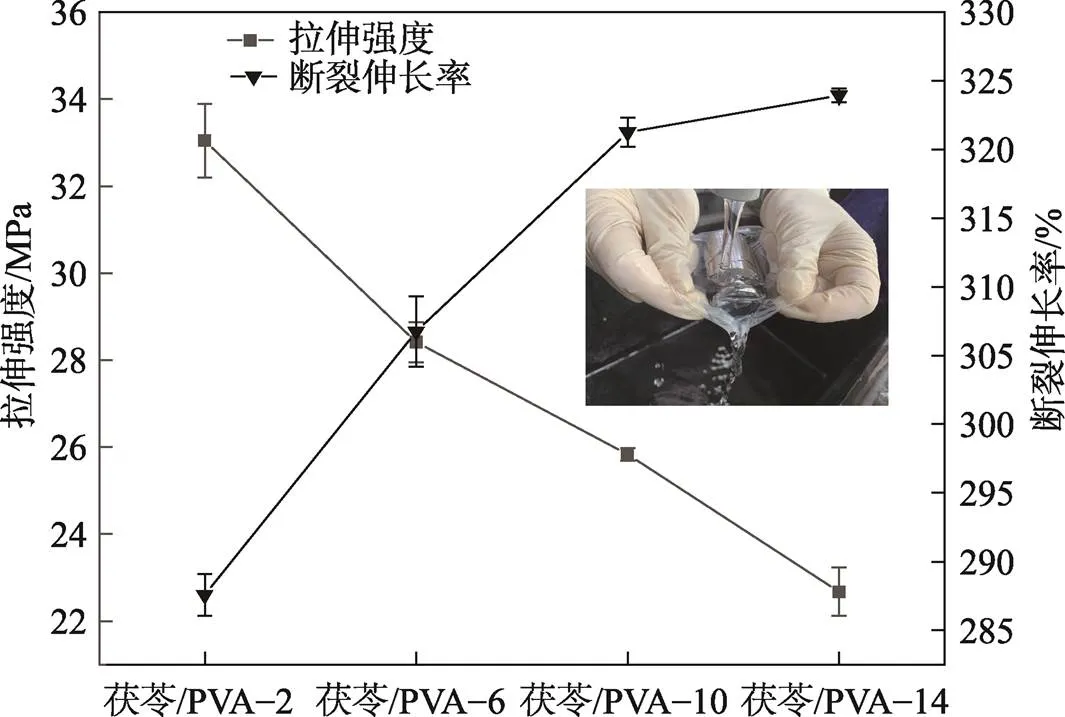
一般来说,力学性能是决定薄膜在包装应用中可行性条件之一,力学性能强弱取决于聚合物的性质与结构。共混膜的机械强度见表1,由表1可知,与对照PVA薄膜相比,随着茯苓的添加,薄膜的拉伸强度减小,断裂伸长率显著增大。出现这一原因是由于茯苓进入PVA分子链中,破坏PVA分子内部晶体结构、削弱分子间相互作用力。随着茯苓质量分数的增加,薄膜拉伸强度减小,断裂伸长率先增加后减小,过高浓度的茯苓导致共混膜之间相容性减弱,使得断裂伸长率下降。
表1 PVA膜和茯苓/PVA共混膜的力学性能、水溶解度、透光率和外观

Tab.1 Mechanical properties, water solubility, light transmittance and appearance of PVA film and Poria cocos/PVA blend films
共混膜在水中浸泡24 h,并在温度(25±1)℃、相对湿度(57±2)%下处理72 h后的力学性能见图1。由于纯PVA全溶于水中,故不讨论PVA在水中浸泡后的力学性能。图1中茯苓/PVA–2复合膜在水中浸泡24 h后,在膜上放上500 g的砝码仍能保持薄膜的完整而不破损。共混膜溶解后的力学性能与浸泡前相比,断裂伸长率降低,拉伸强度增加,这是由于共混膜中亲水性部分溶解在水中,导致水增塑效果减弱,分子间作用力增加。共混膜溶解后仍能保持较好的力学性能,表明茯苓的添加增加了PVA的耐水性。
样品
2.2 水溶解度结果分析
与对照PVA膜相比,茯苓的添加,使得薄膜溶解度由100%减少到38.21%,并且随着茯苓质量分数的增加,共混膜的溶解度减小。薄膜的溶解度取决于基材上游离的羟基,与水之间形成氢键。随着茯苓的添加,PVA上游离的羟基与茯苓中β–(1→3)–D–葡聚糖形成氢键,减少了游离羟基数量,使得溶解度降低。较低的溶解度值表明所得到薄膜在水介质中表现出良好的稳定性,适合包装应用[18]。
2.3 红外光谱分析
不同浓度的茯苓与PVA共混形成的复合膜红外光谱见图2。在PVA膜光谱中观察到3 264 cm−1处的大谱带是羟基的伸缩振动形成的。在1 727 cm−1处的峰值是来自PVA中乙酸基团C=O和C−O的伸缩形成的。此外,光谱还在1 423 cm−1和1 028 cm−1处出现了一些峰,分别对应于C−H和C−O−C基团拉伸振动的。PVA膜在835 cm−1处的峰值,是C−C键振动形成的[19]。茯苓光谱在3 415 cm−1处有一个较宽的吸收峰,这是羟基伸缩振动的特征吸收峰。在2 918 cm−1和1 647cm−1形成的吸收峰分别是C−H和C−C键的振动引起的。茯苓的光谱在889 cm−1也显示出吸收峰,这是由多糖中吡喃结构导致的。

图2 不同浓度茯苓/PVA共混膜的红外光谱
理论上,没有形成氢键的羟基会在3 600 cm−1左右产生吸收峰,当分子间和分子内氢键形成时,吸收带由于拉伸振动会向较低频率处移动,随着氢键变得更强,O−H伸展出现的频率变得更低[20]。当PVA中添加茯苓后,3 264 cm−1处主峰向3 275cm−1处偏移,并且峰型变窄,表明PVA中游离的O−H与茯苓中羟基发生氢键作用,增加茯苓的浓度后,该峰向更高的波数偏移。如上所述,这种现象主要是由于氢键的形成导致的,被称为“红移”效应,是由于O−H键延伸,降低了拉伸O−H键所需的能量[21]。在其他混合物中也发现了类似的结果,如结冷胶与PVA共混[22]、PVA与金合槐胶共混[23]。
从茯苓/PVA薄膜光谱中可以看出,C−O−H组中的C−O拉伸带特征峰从1 162 cm−1(茯苓)转移到1 142 cm−1(茯苓/PVA–2)。这种变化可能与茯苓的−OH基团与PVA的−OH基团相互作用(可能通过氢桥)有关[24]。在PVA中加入茯苓后,茯苓在1 083 cm−1处的波峰向低波数方向移动。这些结果可能与PVA中O−H或C−H基团与茯苓中C−O和C−O−C基团之间发生氢键作用有关。
2.4 扫描电镜分析茯苓/PVA共混膜
研究了茯苓对共混膜微观结构的影响,并对薄膜的截面进行了分析。茯苓/PVA–2膜截面平坦光滑且沟纹均匀,表明茯苓和PVA具有良好的相容性,随着茯苓质量分数增加,茯苓与PVA共混膜截面更加致密,这是由于更多氢键相互作用形成的。当茯苓质量分数增加到14%时,共混膜截面微结构不均匀、粗糙,原因是高浓度的茯苓添加到PVA中,会破坏结构的稳定性与相容性。

图3 不同膜的截面扫描电子显微镜图
2.5 透光率结果分析
透光率对薄膜的功能至关重要,因为它影响产品的外观。不同浓度茯苓的共混膜透光率见表1。当在PVA中添加茯苓时,透光率显著降低,在600 nm处透光率由原来的92.04%降低到80.16%,主要原因是,茯苓溶液为黄褐色,所成薄膜略微偏黄,当茯苓质量分数增加到14%时,透光度降到54.32%。原因是,随着茯苓质量分数的增加,共混膜的相容性减弱,表面会变得相对粗糙(见图2e),影响光的透射。虽然茯苓的添加会降低共混膜的透光率,但是薄膜(如表1物理外观所示)仍有良好的光学透性,不同浓度的茯苓共混膜所覆盖的图像和文字仍能清晰可见。
2.6 复合薄膜抑菌性能
在食品包装中,指示菌严重影响食品质量,导致各种疾病。茯苓与PVA共混膜对3种典型的指示菌的抑菌活性进行了评估(表2)。从图4可以明显看出,纯PVA膜溶解到琼脂中对测试的细菌没有显示出抗菌活性,这一观察结果与之前报道PVA膜对金黄色葡萄球菌和大肠杆菌的抑菌无效[25]。茯苓的添加,共混膜对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌均有明显的抑菌效果,茯苓质量分数的增加,抑菌圈变大,这是因为茯苓中含有的三萜类化合物和茯苓多糖对细菌有一定抑制作用,在实验的指示菌中,大肠杆菌和金黄色葡萄球菌对复合膜最为敏感。随着茯苓质量分数的增加,对指示菌的抑菌作用增强[26]。这些结果表明,茯苓/PVA复合膜具有良好的抗菌活性,可作为一种延长食品货架期的生物活性食品包装材料。
表2 茯苓/PVA共混膜的抑菌圈直径

Tab.2 Diameter of inhibition zones of Poria cocos/PVA films
2.7 复合薄膜土壤降解分析
土埋实验提供了一个真实的外界环境,土壤湿度、温度和微生物繁殖人为控制较少。为了减少薄膜形状对降解过程的影响,所有共混膜的尺寸一样。通过薄膜的质量损失率来评判共混膜的生物降解性(图5)。由于PVA膜在清洗过程中会溶解在水中,导致称量过程中实验数据不准确,以下不单独讨论纯PVA膜降解性。通过计算各共混膜15 d内平均每天质量损失率,结果见表3,复合膜的土壤降解动力学可以分为3个阶段:降解初期、降解生长期和稳定期。在第1个15 d中,共混膜的质量损失率最大,质量损失速率也是最快,茯苓/PVA–2质量损失率达到36%,原因是刚挖的土壤水分含量很高,薄膜中亲水性部分会溶解在土壤里的水中,这与薄膜溶解度规律一致。第2个15 d到第4个15 d是膜降解初期,质量损失速率较小,薄膜依然保持致密的结构,导致土壤中微生物难以降解,也有可能天气较为干燥,不利于微生物生长繁殖。第5个和第6个15 d,降解速率加快,此时是降解生长期,土壤中微生物对薄膜中易降解部分茯苓进行降解,增加了PVA基体与水和微生物的接触面积,从而加快了薄膜质量损失速率,第7个15 d之后,薄膜降解速率开始减慢,进入稳定期。从不同浓度茯苓/PVA降解速率可以观察到,茯苓/ PVA–2降解速率最大,茯苓/PVA–14复合膜降解速率最小,原因是高浓度的茯苓与PVA中游离的羟基形成更多的氢键,薄膜在土壤中更加稳定,这与红外光谱结果一致。共混膜在降解120 d后,茯苓/PVA–2质量损失率能达到73%,表明茯苓/PVA共混膜具有良好的生物降解性。

图4 不同膜的抑菌效果

图5 不同浓度茯苓/PVA共混膜降解曲线
表3 不同浓度茯苓/PVA共混膜降解平均质量损失速率

Tab.3 Average weight loss rate of degradation of different concentrations of Poria cocos/PVA blend films
3 结语
以PVA为基材,通过添加不同浓度茯苓,采用一种简单、经济、环保溶剂浇铸法制备一种生物抑菌膜,研究了不同浓度的茯苓对共混膜理化性能和抑菌性能影响。结果表明,与纯PVA膜相比,茯苓/PVA共混膜具有更优异的耐水性能,溶解度从100%减少到29.36%(茯苓/PVA–14),断裂伸长率由202.77%增加到450.87%,过高浓度的茯苓会导致共混膜相容性下降,断裂伸长率减少。薄膜的透光率随着茯苓质量分数的增加而减小,但不会影响共混膜的光学特性。红外光谱和扫描电镜进一步证实茯苓与PVA分子间形成氢键和高浓度的茯苓会降低膜之间相容性。茯苓/PVA薄膜对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌均有一定的抑制作用。可降解实验表明,土壤中的水分会促进薄膜的降解,且在第1个15 d质量损失率与薄膜溶解度变化规律一致,在120 d时,共混膜的质量损失率超过50%,表明茯 苓/PVA共混膜是一种可降解薄膜。综上所述,茯苓的添加改善了共混膜的理化性质和功能特性,可作为一种有效的生物食品包装材料,改善食品品质,延长食品保质期。
[1] TORRES F G, TRONCOSO O P, DíAZ D A, et al. Morphological and Thermal Characterization of Native Starches from Andean Crops[J]. Starch-Stärke, 2011, 63(6): 381-389.
[2] ZHU Fang-yuan, WARD M B, COMYN T P, et al. Dielectric and Piezoelectric Properties in the Lead-Free System Na0.5K0.5NbO3-BiScO3-LiTaO3[J]. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control, 2011, 58(9): 1811-1818.
[3] THAKORE I M, DESAI S, SARAWADE B D, et al. Studies on Biodegradability, Morphology and Thermo-Mechanical Properties of LDPE/Modified Starch Blends[J]. European Polymer Journal, 2001, 37(1): 151-160.
[4] KIATKAMJORNWONG S, THAKEOW P, SONSUK M. Chemical Modification of Cassava Starch for Degradable Polyethylene Sheets[J]. Polymer Degradation and Stability, 2001, 73(2): 363-375.
[5] ISHIAKU U S, PANG K W, LEE W S, et al. Mechanical Properties and Enzymic Degradation of Thermoplastic and Granular Sago Starch Filled Poly(ε-Caprolactone)[J]. European Polymer Journal, 2002, 38(2): 393-401.
[6] ZHANG X, BURGAR I, LOURBAKOS E, et al. The mechanical Property and Phase Structures of Wheat Proteins/Polyvinyl Alcohol Blends Studied by High-Resolution Solid-State NMR[J]. Polymer, 2004, 45(10): 3305-3312.
[7] DEMIRGÖZ D, ELVIRA C, MANO F, et al. Chemical Modification of Starch Based Biodegradable Polymeric Blends: Effects on Water Uptake, Degradation Behaviour and Mechanical Properties[J]. Polymer Degradation and Stability, 2000, 70(2): 161-170.
[8] KIM M. Evaluation of degradability of Hydroxypropylated Potato Starch/Polyethylene Blend Films[J]. Carbohydrate Polymers, 2003, 54(2): 173-181.
[9] YE Mao, MOHANTY P, GHOSH G. Morphology and Properties of Poly Vinyl Alcohol (PVA) Scaffolds: Impact of Process Variables[J]. Materials Science & Engineering C, Materials for Biological Applications, 2014, 42: 289-294.
[10] LI Ji-hui, LI Yong-shen, SONG Yun-na, et al. Ultrasonic-Assisted Synthesis of Polyvinyl Alcohol/Phytic Acid Polymer Film and Its Thermal Stability, Mechanical Properties and Surface Resistivity[J]. Ultrasonics Sonochemistry, 2017, 39: 853-862.
[11] ALIPOORI S, MAZINANI S, ABOUTALEBI S H, et al. Review of PVA-Based Gel Polymer Electrolytes in Flexible Solid-State Supercapacitors: Opportunities and Challenges[J]. The Journal of Energy Storage, 2020, 27(1): 101072.
[12] 刘文霞, 徐冬美, 时芳芳, 等. 壳聚糖–聚乙烯醇共混膜的制备与性能[J]. 包装工程, 2016, 37(7): 40-44.
LIU Wen-xia, XUDong-mei, SHI Fang-fang, et al Preparation and Propertiesof Chitosan/PVA Blend Films[J]. Packaging Engineering, 2016, 37(7): 40-45.
[13] ALHARBI H F, LUQMAN M, FOUAD H, et al. Viscoelastic Behavior of Core-Shell Structured Nanofibers of PLA and PVA Produced by Coaxial Electrospinning[J]. Polymer Testing, 2018, 67: 136-143.
[14] ANATOLY A, OL'KHOV, ALEXEY L, et al. Morphology of Poly(3-Hydroxybutyrate)-Polyvinyl Alcohol Extrusion Films[J]. Journal of Polymer Engineering, 2015, 35(8): 765-771.
[15] 付玲, 于淼. 茯苓研究的新进展[J]. 新疆中医药, 2005, 23(3): 79-83.
FU Ling, YU Miao. Advances in studies of Poria Cocos[J]. Xinjiang Journal of Traditional Chinese Medicine, 2005, 23(3): 79-83.
[16] ROY S, RHIM J W, JAISWAL L. Bioactive Agar-Based Functional Composite Film Incorporated with Copper Sulfide Nanoparticles[J]. Food Hydrocolloids, 2019, 93(2): 156-166.
[17] HAN, JUNG H. A Review of Food Packaging Technologies and Innovations[J]. Innovations in Food Packaging (Second Edition), 2014, 1: 3-12.
[18] TAI T, AKAHORI A, SHINGU T. Triterpenes of Poria Cocos[J]. Phytochemistry, 1993, 32(5): 1239-1244.
[19] PEREIRA V A, ARRUDA I D, STEFANI R. Active Chitosan/PVA Films with Anthocyanins from Brassica Oleraceae (Red Cabbage) as Time-Temperature Indicators for Application in Intelligent Food Packaging[J]. Food Hydrocolloids, 2015, 43: 180-188.
[20] WANG S, REN J, LI W, et al. Properties of Polyvinyl Alcohol/Xylan Composite Films with Citric Acid[J]. Carbohydrate Polymers, 2014, 103: 94-99.
[21] SIN L T, RAHMAN W, RAHMAt A R, et al. Detection of Synergistic Interactions of Polyvinyl Alcohol-Cassava Starch Blends Through DSC[J]. Carbohydrate Polymers, 2010, 79(1): 224-226.
[22] SUDHAMANI S R, PRASAD M S,SANKAR K U. DSC and FTIR Studies on Gellan and Polyvinyl Alcohol (PVA) Blend Films[J]. Food Hydrocolloids, 2003, 17(3): 245-250.
[23] JUBY K A, DWIVEDI C, KUMAR M, et al. Silver Nanoparticle-Loaded PVA/Gum Acacia Hydrogel: Synthesis, Characterization and Antibacterial Study[J]. Carbohydrate Polymers, 2012, 89(3): 906-913.
[24] NING W, YU J, MA X, et al. The Influence of Citric Acid on the Properties of Thermoplastic Starch/Linear Low-Density Polyethylene Blends[J]. Carbohydrate Polymers, 2007, 67(3): 446-453.
[25] HU Dong-ying, WANG Li-juan. Physical and Antibacterial Properties of Polyvinyl Alcohol Films Reinforced with Quaternized Cellulose[J]. Journal of Applied Polymer Science, 2016, 133(25): 1-8
[26] AMS A, MLN A, ASK A, et al. Preparation and Characterization of PVA-Ge/PEG-400 Biodegradable Plastic Blend Films for Packaging Applications[J]. Chemical Data Collections, 2020, 26: 100338.
Preparation and Biodegradability Evaluation ofPoly (Vinyl Alcohol) Antibacterial Film
ZOU Peng-peng, LIU Yu-qin, CHEN Ya-nan, CAI Jun
(School of Biological Engineering and Food, Hubei University of Technology, Wuhan 430068, China)
Using degradable material poly (vinyl alcoho1) as substrate, the paper aims to prepare the composite antibacterial film by addingsolution and study the effects of different concentrations ofon the physicochemical and functional properties of the blend film./PVA blend film was prepared by solvent casting. The physical mechanics, solubility, light transmittance, antibacterial and degradability of the blend films were investigated. Its structure was characterized by Fourier transform infrared spectroscopy, and scanning electron microscope. The addition ofweakened the intermolecular force of PVA, significantly increased the elongation at break from 202.77% to 398.82%, reduced the tensile strength, and formed a hydrogen bond betweenand PVA, reducing the dissolution of water to the film, and the solubility of the film decreased from 100% to 38.21%. With the increase ofconcentration, the light transmittance of the film decreased and the antibacterial activity was enhanced. Soil degradation test showes that/PVA blend membrane has good biodegradability. The mechanical properties and water resistance of/PVA blend film are improved, and the composite film has certain antibacterial and degradability. The preparation of the composite film provides an ideal choice for food packaging.
; poly (vinyl alcohol ); mechanical property; water resistance; biodegradable
TS206.4
A
1001-3563(2022)11-0031-07
10.19554/j.cnki.1001-3563.2022.11.005
2021–10–27
国家自然科学基金(31401807)
邹鹏鹏(1996—),男,湖北工业大学硕士生,主攻可降解包装材料。
蔡俊(1968—),男,博士,湖北工业大学教授,主要研究方向为新型酶制剂发酵技术。
责任编辑:曾钰婵

