多囊卵巢综合征子宫内膜容受性障碍机制研究进展
卢凤娟,丛晶,王宇,何慧,吴效科
(1.黑龙江中医药大学,哈尔滨 150006;2.黑龙江中医药大学附属第一医院,哈尔滨 150040)
多囊卵巢综合征(PCOS)是育龄期女性常见的内分泌疾病,临床上表现为月经不调(月经过少或闭经)、排卵异常以及卵巢多囊样改变等,是引起不孕和反复妊娠失败等不良生殖结局的重要因素[1]。优质的胚胎及良好的子宫内膜容受性是成功妊娠的前提,临床上PCOS患者通过促排卵治疗后排卵率虽有所提高,但低着床率、低妊娠率、高流产率的“高排低孕”问题仍然困扰着众多有生育需求的PCOS女性,同时也深刻影响着这类女性胚胎移植的成功率。子宫内膜容受性是指在一个严格调定期(植入窗)内的子宫内膜状态,此期子宫内膜已具备允许囊胚附着、穿透和诱导间质细胞局部发生蜕膜化的能力,这是确保胚胎成功着床、维持健康妊娠的关键因素。多项研究证实,PCOS患者的不良生殖结局与其子宫内膜容受性降低关系密切[2]。因此提高PCOS患者子宫内膜容受性已成为生殖领域亟待解决的问题。
一、内分泌紊乱对PCOS患者子宫内膜的影响
PCOS患者下丘脑-垂体-卵巢轴功能由于长期处于失调状态,导致体内激素分泌失衡而表现出典型的高雄激素血症及孕激素抵抗等,这是导致PCOS女性子宫内膜容受性障碍的重要因素,同时还会增加PCOS女性子宫内膜病变的风险。
1.高雄激素血症:高雄激素血症是PCOS重要的诊断标准之一,在PCOS患者中血清雄激素水平升高的发生率高达50%~90%[3]。研究发现,雄激素水平过高可通过干扰PCOS女性的子宫内膜内膜容受性和蜕膜化等途径对PCOS女性的生殖功能产生不利影响[4]。
生理情况下,子宫内膜基质在增殖期会受卵巢类固醇激素的影响,为蜕膜化及胚胎着床提供所需的糖原储备。葡萄糖调节蛋白78(GRP78)是子宫内膜基质细胞摄取葡萄糖过程中的重要物质。体外研究发现,睾酮暴露时会诱导基质细胞模型中GRP78蛋白含量减少,并认为PCOS伴有的高雄激素血症会通过下调GRP78蛋白的表达来影响子宫内膜稳态[5]。这提示PCOS女性伴有的高雄激素血症会阻碍其子宫内膜基质细胞对糖的摄入和利用,导致子宫内膜在蜕膜化过程中糖原供应不足使得子宫内膜发育不充分,有损着床期子宫内膜的形态和容受性。着床期是处于分泌期的子宫内膜接受囊胚的有限时间,其特征是雄激素水平低,此期子宫内膜新生血管活跃,相关因子表达升高,为胚胎发育和维持妊娠提供支持。其中,子宫自然杀伤细胞可促进子宫血管生成和子宫内膜蜕膜化,对母胎界面的交互调控有着重要作用[6]。动物实验发现,随着睾酮剂量的增加,伴有高雄激素血症的PCOS模型鼠的子宫内膜血管构建会逐渐紊乱,并呈剂量依赖性地下调子宫自然杀伤细胞的数量[7]。这说明PCOS女性伴有的高雄激素血症可通过减少子宫自然杀伤细胞的数量来影响子宫内膜血管的新生及修复,形成一种血供不足的胚胎发育环境,导致PCOS患者更易发生着床失败或孕后流产。
此外,雄激素的作用主要是由雄激素受体(androgen receptor,AR)介导的,且有研究认为AR会放大雄激素对子宫内膜的作用[8]。进而推测,AR既是雄激素作用于子宫内膜的主要靶向分子,同样也可以作为改善PCOS高雄激素血症的治疗靶点来降低其对子宫内膜容受性的影响。因此,研究AR对子宫内膜发育的作用机制,或许对改善PCOS患者子宫内膜容受性具有重要意义。
2.孕激素抵抗:生理状态下,孕激素在排卵后激增,可抑制雌激素介导的上皮细胞增殖,使子宫内膜腺体向分泌期转化,具有调控着床期子宫内膜环境的功能。分泌期子宫内膜在孕激素的作用下表现出蜕膜化反应及短暂的可接受性,这对胚胎的成功种植极其重要。而与健康女性相比,PCOS患者子宫内膜普遍存在明显的孕激素抵抗现象[9],一是由于其孕激素生成不足,即卵泡液中孕酮分泌量明显减少,黄体颗粒细胞合成孕激素的能力降低;二是PCOS患者的孕酮存在向雄激素转化的倾向。
孕激素调控子宫内膜周期性变化的功能有赖于孕酮受体(progesterone receptor,PR)。在分泌期,PCOS患者子宫内膜上皮细胞中的PR表达明显多于间质细胞,且间质细胞对孕激素呈低反应性,这使得孕激素对抗雌激素诱导上皮细胞增生的能力不足,进而阻碍了子宫内膜蜕膜化进程,甚至还会由于子宫内膜过度增生而发展为子宫内膜病变[10]。这可能解释了临床上PCOS患者虽进行了孕激素补充治疗但效果并不理想的原因。因此,在未来的研究中,需寻求一种更有效的方法,可以针对性地调整分泌期PCOS患者子宫内膜中PR受体在上皮细胞和间质细胞的分布情况。另外,PR有PRA和PRB两种亚型。动物研究发现,PCOS模型大鼠的子宫内膜中,PRA和PRB表达的升高与雌激素受体的表达升高相似[11]。在敲除PRA基因的小鼠子宫中添加孕激素,发现不能有效抑制雌激素诱导的细胞增殖,进而认为孕激素对雌激素的拮抗作用主要是通过PRA亚型介导的[12]。因此,明确PR亚型在孕激素调控子宫内膜蜕膜化过程中的作用机制,利用PR亚型的作用规律并对其进行有效干预,或许可有效改善PCOS患者子宫内膜间质细胞对孕激素的低反应性现象。
此外,孕激素抵抗还会影响PCOS女性子宫内膜容受性标志物的表达。如,胞饮突是子宫内膜上皮细胞顶部微绒毛融合而形成的膜状突起,其结构的生长及变性受孕激素、孕激素受体等调控。在正常情况下,胞饮突数量和密度的增加与子宫内膜着床期的开启具有同步性[13]。因此,胞饮突的数量和成熟度可以较好地反映着床期的子宫内膜容受性,且与胚胎种植率呈正相关[9]。而由于PCOS患者体内存在孕激素抵抗现象,这会导致胞饮突在着床期表达不良进而影响其可接受性子宫内膜的建立,是造成PCOS女性胚胎植入失败的重要原因。
二、代谢异常对PCOS患者子宫内膜的影响
PCOS女性普遍存在着代谢障碍,其中以胰岛素抵抗和肥胖最为常见,二者之间相互作用,严重影响着PCOS患者的疾病进程及生殖功能。
1.胰岛素抵抗:临床上,约60%~80%的PCOS患者存在胰岛素抵抗(insulin resistance,IR)和代偿性高胰岛素血症(hyperinsulinemia,HI)[14]。PCOS患者妊娠后其IR程度显著增加,并会通过多种途径在着床期影响子宫内膜环境,是阻碍胚胎植入、导致早期胚胎丢失的重要原因[15]。
IR及HI对PCOS患者子宫内膜容受性的影响包括以下3个方面:(1)破坏子宫内膜糖摄取。在生理上,子宫内膜具备完整的糖摄取机制,是促进及维持子宫内膜蜕膜化状态的关键,此过程由胰岛素介导功能正常发挥为前提。葡萄糖转运蛋白(glucose transporter,Glut)是胰岛素通路中的重要靶蛋白[16]。研究证实,与不伴IR的PCOS患者相比,伴有IR者的子宫内膜中Glut4的表达和葡萄糖摄取量均有所减少[17-18],这说明IR可引起PCOS患者子宫内膜中Glut4的表达降低进而导致子宫内膜糖摄取机制障碍。Qi等[18]的研究还发现,合并IR的PCOS患者子宫内膜皮质醇水平在着床期的表达会升高,并认为这可能会诱导或加重PCOS患者的IR程度。此外,当胰岛素的主要信号通路磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)被抑制时,人子宫内膜基质细胞中Glut1水平也会降低[19],而较高的IR会降低PI3K/Akt信号通路的表达[20]。(2)影响内分泌环境。PCOS患者伴有的IR及HI会与高雄激素血症相互影响并对其子宫内膜造成协调损害。IR及HI可直接或间接地通过胰岛素样生长因子刺激卵巢和肾上腺生成更多雄激素;抑制肝脏性激素结合球蛋白的合成与分泌从而使PCOS患者血清中的游离睾酮水平升高[21]。(3)诱发子宫内膜病变。伴有IR的PCOS患者子宫内膜与正常子宫内膜相比,更容易表现出子宫内膜增生、恶变和容受性降低的现象,且IR指数越高子宫内膜病变的恶性程度就越重[22]。
综上所述,IR及HI可被认为是导致PCOS患者代谢紊乱、子宫内膜容受性下降的核心因素之一。而目前针对胰岛素抵抗采用的治疗方法并不能很好地满足临床需要,因此在未来研究中,需要深化对IR机制及其信号通路的研究,以期更好地指导临床治疗。
2.肥胖:(1)炎症因子。肥胖是一种以慢性炎症为特征的代谢状态,这在肥胖型PCOS患者中表现更为明显[23]。其中常见的炎症细胞因子包括白细胞介素(IL)、肿瘤坏死因子等,这些炎症因子不仅能够降低PCOS患者的卵巢功能影响排卵,还会损害子宫内膜容受性[24]。有研究发现,伴有炎症介质紊乱的PCOS患者子宫内膜上皮细胞因子表达水平异常,不利于受精卵着床,并指出肥胖是加剧PCOS炎症程度的重要因素[25]。促炎细胞因子还能通过细胞增殖、血管生成对肿瘤产生影响,如IL-6、IL-8、肿瘤坏死因子等炎性细胞因子水平与子宫内膜病变之间存在显著相关性,且这种联系在很大程度上取决于肥胖程度;PCOS患者在纠正体质量指数后,与子宫内膜癌相关的炎症因子表达会减弱[26]。因而认为子宫内膜炎症是子宫内膜增生恶性肿瘤的重要因素,表明肥胖通过炎症反应在子宫内膜癌变中起作用[27]。此外,促炎细胞因子还能通过增加肿瘤坏死因子-α负向调节PCOS患者子宫内膜中胰岛素受体底物1的激活,从而干扰胰岛素信号的传导,不利于正常子宫内膜功能的建立而导致着床失败和流产[28]。以上研究说明,PCOS患者子宫内膜容受性降低与过高的炎性环境关系密切,而肥胖正是促炎细胞因子分泌异常的重要诱因。
(2)瘦素。瘦素是由脂肪细胞分泌的一种多肽激素,和脂肪含量呈正相关,瘦素与其受体结合后在激素分泌、生殖、炎症等生理系统及代谢途径中发挥作用。已有实验通过对比PCOS患者调整体质量指数前后的血清瘦素水平,发现其血清瘦素浓度会随体重的增加和胰岛素活性的降低而升高,并认为高瘦素水平与PCOS不孕有关[29]。子宫内膜中离子通道可以介导子宫内膜的功能,其中钠通道对子宫内膜的容受性和胚胎着床至关重要。研究发现,瘦素可以通过激活STAT3途径下调着床期子宫内膜上皮钠通道的表达,且瘦素水平越高抑制作用越强[30]。Chakrabarti等[31]认为,瘦素可被视为一种营养状况的代谢信号,可用于评估生殖功能。瘦素水平越高子宫内膜容受性就越差,这与其他研究发现的瘦素水平紊乱可能会影响子宫内膜容受性和胚胎着床的观点相一致[32]。这些研究说明,肥胖能够导致PCOS患者体内瘦素水平升高,进而直接或间接地降低其子宫内膜容受性。
因此,减肥可作为改善PCOS患者子宫内膜容受性、提高其生育能力的一种辅助疗法。临床上多鼓励PCOS女性改变生活方式,如改善饮食结构等,但目前对于哪种膳食成分对改善PCOS临床症状有益仍未可知,所以建议开展更多与PCOS膳食有关的研究,以更好地指导PCOS女性的膳食管理。
三、自噬异常对PCOS子宫内膜容受性的影响
自噬是真核细胞维持内环境稳态的一种平衡机制,与细胞的凋亡关系密切,可通过降解不必要或受损的细胞内物质来维持细胞正常生理活动以及稳定的细胞代谢过程[33]。在生殖方面,正常的自噬水平有助于卵母细胞的发育和成熟,并可调节子宫内膜功能,是子宫内膜蜕膜化过程中不可缺少的部分[34]。
围着床期子宫内膜自噬水平表现为动态模式,自噬相关基因在着床期前的子宫内膜中表达较高,在着床期自噬标志分子会随胚胎的黏附及蜕膜化的发生逐渐下降。采用自噬抑制剂进行干预后,蜕膜化标志物和孕酮受体的表达明显降低,子宫内膜蜕膜化受损[35],说明自噬参与孕早期子宫内膜蜕膜化的发生,若着床期自噬水平异常降低将不利于蜕膜化形成,进而影响胚胎着床。子宫内膜细胞的自噬受到卵巢激素的调控。研究发现,PCOS患者血清游离雄激素指数与子宫内膜自噬水平呈负相关,并认为PCOS患者雄激素利用率的升高会下调子宫内膜自噬水平[36],推测这可能是造成PCOS患者子宫内膜容受性降低的一个重要因素。在不同PCOS子宫内膜病变类型中,自噬相关基因表达水平存在显著差异,即表达水平越低子宫内膜病理类型越差,预后也越差[37]。可见,PCOS患者子宫内膜存在的自噬异常现象可对PCOS患者子宫内膜容受性产生不良影响,参与胚胎着床失败及早期流产的发生。
PCOS患者子宫内膜容受性障碍的发生与多种因素关系密切。高雄激素血症和胰岛素抵抗是导致PCOS子宫内膜容受性障碍的核心影响因素,其中高雄激素血症可通过促进脂肪分解使血脂水平升高来刺激胰岛素的分泌;胰岛素抵抗又会通过刺激卵巢和肾上腺生成更多雄激素,或抑制肝脏性激素结合蛋白的分泌与合成来增加血清雄激素水平;PCOS患者存在的孕激素抵抗现象使得孕酮向雄激素的转化增加,使得血清中游离睾酮水平升高;PCOS患者伴有的高雄激素血症又会影响子宫正常的自噬水平。胰岛素抵抗和肥胖是导致PCOS患者代谢紊乱的关键因素,二者又可相互作用对子宫内膜造成协同损害(图1)。
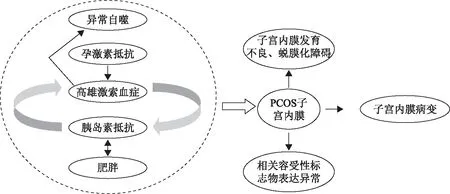
图1 PCOS患者子宫内膜容受性障碍可能机制
综上所述,PCOS的发病机制与内分泌轴及生殖轴功能紊乱关系密切,还与遗传、生活习惯等因素相关,其病因的多样性决定了PCOS患者子宫内膜容受性降低发病机制的复杂性。通过研究PCOS患者子宫内膜容受性降低的相关机制,寻找临床提高PCOS患者子宫内膜容受性的治疗靶点,对改善其生殖结局具有重要意义。然而对其具体发病机制的研究目前尚无定论,对各因素之间潜在的相互交叉作用更是未知,这在很大程度上限制了PCOS的临床治疗方法的选择。未来需要用更加先进的手段,例如基于高通量技术的转录组、蛋白质组等组学技术,对PCOS患者子宫内膜容受性降低进行更加精准的研究,从而为治疗PCOS患者的不孕症难题提供思路。

