沉默DNMT3a表达对银屑病样细胞周期进展和细胞增殖的抑制作用及其机制
潘延斌,苏家光,谭美乐,杨 猛,覃文飞,黄榆秀,蒙世豪,黄耀辉,梁坚强,苏雪芳,黄姿婵,李建民
(1.广西医科大学第三附属医院皮肤科,广西 南宁 530031;2.广西医科大学第一附属医院皮肤科,广西 南宁 530021)
银屑病是一种慢性炎症性皮肤病,其主要病理特征为角质形成细胞的过度增殖、细胞周期缩短和细胞对凋亡信号的抵抗性增加等[1]。银屑病在人群中具有较高的发病率和复发率,严重影响患者的健康和生活质量[2]。但迄今为止银屑病的病因及其分子机制尚不清楚,这导致临床现有的治疗手段均不理想。因此积极探讨细胞增殖/凋亡失衡和异常细胞周期进展的分子机制对更好地认识银屑病的致病机制有至关重要的作用。
近年来随着对银屑病研究[3]的深入,人们发现DNA甲基化异常在银屑病的发病机制中起重要作用。而DNA甲基化需要在DNA甲基化转移酶(DNA methyltransferases,DNMTs)的催化下进行特定的化学修饰以完成目的基因的甲基化修饰,从而调控后者的表达及功能[4]。既往研究[5]显示:在银屑病患者皮损组织中存在DNA甲基化转移酶3a(DNA methyltransferase 3a,DNMT 3a)异常高表达现象,提示银屑病表皮中存在某些基因的甲基化水平异常。Yes-相关蛋白(Yes-associated protein,YAP)是Hippo信号通路中一个关键组分,研究[6]显示:YAP在细胞增殖、细胞凋亡和组织生长发育等细胞生物学进程中具有重要作用。最近有研究[7]显示:在银屑病患者皮损组织中YAP蛋白的表达异常增加,同时沉默YAP在角质形成细胞HaCaT中的表达能够通过抑制细胞周期进展来调节细胞增殖/凋亡的失衡现象。大肿瘤抑制基因1(large tumor suppressor gene 1,LATS1)同样也是Hippo信号通路中的关键因子,作为YAP蛋白的上游基因,其被证实能够在体内外调控YAP基因的转录并抑制YAP蛋白介导的促增殖作用[8]。然而,LAST 1基因启动子区存在大量可发生甲基化的Cp G岛,因此LAST 1基因极易发生甲基化而失活,进而失去对YAP基因的抑制作用[9]。然而,尚无相关研究显示在银屑病中DNMT 3a是否是通过改变LAST 1启动区甲基化水平而减弱其对YAP基因的表达抑制作用,从而导致角质形成细胞增殖和凋亡的失衡。本研究检测银屑病患者皮损组织中DNMT 3a的表达和LAST 1的甲基化水平,并在体外诱导建立银屑病样细胞模型以明确DNMT 3a与LAST 1/YAP信号通路之间的关系。
1 资料与方法
1.1 一般资料收集2018年5月—2019年5月于广西医科大学第三附属医院皮肤科就诊的15例寻常型银屑病患者的斑块样皮损组织作为银屑病组,其中男性9例,女性6例,平均年龄18~49岁。另于广西医科大学第三附属医院泌尿外科和整形外科收集年龄和性别相匹配的15名研究对象的健康皮肤组织作为对照组。15例银屑病患者的银屑病皮损 程 度(psoriasis area and severity index,PASI)评分为2.7~44.6分,皮损组织取材于四肢近端伸侧或躯干部位。所有受试者均为本地长期居住人群。纳入标准:①银屑病组患者均符合银屑病临床和病理诊断标准,病程均>3个月,且1个月内未系统用药,2周内未使用外用药物。②所有受试者均未并发其他系统如心脑血管、呼吸、消化和免疫等相关疾病及肿瘤,排除妊娠及哺乳者;③所有受试者病史资料完善,且自愿参加本实验,并签署知情同意书。本研究经广西医科大学第三附属医院伦理委员会审批。
1.2 细胞、主要试剂和仪器人永生化角质形成细胞HaCaT购自中科院上海细胞所。DMEM培养液、Opti-MEM培养液和胎牛血清(fetal bovine serum,FBS)(美国Gibico公司),含EDTA的0.25%胰蛋白酶(美国Hyclone公司),CCK-8试剂(美国Sigma公司),TRIzol、逆转录试剂盒、BCA试剂盒和EdU试剂盒(美国Thermo公司),SYBR Green实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)试剂盒(上海索莱宝生物公司),转染试剂脂质体Lipofectamine3000(美国Invitrogen公司),含沉默DNMT 3a的siRNA(si-DNMT 3a)和siRNA阴性对照序列(si-NC)质粒(广州锐博生物公司),PCR和甲基化特异性PCR(methy lation specific PCR,MSP)引物(上海生工公司),DNA提取试剂盒(美国Tiangen生物公司),甲基化试剂盒(美国Zymo Research公司),AnnexinⅤ-FITC/PI凋亡检测试剂盒(江苏碧云天公司),细胞周期检测试剂盒(美国BD公司),MSP相关试剂(日本TaKaRa公司),兔抗DNMT 3a、LATS1、YAP1和β-actin单克隆抗体(美国Santa Cruz公司),兔抗Cyclin D1、CDK6、cleaved caspase-3单克隆抗体(美国Abcam公司),HRP标记的山羊抗兔IgG二抗(北京中杉金桥生物有限公司)。流式细胞仪(美国BD Biosciences公司),超净工作台(美国Thermo公司),PCR仪、RT-qPCR仪和凝胶成像系统(美国Bio-Rad公司)。
1.3 皮肤组织标本处理采用0.25%分散酶消化上述收集的皮肤组织标本14~20 h以完全分离表皮组织,取约3 mL含EDTA的0.25%胰蛋白酶消化上述分离的皮肤组织后,在研磨器中进行组织匀浆以备后续实验使用。
1.4 细胞培养、转染和分组常规复苏HaCaT细胞后采用含10%FBS和1%青-链霉素的DMEM培养基于37℃、5%CO2恒温培养箱培养。取生长汇合至80%的HaCaT细胞,调整细胞密度至2×105个/孔,接种至6孔板中培养过夜,次日参考转染试剂 Lipofectamine3000说明书,将 50 ng si-DNMT 3a或si-NC质粒分别转染入HaCaT细胞中,转染6 h后将培养基更换为含10%FBS的DMEM常规培养基。转染48 h后更换为含2 mg·L-1嘌呤霉素筛选细胞,以建立稳定转染细胞系。参考文献[10],采用M 5培养法诱导HaCaT细胞48 h后,建立银屑病样HaCaT细胞模型。按处理条件的不同将HaCaT细胞分为:M 5培养诱导的HaCaT细胞(对照组)、采用M 5培养诱导的经转染si-DNMT 3a质粒的HaCaT细胞(si-DNMT 3a组)、采用M 5培养诱导的经转染si-NC质粒的HaCaT细胞(si-NC组)和正常培养的HaCaT细胞(HaCaT组)。将上述各组细胞培养于37℃、5%CO2恒温培养箱中,若无特殊说明,取培养24 h后的细胞进行相关实验。
1.5 RT-qPCR法检测2组研究对象表皮组织细胞中DNMT 3a m RNA表达水平按照TRIzol法提取表皮组织和各组细胞中的总RNA,分光光度计检测RNA纯度和浓度。采用逆转录试剂盒将RNA逆转录为cDNA。根据SYBR Green Real-time PCR试剂说明书和预实验确定的反应时间及温度进行RT-qPCR。RT-qPCR引物序列:DNMT 3a上游引物 5′-GGACAAGAATGCCACCAAATCA-3′,DNMT 3a下 游 引 物5′-CTTGCCGTCTCCGAACCA-3′;GAPDH上 游 引 物5′-CAAATTCATTGTCGTACCAG-3′,下 游 引 物5′-ACACTCACTCTTCTACCTTTG-3′。以GADPH为内参,采用2-ΔΔCt法分析目的基因的表达水平。上述实验单独重复3次。
1.6 CCK-8法检测各组细胞增殖率取上述各组细胞,常规消化细胞后接种至96孔板中,调整细胞密度至1×104个/孔,并向每孔加入200μL含10%FBS的DMEM培养液,培养过夜后,分别于12、24、36和48 h时向每孔加入10μL CCK-8试剂,培养箱中孵育2 h后,于酶标仪490 nm处检测每孔吸光度(A)值,每个浓度每组设置5个复孔,计算细胞增殖率。细胞增殖率=(实验组A值-对照组A值)/对照组A值×100%。绘制各组细胞的生长曲线。
1.7 Ed U染色检测各组细胞增殖率取上述各组细胞,接种至铺有盖玻片的24孔板中,每孔加入1 mL含10%FBS和1%青-链霉素的DMEM培养液,置于37℃、5%CO2培养箱中培养,按照试剂盒说明书检测培养48 h的细胞增殖率。在离观察终点2 h前向培养基中加入终浓度为50μmol·L-1的Ed U溶液,4%多聚甲醛固定细胞30 min,每孔加入200μL Apollo染色反应液避光孵育30 min,加入Hoechst3342作用30 min,置于荧光显微镜下采用550 nm的激发光观察Appolo567染色,采用350 nm的激发光观察Hoechst3342染色,最后拍照计算细胞核(Hoechst)与增殖细胞(Appolo)染色的细胞数,Appolo/Hoechst比值的百分率为Edu阳性表达率,以此代表细胞增殖率。每组设置5个复孔,实验单独重复3次。
1.8 流式细胞术检测不同细胞周期各组细胞百分率取上述各组细胞,4℃预冷的PBS轻轻洗涤细胞后,进行常规消化,300 g离心5 min,弃上清,收集细胞,加入500μL PBS重悬细胞,并迅速加入3.5 mL-20℃预冷的70%酒精,将细胞吹打均匀后,于4℃固定过夜。PBS洗涤细胞3次,按上述方法离心后以充分去除固定液,随后按照细胞周期流式检测试剂盒的说明方法进行操作,加入500μL PI/RNase染色液,4℃条件下避光孵育30 min。采用流式细胞术检测不同细胞周期各组细胞百分率。实验单独重复3次。
1.9 AnnexinⅤ-FITC法检测各组细胞凋亡率取上述各组细胞,800 g离心5 min,弃上清,4℃预冷的PBS洗涤细胞2次,再次离心后,收集细胞沉淀,采用195μL AnnexinⅤ-FITC结合液重悬细胞,并调整细胞至7×105mL-1。并依次加入5μL AnnexinⅤ-FITC和10μL碘化丙啶(propidium iodide,PI)染色液,轻轻摇晃离心管以充分混匀后,室温下避光孵育30 min。300目滤膜过滤细胞团块后,进行流式细胞术检测。实验单独重复3次。
1.10 MSP法检测各组细胞中LATS1基因的甲基化水平按照DNA提取试剂盒说明书方法提取银屑病组患者皮损组织和对照组研究对象表皮组织的基因组DNA,紫外分光光度计检测DNA的纯度和浓度后,按照甲基化试剂盒说明书方法进行基因组DNA进行重亚硫酸盐修饰。MSP引物:LATS1甲基化上游引物5′-GAACGATAAGAGTTGCGGGCGCC-3′,LATS1甲基化下游引物5′-AACAATTCCCGACGTCGCTTTCG-3′;LATS1非甲基化上 游 引 物LATS1 5′-TGATTGATTAGAGTCGTGGGTGAT-3′,LATS1非甲基化下游引物5′-AATCATTTCCCAACATCATTTACA-3′。取扩增产物于含EB的2%琼脂糖凝胶中电泳。采用凝胶成像系统拍照。采用甲基化引物扩增出产物则表示待测基因组存在DNA甲基化,若采用非甲基化引物扩增出产物则表示不存在DNA甲基化,若均扩增出产物即为部分甲基化。采用PyroMark Q48-CpG软件自动分析2组研究对象表皮组织中LATS1基因每个位点的甲基化水平。
1.11 Western blotting法检测各组细胞中目的蛋白表达水平取上述各组细胞,4℃预冷的PBS洗涤细胞3次后,加入RIPA细胞裂解液和蛋白酶抑制剂进行提取细胞中总蛋白。BCA法进行蛋白定量。取30μg蛋白进行SDS-PAGE分离蛋白,采用湿转法将分离蛋白转至PVDF膜上,5%脱脂牛奶于室温下封闭2 h后,分别加入DNMT 3a(1∶300)、LATS1(1∶300)、YAP1(1∶300)、Cyclin D1(1∶500)、CDK6(1∶500)、cleaved caspase-3(1∶500)和β-actin(1∶1 000)一抗,4℃摇床孵育过夜。TBST溶液清洗3次,每次5 min,以辣根酶标记的二抗(1∶5 000)室温孵育1 h,以TBST溶液清洗3次,每次5 min。最后均匀滴加ECL发光液后于凝胶成像仪曝光拍照。采用Image J软件分析条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参β-actin条带灰度值。以上实验单独重复3次。
1.12 统计学分析采用SPSS 19.0统计软件和GraphPad Prism 5.0统计软件进行统计学分析。2组研究对象皮肤组织中DNMT 3a mRNA表达水平,各组细胞中DNMT 3a mRNA和蛋白表达水平,细胞增殖率,Ed U阳性表达率,不同细胞周期细胞百分率,细胞凋亡率和细胞中LATS1、YAP1、Cyclin D1、CDK6和cleaved caspase-3蛋白表达水平均符合正态分布且方差齐,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSDt检验。2组研究对象皮肤组织中LATS1基因的甲基化水平以百分率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 2组研究对象皮肤组织中DNMT 3a m RNA表达水平与对照组比较,银屑病组患者皮肤组织中DNMT 3a mRNA表达水平明显升高(P<0.01)。见图1。

图1 RT-qPCR法检测对照组和银屑病组研究对象皮肤组织中DNMT 3a mRNA表达水平Fig.1 Expression levels of DNMT 3a mRNA in epidermal tissue of subjects in control group and psoriasis group detected by RT-qPCR method
2.2 各组HaCaT细胞中DNMT 3a mRNA表达水平与HaCaT组比较,si-NC组HaCaT细胞中DNMT 3a mRNA表 达 水 平 降 低(P<0.05),si-DNMT 3a组HaCaT细胞中DNMT 3a mRNA表达水平差异无统计学意义(P>0.05)。见图2。

图2 RT-qPCR法检测各组HaCaT细胞中DNMT 3a mRNA表达水平Fig.2 Expression levels of DNMT 3a mRNA in HaCaT cells in various groups detected by RT-qPCR method
2.3 各组HaCaT细胞增殖率和Ed U阳性率与HaCaT组比较,对照组、si-NC组和si-DNMT 3a组HaCaT细胞增殖率随时间的延长而不断增加,其中以48 h时HaCaT细胞增殖率升高最为明显(P<0.01);与对照组和si-NC组比较,si-DNMT 3a组HaCaT细胞增殖率降低(P<0.05)。见图3。EdU实验结果显示:与HaCaT组(21.05%±7.06%)比较,对照组(82.24%±16.10%)、si-NC组(75.39%±15.42%)和si-DNMT 3a组(58.11%±13.79%)HaCaT细胞中Ed U阳性率明显升高(P<0.05),而si-DNMT 3a组HaCaT细胞中Ed U阳性率明显低于对照组和si-NC组(P<0.05)。见图4。

图3 CCK-8法检测各组HaCaT细胞增殖率Fig.3 Proliferation rates of HaCaT cells in various groups detected by CCK-8 method

图4 Ed U染色法检测各组HaCaT细胞的增殖活力(×200)Fig.4 Proliferation activities of HaCaT cells in various groups detected by EdU staining(×200)
2.4 不同细胞周期各组HaCaT细胞百分率与HaCaT组比较,对照组、si-NC组和si-DNMT 3a组G1期HaCaT细胞百分率明显降低(P<0.05),S期HaCaT细胞百分率明显升高(P<0.01);与对照组和si-NC组比较,si-DNMT 3a组G1期HaCaT细胞百分率明显升高(P<0.05),但S期HaCaT细胞百分率降低(P<0.05)。见图5和6。

图5 流式细胞术检测不同细胞周期各组HaCaT细胞百分率Fig.5 Percentages of HaCaT cells at different cell cycles in various groups detected by flow cytometry
2.5 各组HaCaT细胞凋亡率对照组、si-NC组和si-DNMT 3a组HaCaT细胞凋亡率分别为(10.18±4.26)%、(2.71±0.62)%、(3.16±0.89)%和(5.48±1.23)%。与HaCaT组比较,对照组、si-NC组和si-DNMT 3a组HaCaT细胞凋亡率降低(P<0.05);与对照组和si-NC组细胞比较,si-DNMT 3a组HaCaT细胞凋亡率明显升高(P<0.05)。见图7。

图7 流式细胞术检测各组HaCaT细胞凋亡率Fig.7 Apoptotic rates of HaCaT cells in various groups detected by flow cytometry

图6 不同细胞周期各组HaCaT细胞百分率Fig.6 Percentages of HaCaT cells at different cell cycles in various groups
2.6 2组研究对象皮肤组织中LAST 1启动子区甲基化水平MSP实验结果显示:与对照组[6.7%(1/15)]比较,银屑病组患者皮肤组织中LAST 1启动子区甲基化水平[33.3%(5/15)]明显升高(P<0.01)。见图8。

图8 MSP法检测2组研究对象皮肤组织中LAST 1启动子区甲基化水平Fig.8 Methylation levels of LAST 1 promoter in epidermal tissue of subjects in two groups detected by MSP method
2.7 各组HaCaT细胞中DNMT 3a蛋白和LAST 1/YAP信号通路及细胞周期相关蛋白表达水平与HaCaT组比较,对照组和si-NC组HaCaT细胞中DNMT 3a蛋白表达水平明显升高(P<0.05),si-DNMT 3a组HaCaT细胞中DNMT 3a蛋白表达水平明显降低(P<0.01);与HaCaT组比较,对照组、si-NC组和si-DNMT 3a组HaCaT细胞中YAP1蛋白和细胞周期相关蛋白Cyclin D1及CDK6表达水平明显升高(P<0.05),LATS1蛋白和凋亡相关蛋白cleaved caspase-3表达水平明显降低(P<0.05);与对照组和si-NC组比较,si-DNMT 3a组HaCaT细胞中YAP1、Cyclin D1和CDK6蛋白表达水平降低(P<0.05),LATS1及cleaved caspase-3蛋白表达水平升高(P<0.05)。见图9。
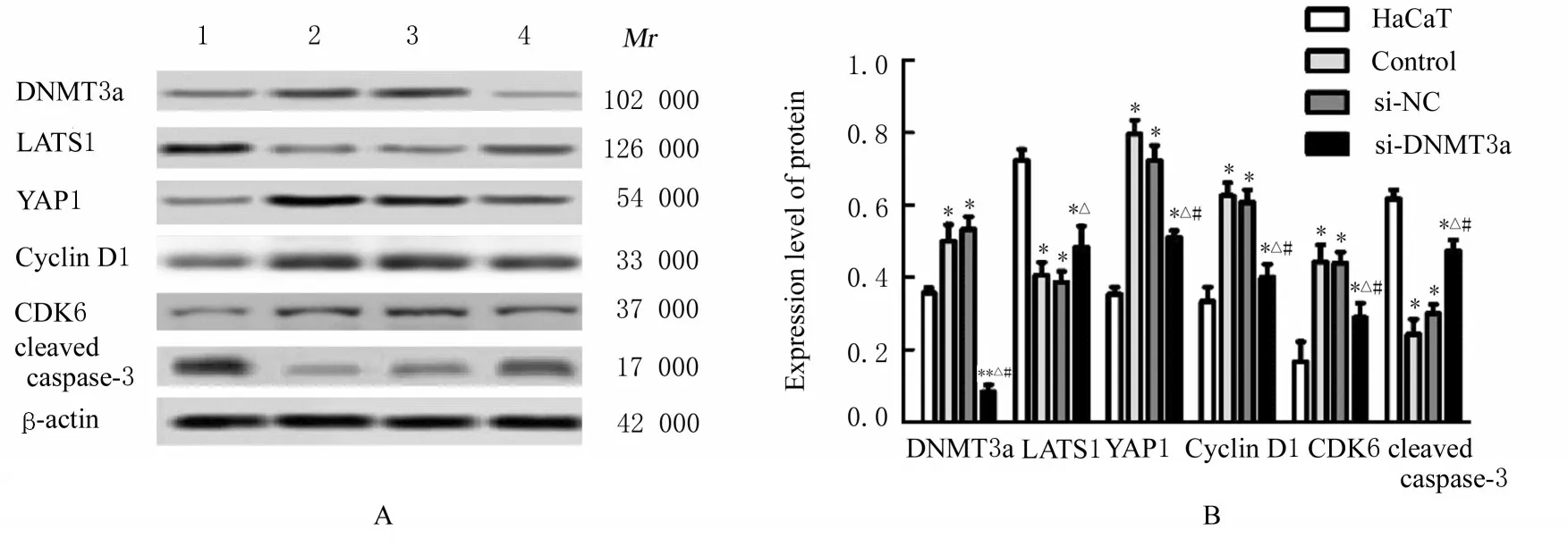
图9 Western blotting法检测各组HaCaT细胞中LAST 1/YAP信号通路和细胞周期相关蛋白及凋亡相关蛋白表达电泳图(A)和直条图(B)Fig.9 Elctrophoregram(A)and histogram(B)of expressions of LAST 1/YAP signaling pathway and cycle-related proteins and apoptosis-related proteins of HaCaT cells in various groups detected by Western blotting method
3 讨 论
银屑病中角质形成细胞具有类似肿瘤细胞的增殖过度、细胞周期缩短和抗凋亡信号等恶性细胞特性[11]。近年来,肿瘤相关调控因子和分子信号通路在银屑病中作用的研究引起了广泛关注。Hippo信号通路最早在果蝇中被发现并报道,但随着研究的深入,学者发现这条高度保守的信号通路在哺乳动物生长发育过程中同样起关键作用,如Hippo信号通路能够精确调控器官的发育和组织再生,该通路的异常将导致细胞增殖活跃,凋亡水平降低,进而导致器官或组织的过度生长[12-13]。LATS1基因作为Hippo信号通路中的关键信号传导因子,在正常生理状态下,上游信号激活并磷酸化LATS1,并形成以其为中心的1个复合体,继而磷酸化下游靶基因YAP(主要为YAP1),磷酸化的YAP1被滞留于胞浆中,从而阻滞了YAP1/TEAs信号的传导[8]。当LAST 1基因缺失或低表达时,无法继维持YAP1的续磷酸化状态,而未磷酸化的YAP1能够被顺利转运至细胞核,与TEAs元件结合后启动促进细胞增殖和存活的基因表达[12],表明Hippo信号通路主要通过LATS1的激活来抑制YAP的表达,使其磷酸化而不能传导相关信号的表达,从而调控细胞及组织的生长发育。研究[9]显示:LATS1的突变或失活主要是由其基因启动子区的甲基化造成,如在肾癌和肝癌等肿瘤组织中均出现LATS1的高甲基化水平。
DNA甲基化是一种重要的表观遗传学调控机制,近年来研究[3,14]显示:银屑病中存在大量基因甲基化水平的改变。如ZHANG等[15]采用甲基化DNA免疫沉淀测序结果显示:与银屑病患者非皮损处组织比较,皮损组织中几乎全基因组的甲基化水平均发生明显改变,其中以TIMP2和PDCD5的甲基化程度最为明显。经治疗后,皮损组织中DNA甲基化模式发生逆转,即出现去甲基化改变,说明DNA甲基化影响银屑病的发生发展。DNMTs是DNA甲基化过程中起重要调控作用的酶,其能够将S-腺苷甲硫氨酸提供的甲基以共价结合的方式转移至目的基因胞嘧啶的第5位碳原子上,生成5-甲基胞嘧啶。在哺乳动物中DNMTs主要 包括DNMT 1、DNMT 3a和DNMT 3b[16-18]。在银屑病中,研究者[19]发现:DNMT 3a在皮损组织中的表达明显增加,而这与银屑病中存在大量的基因甲基化水平异常的现象高度相关。
本研究结果显示:沉默DNMT 3a能明显降低HaCaT细胞的增殖,抑制HaCaT细胞周期进展并促进其发生凋亡。MSP实验结果表明:银屑病皮损组织中LATS1基因启动子区的甲基化水平较正常健康人群明显升高,且Western blotting实验结果同样证实:在HaCaT细胞中LATS1蛋白表达水平较正常培养的HaCaT细胞明显降低,而沉默DNMT 3a后HaCaT细胞中LATS1蛋白表达水平明显升高,YAP1蛋白表达水平却明显降低,细胞周期相关蛋白Cyclin D1和CDK6表达水平也随之降低,但凋亡相关蛋白cleaved caspase-3表达水平明显升高。YAP1作为Hippo信号通路中的关键因子,其在多种肿瘤中被视为癌基因,下调YAP1的表达能够抑制胰腺癌、肝癌、前列腺癌和骨肉瘤等肿瘤细胞的增殖,因此也被认为是这些肿瘤的潜在治 疗 靶 点[20-23]。而 最 新的 研 究[7,10]同 样 证 实:在银屑病皮损组织中异常增加的YAP1蛋白同样能够促进角质形成细胞的增殖,细胞周期进展,并抑制其凋亡,而该研究团队还发现丹参素能够通过下调银屑病样细胞中YAP1的表达,从而抑制其上述作用。
综上所述,沉默在银屑病皮损组织中高表达的甲基化转移酶DNMT 3a,可能通过降低LATS1的甲基化水平以下调YAP1的表达,从而抑制细胞周期进展和细胞增殖,并促进细胞凋亡。本研究结果进一步证实甲基化在银屑病发生发展中的作用,并为LATS1/YAP信号通路作为银屑病治疗的潜在靶点提供了依据。

