miRNA-138-5p过表达对香烟烟雾暴露所致大鼠睾丸支持细胞损伤的调控作用
仲春雪,徐 华,张 晨,何丽娟,4
(1.新疆医科大学第五附属医院教学科研办公室和中心实验室,新疆 乌鲁木齐 830054;2.新疆医科大学第一附属医院生殖助孕中心,新疆 乌鲁木齐 830054;3.新疆医科大学公共卫生学院社会医学教研室,新疆 乌鲁木齐 830054;4.新疆医科大学药学院博士后流动站,新疆 乌鲁木齐 830054)
烟草中含有多种有害成分,现有研究[1-2]表明:13%的男性不育症归因于吸烟,而育龄男性(20~39岁)中吸烟者占46%。这也引起了对于吸烟所致男性生殖毒性的关注。精子发生是处于睾丸曲细精管中的精原细胞增殖、分化形成成熟精子的过程[3]。长期大量吸烟可产生睾丸毒性,使睾丸正常的精子发生过程受到干扰,造成精液质量降低和精子受精能力下降而影响男性生育力[4]。精子发生过程离不开支持细胞,支持细胞结构的完整性为精母细胞顺利减数分裂形成精子提供了必要保障。微小RNAs(microRNAs,miRNAs)参与生物体细胞周期、细胞增殖、细胞分化和细胞凋亡等重要的生物学过程[5],并作为重要的表观遗传因子在雄性生物睾丸的正常发育和精子发生过程的调控中发挥重要作用[6-7]。然而与吸烟所致睾丸毒性损伤有关的微小RNA(microRNA,miRNA)及其调控机制尚不清楚,因此本课题组前期采用miRNA高通量芯片测序技术筛选出了5条在香烟烟雾暴露后睾丸组织差异性表达的miRNA,选择表达下调的微小RNA 138-5p(microRNA 138-5p,miR-138-5p)进行后续研究;对差异性miRNA的靶基因进行预测和功能分析后发现:其靶基因参与了细胞凋亡的调控过程。虽然以往有研究[8]显示:miR-138-5p参与肿瘤细胞的调控过程,然而关于miR-138-5p在吸烟所致睾丸细胞损伤中的具体调控机制尚不清楚。本研究通过体内和体外实验验证香烟烟雾暴露对大鼠睾丸支持细胞的损伤作用,并分析miRNA-138-5p在其中发挥的重要调控作用,寻找吸烟所致雄性生物生殖损伤的生物标志物,为临床诊断和治疗提供依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器200只SPF级雄性SD大鼠,体质量180~220 g,购自新疆维吾尔自治区实验动物研究中心,动物生产许可证号:SCXK(新)2015-0004,动物使用许可证号:SYXK(新)2015-000,饲养于新疆医科大学实验动物中心,饲养温度为20℃~25℃、相对湿度为40%~70%。大鼠抑制素B酶联免疫吸附测定盒购自武汉伊莱瑞特生物公司,波形蛋白一抗购自武汉Bioworld公司,AnnexinⅤ-FITC/PI试剂盒购自上海贝博生物公司,TUNEL染色试剂盒和细胞凋亡检测试剂盒(型号C1086)购自上海碧云天生物技术公司,Bulge-Loop™miRNA试剂盒、miScript逆转录试剂盒和miScript SYBR Green PCR试剂盒购自美国Qigen公司。细胞培养箱、酶标检测仪、流式细胞仪(BD-FACSVerse)和Real-time检测仪(ABI-7500)购自美国Thermo公司。
1.2 动物分组和香烟烟雾的干预方法依照实验设计分为2、4、6、8和12周香烟暴露组,其中每个时间香烟暴露组中又分为对照组和低、中、高剂量香烟暴露组(分别给予每只大鼠每天10、20和30支香烟),共计20组,随后将雄鼠随机分至各组,每组10只。本研究经新疆医科大学第一附属医院伦理委员会审批(审批证号:IACUC-20151105011)。受试物选择某卷烟厂生产的过滤嘴香烟(CO含量为12 mg/支,焦油量为11 mg/支,烟碱量为1.0 mg/支)。本研究预先准备80 cm×60 cm×80 cm的静式染毒箱,将低剂量香烟暴露组大鼠置入箱中,密闭状态下将10支香烟滤嘴依次插入下侧的进气道并点燃,待香烟充分燃尽后取出大鼠。中剂量香烟暴露组按以上方法燃尽10支香烟后开箱通风10 min,继续点燃10支香烟直至燃尽。高剂量香烟暴露组大鼠染毒方法以此类推。对照组雄鼠置于同样的染毒箱中,但不进行任何处理。染毒过程中实时监测染毒箱内的总悬浮颗粒物和CO浓度。连续每日染毒,2、4、6、8和12周时分别麻醉处死各组大鼠,摘取双侧睾丸。一侧大鼠睾丸组织置入-80℃冻存备用,另一侧睾丸组织置入4%多聚甲醛中固定后备用。
1.3 各组大鼠血浆中抑制素B水平检测在空白孔、标准品孔和待测样品孔分别加入100μL工作液,37℃孵育60 min后洗板3次并甩干;各孔加入100μL酶结合物工作液,孵育30 min后洗板5次;加入90μL底物溶液,37℃避光孵育15 min;最后加入50μL终止液,于450 nm波长处检测吸光度(A)值,将样品的A值代入标准曲线的拟合方程式,计算大鼠血浆中抑制素B水平。
1.4 实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)法检测各组大鼠睾丸组织中miR-138-5p表达水平采用Bulge-Loop™miRNA试剂盒、miScript逆转录试剂盒和miScript SYBR®Green PCR试剂盒分别提取睾丸组织的miRNA、并进行逆转录和荧光定量分析。miR-138-5p正 向引 物:5′-AGCTGGTGTTGTGAATCAG-3′,miR-138-5p反 向 引 物:5′-CAGTGCGTGTCGTGGAGT-3′;内 参U 6正 向 引 物:5′-CTCGCTTCGGCAGCACA-3′,U 6反向引物:5′-AACGCTTCACGAATTTGCGT-3′。采 用2-△△Ct法计算miR-138-5p表达水平。
1.5 免疫组织化学法检测各组大鼠睾丸支持细胞中波形蛋白表达水平对各组大鼠睾丸组织切片行烤片、梯度脱蜡、去除内源性过氧化物酶及抗原修复处理后,加入波形蛋白一抗(1∶200),继续滴加二抗,37℃孵育20 min后加DAB显色,将切片依次放入苏木素复染7 min,盐酸乙醇分化5 s,PBS洗片5 min;再经梯度脱水后封片,在光镜下观察大鼠睾丸组织中波形蛋白表达情况,采用Cells Sens生物医学图像分析系统计算免疫组织化学法检测的波形蛋白表达水平。
1.6 香烟烟雾提取物(cigarette smoke extract,CSE)的制备将燃烧的香烟经负压吸引器连续抽吸至磷酸盐缓冲液中形成悬液(3支·mL-1),3 min燃尽,悬液采用1 mmol·L-1NaOH调节p H值为7.0,经0.22μm微孔过滤膜除菌过滤形成CSE原液。
1.7 细胞培养和CSE干预小鼠睾丸TM 4支持细胞购自中国典型培养物保藏中心(China Center for Type CultureCollection,CCTCC),加入含10%胎牛血清的DMEM培养基,在37℃、5%CO2培养箱中培养。待细胞融合至70%~80%,采用PBS液洗涤2次。将制备好的CSE原液采用培养基稀释至5%(5%CSE组)和10%(10%CSE组),并设对照组(0%CSE组),进行分组干预,24 h后进行后续细胞实验。
1.8 MTT法检测各组大鼠睾丸TM 4细胞存活率CSE干预后,待细胞长满后接种于96孔板,5%CO2培养箱中培养24 h,每孔加入10μL MTT,培养箱中避光孵育4 h。加入200μL DMSO后震荡10 min。于492 nm波长处测定同一时间点A值,计算细胞存活率。细胞存活率=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。
1.9 各组大鼠睾丸TM 4细胞中乳酸脱氢酶(lactate dehydrogenase,LDH)活性检测将TM 4细胞接种于96孔培养板。将100μL上清液转移至96孔培养板上。加入细胞毒性检测试剂盒LDH溶液100μL,37℃避光孵育15 min。加入50μL终止液(1 nmol·L-1HCL)停止反应,酶标仪于450 nm波长处测各孔A值,以A值代表各组细胞中LDH活性。
1.10 流式细胞术检测各组细胞凋亡率CSE干预细胞后采用胰酶消化,1 500 r·min-1离心5 min;加入300μL Binding Buffer悬浮细胞;分别加入5μL AnnexinⅤ-FITC和10μL PI染料,37℃避光孵育15 min;采用流式细胞术进行检测,采用CELL Quest软件进行结果分析。
1.11 睾丸TM 4细胞转染miRNA-138-5p过表达质粒采用限制性内切酶酶切目的基因和载体,按照试剂盒说明对其进行切胶纯化,并将目的片段与载体连接。采用100μL无血清培养基分别稀释pcDNA 3.1-EGFP-miR-138-5p质粒和 7.5 μL Lipofectamine 2 000;将2种液体混合,室温孵育20 min;在培养板中加入200μL转染复合物,5%CO2培养箱中37℃培养6 h;吸除上清液后加入3 mL完全培养基,继续培养24 h后进行后续实验。
1.12 TUNEL法检测各组大鼠睾丸TM 4细胞凋亡率在睾丸TM 4细胞过表达miRNA-138-5p后,采用相同方法将其暴露于CSE中,分为对照组、5%CSE组、5%CSE+Pri-miRNA-138-5p Ctrl组、5%CSE+Pri-miRNA-138-5p组、10%CSE组、10%CSE+Pri-miRNA-138-5p Ctrl组和10%CSE+Pri-miRNA-138-5p组,采用TUNEL法和细胞凋亡检测试剂盒并通过荧光显微镜检测各组睾丸TM 4细胞凋亡率。细胞凋亡率=凋亡细胞数/细胞总数×100%。
1.13 荧光显微镜观察各组细胞凋亡形态各组细胞切片经多聚甲醛固定后,加入含0.3%Triton X-100的PBS,37℃孵育5 min;继续在0.3%H2O2溶液中孵育20 min;加入生物素标记液,洗涤后加入50μL TUNEL反应液,37℃避光孵育1 h;PBS洗涤3次后封片,在荧光显微镜下观察细胞凋亡形态。
1.14 统计学分析采用SPSS 21.0统计软件进行统计学分析。各组大鼠血浆中抑制素B水平,睾丸组织中miR-138-5p表达水平,睾丸支持细胞中睾丸波形蛋白表达水平,各组睾丸TM 4细胞存活率、细胞中LDH活性和细胞凋亡率均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSDt检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠血浆中抑制素B水平与对照组比较,暴露初期(2、4和6周时)各剂量香烟暴露组大鼠血浆中抑制素B水平差异无统计学意义(P>0.05);第8周时,高剂量暴露组和第12周时各剂量组大鼠血浆中抑制素B水平降低(P<0.05或P<0.01)。大鼠血浆中抑制素B水平在长期香烟烟雾暴露后明显降低,且呈现出一定的剂量-反应关系。见表1。
表1 各组大鼠血浆中抑制素B水平T ab.1 Levels of inhibin B in plasma of rats in various groups (n=10,±s)

表1 各组大鼠血浆中抑制素B水平T ab.1 Levels of inhibin B in plasma of rats in various groups (n=10,±s)
*P<0.05,**P<0.01 compared with control group.
Group 4 6 8 Control Cigarette exposure Low dose Middle dose High dose Level of inhibin B(weak) 2 25.64±1.06 24.67±1.23 25.12±0.98 24.45±1.12 12 25.64±1.06 20.19±1.99*20.34±1.43*19.14±1.02**27.05±2.26 25.69±1.82 23.37±2.99 27.43±1.69 24.34±1.70 21.82±1.27 24.85±1.14 23.87±0.76 22.80±1.32 23.63±1.58 19.30±0.77 19.88±0.94*
2.2 各组大鼠睾丸TM 4细胞中睾丸波形蛋白表达水平对各组大鼠睾丸组织切片行免疫组织化学分析,在光镜下可见:对照组大鼠睾丸细胞胞质出现阳性黄染,说明波形蛋白表达呈阳性,而香烟暴露组大鼠睾丸TM 4细胞中睾丸组织波形蛋白表达水平逐渐降低,见图1。对图像进行后续数据分析结果显示:与对照组比较,暴露2、4、6、8和12周时,高剂量香烟暴露组大鼠睾丸TM 4细胞中睾丸波形蛋白表达水平均降低(P<0.05或P<0.01)。见表2。
表2 各组大鼠睾丸TM 4细胞中睾丸波形蛋白表达水平Tab.2 Expression levels of vimentin in testicular TM 4 cells of rats in various groups (n=10,±s)

表2 各组大鼠睾丸TM 4细胞中睾丸波形蛋白表达水平Tab.2 Expression levels of vimentin in testicular TM 4 cells of rats in various groups (n=10,±s)
*P<0.05,**P<0.01 compared with control group.
Group 4 6 8 Control Cigarette exposure Low dose Middle dose High dose Expression level of vimentin in testicular TM 4 cells(weak)2 27.90±6.27 27.13±3.76 26.12±6.12 28.12±4.93 12 25.12±6.12 18.89±2.54 12.76±2.85**10.48±1.28**34.56±6.65 19.62±3.01*15.02±7.00*23.19±9.70 14.14±6.89*13.90±5.48*28.19±1.32 14.46±8.23*10.88±5.55**21.50±5.23 20.42±4.68*10.64±3.24**
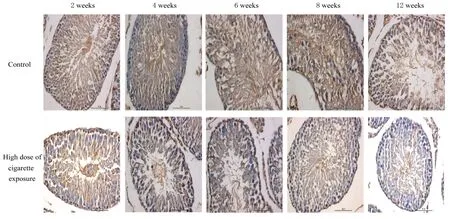
图1 各组大鼠睾丸TM 4细胞中睾丸波形蛋白表达情况(免疫组织化学,×400)Fig.1 Expressions of vimentin in testicular TM 4 cells of rats in various groups(Immunohistochemistry,×400)
2.3 各组大鼠睾丸组织中miR-138-5p表达水平与对照组比较,香烟烟雾暴露组大鼠睾丸组织中miR-138-5p表达水平逐渐降低,且呈现一定的剂量-反应关系。与对照组比较,暴露初期(第2、4和6周时)各组大鼠睾丸组织中miR-138-5p表达水平差异无统计学意义(P>0.05);第8周时,中和高剂量香烟暴露组及第12周时各剂量香烟暴露组大鼠睾丸组织中miR-138-5p表达水平均降低(P<0.05)。见表3。
表3 各组大鼠睾丸组织中miR-138-5p表达水平Tab.3 Expression levels of miR-138-5p in testicular tissue of rats in various groups (n=5,±s)

表3 各组大鼠睾丸组织中miR-138-5p表达水平Tab.3 Expression levels of miR-138-5p in testicular tissue of rats in various groups (n=5,±s)
*P<0.05 compared with control group.
Group 4 6 8 Control Cigarette exposure Low dose Middle dose High dose Expression level of miR-138-5p(weak)2 1.02±0.21 1.01±0.33 1.01±0.12 1.01±0.17 12 1.01±0.17 0.63±0.12*0.53±0.14*0.48±0.14*1.12±0.23 0.98±0.10 0.89±0.37 0.97±0.19 1.09±0.20 0.88±0.33 0.94±0.19 0.79±0.10 0.80±0.12 0.70±0.23 0.81±0.07*0.67±0.20*
2.4 各组大鼠睾丸TM 4细胞存活率和睾丸TM 4细胞中LDH活性与对照组比较,5%CSE组和10%CSE组TM 4细胞存活率明显降低(P<0.05或P<0.01)。与对照组比较,5%CSE组和10%CSE组大鼠睾丸TM 4细胞中LDH活性降低(P<0.05或P<0.01),且随着CSE浓度的增加,LDH活性逐渐降低。见表4。
表4 各组大鼠睾丸TM 4细胞存活率和睾丸TM 4细胞中LDH活性Tab.4 Survival rates of testicular T M 4 cells and LDH activities in testicular TM 4 cells of rats in various groups(n=3,±s)

表4 各组大鼠睾丸TM 4细胞存活率和睾丸TM 4细胞中LDH活性Tab.4 Survival rates of testicular T M 4 cells and LDH activities in testicular TM 4 cells of rats in various groups(n=3,±s)
*P<0.05,**P<0.01 compared with control group.
Group Control 5%CSE 10%CSE LDH activity[λB/(U·L-1)]187.27±10.62 244.19±19.11*573.78±17.02**Survival rate of TM 4 cells(η/%)100.00±0.00 79.18±1.92*68.34±4.09**
2.5 各组睾丸TM 4细胞凋亡率流式细胞术检测睾丸细胞凋亡率结果显示:对照组细胞基本无凋亡,5%CSE组TM 4细胞细胞凋亡率增加至(18.82±0.44)%,10%CSE组TM 4细胞凋亡率增加 至(31.33±0.66)%;与 对 照 组(3.51%±0.34%)比较,5%CSE组和10%CSE组细胞凋亡率均明显升高(P<0.05)。见图2。

图2 流式细胞术检测香烟烟雾暴露后各组睾丸TM 4细胞凋亡率Fig.2 Apoptotic rates of testicular TM 4 cells of rats in various groups after cigarette smoking exposure detected by flow cytometry
2.6 过表达miR-138-5p后各组大鼠睾丸TM 4细胞增殖率与对照组比较,5%CSE组、5%CSE+Pri-miRNA-138-5p Ctrl组、5%CSE+Pri-miRNA-138-5p组、10%CSE组、10%CSE+Pri-miRNA-138-5p Ctrl组和10%CSE+Pri-miRNA-138-5p组大鼠睾丸TM 4细胞增殖率降低(P<0.05或P<0.01);与5%CSE组比较,5%CSE+Pri-miRNA-138-5p组大鼠睾丸TM 4细胞增殖率升高(P<0.05或P<0.01);与10%CSE组比较,10%CSE+PrimiRNA-138-5p组大鼠睾丸支持细胞增殖率升高(P<0.05或P<0.01)。见表5。

表5 过表达miR-138-5p后各组大鼠睾丸TM 4细胞增殖率Tab.5 Proliferation rates of testicular TM 4 cells of rats in various groups after over-expression of miR-138-5p (n=3,x±s,η/%)
2.7 过表达miR-138-5p后各组大鼠睾丸TM 4细胞凋亡形态和细胞凋亡率荧光显微镜下,各组TM 4细胞均有凋亡表现。与对照组比较,5%CSE组和10%CSE组大鼠睾丸TM 4细胞凋亡率升高(P<0.05或P<0.01)。与5%CSE组 比 较,5%CSE+Pri-miRNA-138-5p组大鼠睾丸TM 4细胞凋亡率降低(P<0.05)。与10%CSE组比较,10%CSE+Pri-miRNA-138-5p组大鼠睾丸TM 4细胞凋亡率降低(P<0.05)。见图3和4。

图3 荧光显微镜观察TUNEL染色后各组大鼠睾丸TM 4细胞凋亡形态表现(×400)Fig.3 Apoptotic morphology of testicular TM 4 cells of rats in various groups after TUNEL staining observed by fluorescence microscope(×400)
3 讨 论
睾丸支持细胞也被称为“保姆细胞”,位于生精上皮,是形成睾丸组织结构的重要体细胞[9]。支持细胞为各级生精细胞提供了营养物质保障,同时可阻止多种有害物质进入生精小管[10]。相邻支持细胞间通过紧密连接便形成了血睾屏障(bloodtestis barrier,BTB),血睾屏障作为哺乳动物的天然屏障,在精子发生过程中发挥关键作用[11]。支持细胞受到破坏后,血睾屏障的完整性即发生改变,而完整的血睾屏障为正常精子发生过程提供了重要的微环境,以保证前细线期精母细胞能够顺利进入生精小管从而分化为成熟精子[12]。由此可见,精子发生过程离不开支持细胞,支持细胞结构和功能的完整性为血睾屏障发挥其正常功能提供了必要保障,同时也确保精母细胞能够顺利减数分裂形成成熟精子,本研究所用TM 4细胞即为睾丸支持细胞。
高表达于支持细胞的波形蛋白是构成细胞骨架的主要蛋白[13]。直接或间接地参与了血睾屏障的调控。研究[14]表明:当波形蛋白表达异常时,支持细胞骨架出现变形甚至消失,最终改变血睾屏障的通透性。波形蛋白表达的改变是鉴定早期睾丸毒性效应的重要指标之一[15]。本研究结果显示:大鼠睾丸波形蛋白表达水平随香烟烟雾暴露时间和剂量的增加而逐渐降低。该结果与以往的睾丸毒性损伤研究结果一致,郭海等[16]研究表明:金属锰诱导后的大鼠睾丸波形蛋白的表达下调,睾丸的超微结构发生改变。PRIHATNO等[17]研究表明:给Wistar大鼠注射顺铂后,大鼠睾丸曲细精管严重损伤,波形蛋白和角蛋白等表达明显下调。以上结果均证实:当外源化学物刺激并长期作用于机体时,可能会造成睾丸波形蛋白表达的改变,致使睾丸支持细胞骨架发生改变,最终影响睾丸的正常功能。

图4 各组大鼠睾丸TM 4细胞凋亡率Fig.4 Apoptotic rates of testicular TM 4 cells of rats in various groups
抑制素B来源于支持细胞,是反映支持细胞功能的重要内分泌标志物。抑制素B在睾丸生精过程中主要通过旁分泌作用调节支持细胞功能[18-19]。马帅[20]通过Meta分析证实:血浆抑制素B在临床上可作为非梗阻性无精子症患者睾丸生精功能的良好预测指标。本研究结果显示:睾丸支持细胞合成分泌的抑制素B水平在长期香烟烟雾暴露后明显降低,且呈现出一定的剂量-反应关系,此结果与王程强等[21]研究结果一致。上述研究结果均提示:长期大量吸烟可能导致睾丸支持细胞功能损伤。本研究进一步对支持细胞做体外实验发现:香烟烟雾暴露后,支持细胞增殖率明显降低,同时凋亡率和细胞毒性明显升高。均证实大量长期香烟烟雾暴露对睾丸支持细胞产生的毒性损伤是不可逆的,其中的具体调控机制本课题组将在未来的研究中进行验证。
miRNA参与生物体细胞周期、细胞增殖、细胞分化和细胞凋亡等重要的生物学过程[5,22],并作为重要的表观遗传因子在雄性生物睾丸的正常发育和精子发生过程的调控中发挥作用[23-24]。然而与吸烟所致睾丸毒性相关的miRNA及其调控机制尚不清楚,因此本课题组前期采用miRNA高通量芯片测序技术筛选出了5条在香烟烟雾暴露后睾丸组织差异性表达的miRNA。对差异性miRNA的靶基因进行预测和功能分析后,本课题组最终选择表达差异倍数较大且预测具有靶基因的miR-138-5p进行后续研究。本研究中采用RT-qPCR法对芯片结果进行验证,对不同暴露周期香烟暴露组大鼠睾丸TM 4细胞中miR-138-5p的表达进行分析,结果与芯片结果一致,即香烟烟雾暴露后睾丸组织中miR-138-5p的表达水平降低,且呈现一定的剂量-反应关系。结合本课题组过往研究[25]的结果显示:香烟烟雾暴露后睾丸TM 4细胞中miR-138-5p的表达下调与睾丸细胞损伤的发生呈负相关关系,说明miR-138-5p可能在香烟烟雾暴露所致睾丸支持细胞损伤中扮演重要的调控作用。继续通过体外实验,对这一假设进行验证,首先在支持细胞中过表达miR-138-5p,继续香烟烟雾干预实验结果显示:香烟烟雾暴露后,过表达miR-138-5p的TM 4细胞增殖情况、细胞毒性及细胞凋亡情况均得到了有效缓解。
综上所述,miR-138-5p在香烟烟雾暴露所致睾丸支持细胞损伤过程中具有重要调控机制,同时本研究结果为本课题组未来对于miR-138-5p的具体分子调控机制的研究提供了依据。

