脂肪间充质干细胞对卵巢早衰模型大鼠的治疗作用及其机制
颜培玉,张爱臣,章 宏,李 杨,张萌萌,洛梦泽,潘 颖
(1.吉林大学中日联谊医院妇产科,吉林 长春130033;2.吉林大学基础医学院生理学系,吉林 长春130021)
针对卵巢早衰(premature ovarian failure,POF)患者,现有很多临床治疗方法,但利弊共存,各种疗法虽能在不同程度上缓解患者的临床症状和改善卵巢功能,但无法从本质上解决POF问题,因此为化疗性卵巢早衰(chemotherapyinduced premature ovarian failure,CIPOF)患者寻求一种安全有效恢复卵巢功能的方法尤为重要。近年来研究[1-2]显示:组织器官损伤后会释放多种生物活性因子,引导移植到患者体内的外源干细胞向损伤部位迁移。干细胞能在一定程度上恢复卵巢的功能。目前经过骨髓移植的一部分癌症患者的卵巢功能和生育能力得到改善,甚至可以分娩出健康的后代[3]。此外,干细胞通过自分泌、旁分泌和远程分泌可产生干扰素(interferon,INF)类因子、生长因子、白细胞介素(interleukin,IL)类因子和神经营养因子等多种细胞因子[4-5],有效地促进卵巢血管再生,激活早衰的卵巢并使其去分化,修复早衰的卵巢。FAZELI等[5]和HE等[6]将干细胞移植至CIPOF患者机体后,干细胞可以分化为卵母细胞,修复受损的卵巢,改善卵巢的功能,且不具有成瘤性。但胚胎干细胞获取不易且涉及伦理争议,其他成体干细胞虽来源丰富但容易发生免疫排斥反应。脂肪间充质干细胞 (adipose derived mesenchymal stem cells,ADMSCs)具有数量多、操作简单、容易获取、分化能力强和免疫调节性良好的特点[7-8]。因此,ADMSCs在治疗POF方面具有很大的应用前景。本研究采用ADMSCs治疗POF大鼠,探讨ADMSCs对POF模型大鼠的治疗作用及其机制,为研究ADMSCs治疗POF提供依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器未交配的6~8周龄雌性SD大鼠(SPF级)30只,体质量180~220 g,购自吉林省长春市亿斯实验动物技术有限责任公司。根据《吉林大学实验动物伦理审查的基本原则》的规定进行饲养及实验。顺铂(江苏豪森药业集团有限公司),TBD标准胎牛血清(以色列Biological Industries公司),DMEM低糖培养液(美国Hyclone公司),细胞增殖-毒性检测试剂盒(Cell Counting Kit-8,CCK-8)(北京Biosharp公司),成骨细胞诱导试剂盒和成脂细胞诱导试剂盒(美国Cyagen公司),FITC抗鼠CD44、FITC抗鼠CD90和FITC抗鼠CD45(美国BioLegend公司)。TD5A低速离心机(中国上海Aida公司),D3024R高速离心机(美国SCILOGEX公司),恒温CO2细胞培养箱(日本SANYO公司),GFM-800P倒置相差显微镜(中国上海光密仪器有限公司),Synergy H1多功能酶标仪(美国BioTek公司),NovoCyte流式细胞分析仪(美国Agilent公司)。
1.2 大鼠ADMSCs的分离和培养采用7%水合氯醛将6~8周龄雌性大鼠麻醉后颈椎脱臼法处死,在无菌操作台中用眼科剪、组织镊子钝和锐性完整剔除包绕脂肪组织的血管及筋膜,分离出大鼠双侧腹股沟脂肪。采用大量PBS冲洗,将其放入小烧杯中充分剪碎成体积约为1 mm×1 mm×1 mm组织块,转移至离心管中并加入其体积2~3倍的Ⅰ型胶原酶,置于37℃恒温水浴中震荡消化60 min(期间至少反复混匀3次),直至脂肪组织呈乳糜状,采用完全培养基终止消化,滤网过滤下层消化产物得到细胞悬液,按1 500 r·min-1离心8 min。去上清液,以完全培养基重悬细胞沉淀,以1×106mL细胞数接种于75 cm2的培养瓶中,摇匀后将细胞平铺于培养瓶中,于培养箱中培养。24 h后首次换液,除去未贴壁血细胞,之后每3 d全量换液1次。每日在倒置相差显微镜下观察细胞形态和生长状况。当贴壁细胞长满瓶底壁面积的80%~90%后按照1∶2传代培养,以下所有实验均选择第4(P4)代细胞进行。
1.3 ADMSCs多向分化潜能鉴定以2×104cm-2的种植密度将细胞接种于6孔板,放置培养箱中培养,待细胞融合至80%~90%时,更换成骨细胞诱导培养基[9]和成脂诱导培养基[10-11],1周更换2次培养基,将培养在完全培养基的细胞作为空白对照;分别在诱导分化后的第0、1、4、7、14和21天拍照记录细胞形态变化;诱导分化14 d后,采用4%多聚甲醛固定细胞;根据油红O染色剂说明,对诱导成脂的细胞进行染色[12],脂肪颗粒为橘红色。于第21天按照茜素红S染色剂说明,对诱导成骨的细胞进行5 min的染色[9],钙沉积处为红色。
1.4 流式细胞术鉴定ADMSCs弃去原培养基,采用PBS冲洗,终止消化后将细胞悬液转移至离心管中,以1 200 r·min-1离心5 min;弃去上清液,加入PBS配置成密度为1×106L-1的细胞悬液;将其分别放入4支离心管中,每支离心管各100μL,编号为1~4号;第1号离心管为阴性对照管,加入等量相应的同型对照抗体。向2~4号离心管依次加入0.5μL FITC抗鼠CD44、0.1μL FITC抗鼠CD90和0.5μL FITC抗鼠CD45;避光冰上孵化30 min,1 200 r·min-1离心5 min,去上清液;采用PBS重悬,再次离心,去上清液;重复洗涤2次,再采用PBS重悬,等待上机。采用NovoCyte流式细胞分析仪进行分析。
1.5 ADMSCs生长曲线绘制采用胰蛋白酶-EDTA消化细胞后计数,将细胞配成不同密度的细胞悬液;接种于7块96孔培养板中,分别设置每孔0、500、1 000和2 000个细胞,每组各5复孔,孔中加入完全培养基200μL,置于标准环境下培养;24 h后,取出其中1块板,向其中所有孔中加入含有CCK-8溶液的工作液(600μL CCK-8与5 400μL无血清基础培养基的混合溶液)100μL,混匀置于培养箱中继续培养2 h;将96孔板置于酶标仪中,于450 nm波长处测量每孔吸光度(A)值;每天重复上述步骤1次,共操作7 d;绘制细胞生长曲线。
1.6 POF大鼠模型制备将30只6~8周龄和体质量为180~220 g的SD大鼠分为正常对照组和造模组:正常对照组10只,造模组20只。造模组:每天上午8时以1.5 mg·kg-1的剂量腹腔注射顺铂,持续注射2周;正常对照组:每天上午8时腹腔注射生理盐水0.03 mg·kg-1,持续注射2周。每天记录各组大鼠体质量变化及行为学改变。
1.7 各组大鼠给药方式和ELISA法检测腹腔注射顺铂结束1周后,将20只顺铂造模组大鼠再随机分为模型组和ADMSCs治疗组,每组各10只。正常对照组和模型组:将0.5 mL生理盐水通过尾静脉注射至大鼠体内;ADMSCs治疗组:将ADMSCs细胞以1×106mL-1的密度形成悬浮液,按每公斤2×106个细胞的剂量经尾静脉注射,2组大鼠均每3 d注射1次,共注射4次。最后一次注射治疗1周后,麻醉正常对照组、模型组和ADMSCs治疗组大鼠,心脏取血,收集血清备检。采用ELISA法检测大鼠血清雌二醇(estradiol,E2)、卵 泡 刺 激 素(follicle stimulating hormone,FSH)和黄体生成素(luteinizing hormone,LH)水平。
1.8 各组大鼠卵巢组织病理形态检测收集大鼠两侧卵巢组织,去除脂肪后拍照,采用细胞组织固定液固定,将标本制成切片,HE染色观察各组大鼠卵巢组织病理形态表现。
1.9 统计学分析采用SPSS 22.0统计软件进行统计学分析。各组大鼠体质量和血清E2、FSH及LH水平均符合正态分布,以±s表示,组间两两比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠ADMSCs培养和鉴定原代ADMSCs在体外培养24 h后细胞开始贴壁生长,细胞较杂,有少量圆形细胞和脂滴漂浮,48 h后少量梭形、圆形、不规则三角形和多边形的成纤维状细胞贴壁,细胞大小不一,仍有少量脂滴,4~6 d后细胞融合生长至培养瓶瓶底面积的70%~80%,细胞大部分伸展,体积变大。经3次传代后细胞逐渐变纯,形态较稳定,呈均一、长梭状的细胞,无漂浮脂滴。生长旺盛时细胞增殖迅速,细胞核较大,呈鱼群及旋涡状生长。见图1。
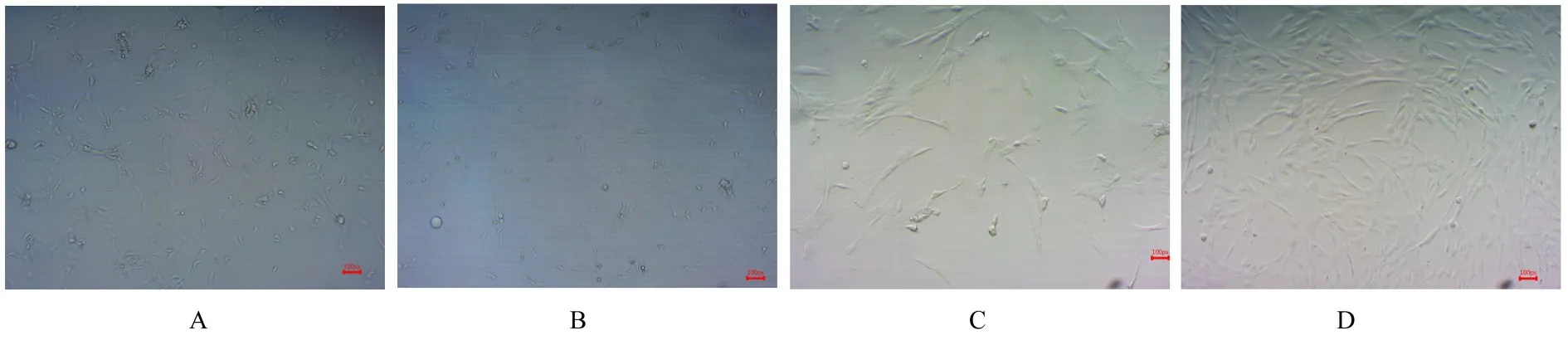
图1 ADMSCs的形态表现(×100)Fig.1 Morphology of ADMSCs(×100)
成骨诱导至第4天,细胞形态开始逐渐变大,为圆形和多角形等不规则形状,第21天时细胞呈复层生长,形态较模糊,排列紊乱,细胞间形成钙质沉积。第21天,细胞经过1%茜素红染色后,有红色钙结节沉积在细胞外基质内。见图2。
图2 ADMSCs向成骨细胞的分化(×100)Fig.2 Differentiation of ADMSCs to osteoblasts(×100)
成脂诱导第4~5天,部分细胞形态由长梭状转变成肥大的多形性细胞,并在胞浆内可见透光性较好的小中性脂质空泡,随着诱导时间的延长,脂滴的数量越来越多,并逐渐融合形成较大的脂滴。第14天,胞浆中可见大量大小不一、折光性良好的脂质空泡。第21天,细胞经油红O染色后变为橘红色。见图3。

图3 ADMSCs向成脂细胞的分化(×100)Fig.3 Differentiation of ADMSCs to adipocytes(×100)
第4代ADMSCs的表面标志物CD44和CD90均呈高表达,表达率分别为75.85%和59.71%;CD45呈低表达,表达率为39.12%。见图4。

图4 流式细胞术检测ADMSCs表面标志物Fig.4 Surface markers of ADMSCs detected by flow cytometry
大鼠ADMSCs可在体外培养环境下快速增殖,在P4代接种后均呈典型的“S”形生长曲线,见图5。消化接种后的第1~2天细胞增长较慢,从第3天起细胞进入对数生长期,快速增殖,并在第6~7天进入平台期停止生长。
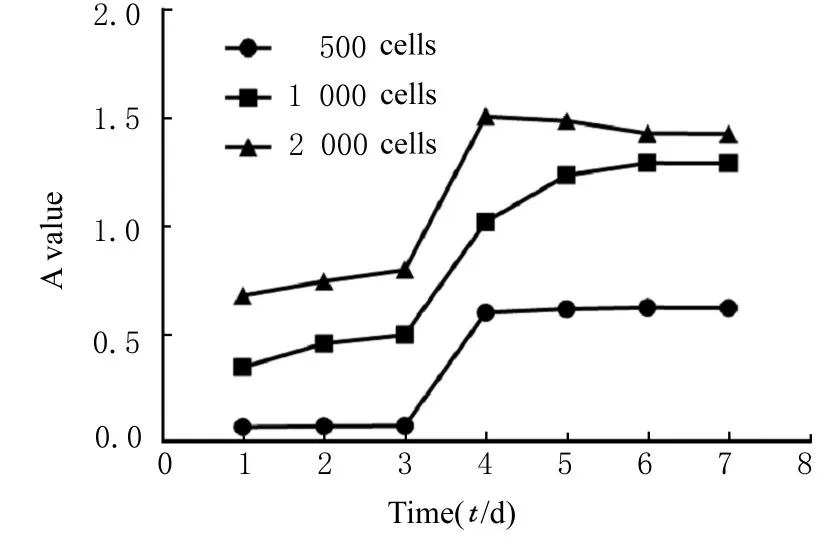
图5 P4代ADMSCs的生长曲线Fig.5 Growth curves of P4 generation ADMSCs
2.2 2组大鼠行为学改变和体质量正常对照组大鼠体态活泼,食量、毛发和大便正常,体质量稳定。造模组大鼠经腹腔注射顺铂4 d后进食不佳,精神颓靡,不愿意进行自主活动,对外界刺激反应亢进。1周后,大鼠毛发开始蓬乱、无光泽及脱落,体质量下降明显,见图6。造模组大鼠体质量[(203.35±21.74)g]明显低于正常对照组[(241.27±8.65)g](P<0.05)。
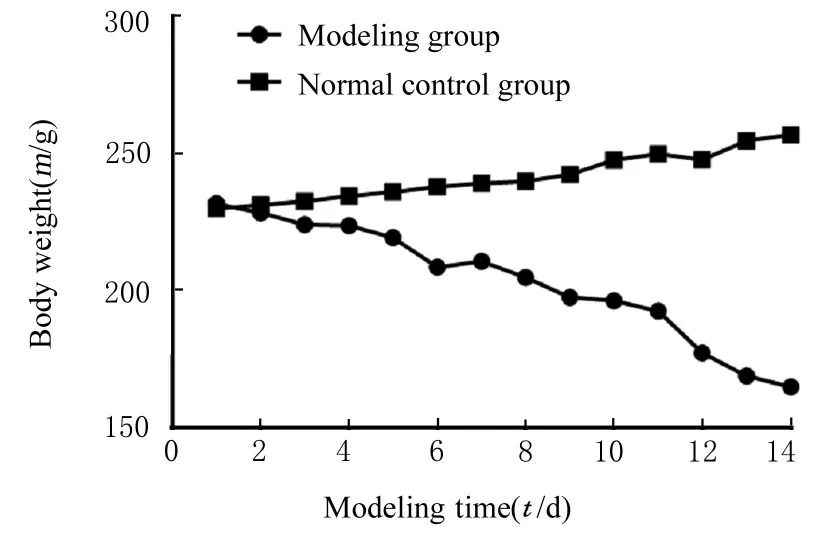
图6 造模期间2组大鼠体质量变化曲线Fig.6 Curves of changes of body weights of rats in two groups during modeling period
2.3 各组大鼠治疗前后体质量和卵巢大体观察治疗前,模型组与ADMSCs治疗组大鼠体质量比较差异无统计学意义(P>0.05),具有可比性(表1)。治疗后,ADMSCs治疗组大鼠体质量呈升高趋势,模型组大鼠体质量呈缓慢上升后趋于平稳的趋势(图7),但二者比较差异无统计学意义(P>0.05)。对比各组大鼠卵巢组织外观发现:正常对照组大鼠卵巢组织体积较大,表面呈淡红色,可见新鲜卵泡;模型组大鼠卵巢组织体积最小,表面呈灰黄色;ADMSCs治疗组大鼠卵巢组织体积大于模型组,接近于正常对照组,表面呈淡粉色(图8)。

图7 模型组和ADMSCs治疗组大鼠体质量Fig.7 Body weights of rats in model group and ADMSCs treatment group

图8 各组大鼠卵巢组织的外观表现Fig.8 Morphology of ovary tissue of rats in various groups
2.4 各组大鼠血清E 2、FSH和LH水平与正常对照组比较,模型组大鼠血清E2水平降低(P<0.05),FSH和LH水平升高(P<0.05);与模型组比较,ADMSCs治疗组大鼠血清E2水平明显升高,FSH和LH水平明显降低(P<0.05);与正常对照组比较,ADMSCs治疗组大鼠血清LH和FSH水平较高,E2水平较低,但组间比较差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠体质量和血清激素水平Tab.1 Body weights and serum hormone levels of rats in various groups (n=10,±s)

表1 各组大鼠体质量和血清激素水平Tab.1 Body weights and serum hormone levels of rats in various groups (n=10,±s)
*P<0.05 vs normal control group;△P<0.05 vs model group.
Group E2[ρB/(ng·L-1)]FSH[λB/(IU·L-1)]LH[ρB/(ng·L-1)]Normal control Model ADMSCs treatment Body weight(m/g)Before treatment 269.98±1.29 167.18±15.91 163.41±21.70 After treatment 276.59±4.65 167.62±0.47 168.52±3.64 306.61±216.33 694.55±247.87*400.21±218.80△49.85±14.29 32.56±9.92*45.69±9.13△3.47±0.86 4.20±0.36*3.57±0.69△
2.5 各组大鼠卵巢组织病理形态表现HE染色结果显示:与正常对照组比较,模型组大鼠缺乏各级卵泡,闭锁卵泡数增多;与模型组比较,ADMSCs治疗组大鼠各级卵泡数增多,闭锁卵泡数减少;与正常对照组比较,ADMSCs治疗组大鼠各级卵泡形态和数目无明显差别。见图9。

图9 各组大鼠卵巢组织病理形态表现(HE,×200)Fig.9 Pathomorphology of ovary tissue of rats in various groups(HE,×200)
3 讨 论
POF的定义为女性<40岁时,有闭经、FSH>25 IU·L-1及E2水平降低表现,并伴有潮热、月经改变、骨质疏松、乳房萎缩及阴毛和(或)腋毛脱落等不同程度的围绝经期症状,属于早发性卵巢功能不全(premature ovarian insufficiency,POI)的终末阶段[13]。在国外,普通人群POF发病率约为1%[14],中国约3.8%,其中特发性POF约占80%[15]。引起该疾病的病因有很多,如遗传因素、精神心理状态和医源性损伤等。并且随着乳腺癌、卵巢癌和宫颈癌等妇科恶性肿瘤发病率的上升及癌症的年轻化,化疗性卵巢早衰越来越常见并受到广泛关注。POF不仅在精神心理上给女性带来巨大压力,还使其机体受损,甚至丧失生育能力。针对POF患者,现有的临床治疗方法很多且利弊共存,包括激素替代治疗(hormone replacement therapy,HRT)、诱导排卵[16]、坤泰胶囊联合激素疗法[17]和针灸疗法[18]等。虽然HRT能迅速和高效地改善更年期症状,但长时间应用会增加乳腺癌、子宫内膜癌及心脏病等疾病的发病风险[1]。对于有生育要求的患者,长期诱导排卵可使储存卵泡被过度消耗,导致病情加重且复发,进而不利于生育[16]。随着对干细胞研究的不断深入,ADMSCs的诸多优点不断被挖掘,国内外对其展开了更热烈的研究,以探讨ADMSCs对POF的治疗作用。
ADMSCs来自中胚层,与骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)和脐带间充质干细胞(umbilical cord mesenchymal stem cells,UCMSCs)等其他间充质干细胞比较,ADMSCs不仅可多向分化且容易获取,还存在较少的伦理争议[14]。于2001年ZUK等[19]第一次从脂肪组织血管周围分离出来ADMSCs并进行培养,发现其能分化为骨细胞、神经细胞和软骨细胞等多种类型的细胞。研究[2]显示:ADMSCs在移植后具有归巢性,主要分布在损伤部位,可发挥良好的免疫调节作用,能够抑制树突细胞(dendritic cells,DCs)成熟,通过负调节免疫力,诱导免疫耐受[20];诱导巨噬细胞极化,下调免疫应答[21];抑制NK细胞增殖,使其在组织中保留足够的时间,在清除之前平衡免疫应答[22];同时抑制B细胞和T细胞增殖;不表达主要组织相容性复合物Ⅱ(major histocompatibility complexⅡ,MHC-Ⅱ),并促进前列腺素E2(prostaglandin E2,PGE2)等因子释放,进而控制移植后的混合淋巴细胞反应,能有效地抑制宿主的急性免疫反应[23],明显延长移植物存活的时间。并且这种免疫抑制作用不仅适用于同种异体间的移植,同样适用于异种间的移植[14],将人ADMSCs移植至动物模型中也有一定的治疗作用。另外,Angpt1与Zcchc11是两个与卵巢功能主要相关的基因。当Angpt1高表达时,可以增加卵巢的血供,促进卵泡的生长;而Zcchc11能上调IGF-1的表达,从而加快颗粒细胞增殖成长,减少细胞凋亡及使卵泡腔快速形成[24]。将ADMSCs移植至环磷酰胺诱导的POF小鼠机体后,Angpt1、Zcchc11和Onecut2基因表达明显增多,CXCR4表达减少,加速了原始卵泡发育为成熟卵泡的进程。同时ADMSCs可以分泌神经生长因子(nerve growth factor,NGF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、转化生长因子β(transforming growth factor-β,TGF-β)和血小板生长因子(platelet growth factor,PGF)等细胞因子,抑制颗粒细胞凋亡,使卵泡的数目增多,改善卵巢的功能。
本研究结果证实:ADMSCs具有粘附性贴壁生长,呈现成纤维样细胞等间充质干细胞的特征,传代至6代仍维持其表型,具有较强的增殖能力,且具有向成骨和成脂细胞多向分化的能力。这与国内外学者的研究[7,25]结果一致。ADMSCs高表达CD44和CD90,低表达CD45,符合国际细胞治疗学会对MSC提出的通用标准。造模组大鼠的E2水平较正常对照组低,而FSH和LH水平较正常对照组高,与卵巢早衰患者机体内激素水平的改变相似。另外,通过观察卵巢组织形态与病理切片发现:与正常对照组大鼠比较,模型组大鼠卵巢组织中有更多闭锁卵泡,各级卵泡数目明显减少,缺乏成熟卵泡,卵泡颗粒细胞结构松散,与POF患者卵泡丢失、闭锁和不排卵的症状相符。正常对照组大鼠卵巢组织中始基卵泡、初级卵泡和次级卵泡等各级卵泡均有明显的细胞増殖,而模型组大鼠卵巢组织中几乎检测不到增殖的卵泡,表明顺铂可以显著抑制卵巢细胞增殖,抑制卵巢分泌功能,诱导卵巢发生早衰。经过ADMSCs治疗后,ADMSCs治疗组大鼠血清中LH和FSH水平较模型组明显降低,而E2水平明显升高,表明ADMSCs能够在一定程度上恢复卵巢激素水平,改善卵巢功能。HE染色结果显示:与正常对照组比较,ADMSCs治疗组大鼠各级卵泡形态和数目无明显差别;与模型组比较,ADMSCs治疗组大鼠生长的卵泡数量增多,闭锁卵泡数量减少,说明ADMSCs能促进卵泡生长,减轻卵巢的损伤,对POF具有一定的治疗作用。
本实验证实ADMSCs能够在体外生长繁殖,并具有较强生长增殖能力和多向分化能力;ADMSCs能够提高POF模型大鼠血清E2水平,对恢复卵巢排卵功能和内分泌功能具有一定作用。为临床治疗POF,尤其有生育要求的POF患者寻求了一种安全有效的方法。

