电化学学习方法探讨
杜德祥
(昆明市第一中学,云南 昆明 650031)
“变化观念与平衡思想” 是化学学科五个核心素养中最基本的核心素养,也是学生了解、认识、解决化学常见问题的基础。变化是化学永恒的主题,同时,化学变化的过程又是守恒的。守恒是物质世界运动的一大特点,也是自然界最重要的基本规律。电化学的学习有助于学生“变化观念和平衡思想”学科核心素养的建构。
电化学(含原电池和电解池)其实是氧化还原反应的一个特殊领域,有电子转移是其本质。普通氧化还原反应中电子的得失是同时、同处发生,而电化学中的电子转移却是同时但不同处发生——电子从A处转移至B处。这就必然出现电子的定向移动,而电子的定向移动即形成电流(正电荷移动的方向与电子移动的方向相反,正电荷移动的方向就是电流的方向)。由此就蕴含着电化学中的很多“变化”。电化学中的平衡思想是:无论发生何种变化,一个电极失去的电子总数一定等于另一个电极得到的电子总数。这就是电化学中“变”与“不变”的对立统一。
电化学中的“变化”一般包括:电子转移的方向、电流方向、阴阳离子的移动方向、电极反应、电池的总反应;电化学中的平衡思想的体现之一:得失电子相等。
电化学知识与人类生活息息相关、密不可分。“运用化学原理和化学技术,解释生活中的化学现象,解决生活中的化学问题,提高人类生存质量和生活质量,是化学科学对人类的重要贡献之一。学生从生活和生产实际中探究和学习化学,既是运用化学原理、观念和方法解释生活中的化学现象,解决生活中与化学相关的问题的过程,又是形成解决未来生活中可能面临的陌生、复杂甚至不可预测的问题的能力的过程”。居于此,在每一年的高考中,都涉及到对电化学知识的考查。本文从电化学中的变化与守恒、解决电化学问题的认知模型的建立,以及认知模型在解决电化学问题中的应用三个方面进行阐述。
1 电化学中的变化与守恒
电子的转移是氧化还原反应的本质,因此电化学中必然有氧化还原反应的发生。所以电化学必须遵循氧化还原反应中的所有概念,即还原剂失去电子,化合价升高,元素被氧化,发生氧化反应;氧化剂得到电子,化合价降低,元素被还原,发生还原反应。
1.1 原电池
1.1.1 电极名称
原电池是化学能转变成电能的装置,也可以理解为:原电池是由于化学反应而引起电流产生的装置。有电流产生,必然就有电子的定向移动。一般规定:失去电子的一极,即电子流出的一极,为原电池的负极;得到电子的一极,即电子流入的一极,为原电池的正极。
1.1.2 典型代表——铜-锌-硫酸原电池
铜-锌-硫酸原电池是所有原电池的基础,也就是说,所有的原电池中,更容易失去电子的一极是负极,更容易得到电子的一极是正极。根据氧化还原反应的知识,失去电子,化合价升高,被氧化,发生氧化反应;得到电子,化合价降低,被还原,发生还原反应。
1.1.3 有盐桥的锌铜原电池(即双液原电池)
没有盐桥(盐桥中通常装有含琼胶的KCl饱和溶液)的普通铜-锌-硫酸铜原电池中,锌单质与硫酸铜直接接触而反应。在这一部分反应中,电子直接从还原剂转移给氧化剂,没有电子通过外电路的定向移动,即没有形成电流,导致能量转化率不高。另外,锌片与硫酸铜溶液直接接触反应,铜在锌片表面析出,锌表面也构成了原电池,进一步加速铜在锌表面析出,致使向外输出的电流强度逐渐减弱。当锌片表面完全被铜覆盖后,将不再构成原电池,也就没有电流产生了。使用盐桥后,锌单质和硫酸锌溶液接触,铜单质和硫酸铜溶液接触,两份溶液通过盐桥联通,不会出现氧化剂和还原剂之间的直接反应。双液原电池使用盐桥,可使由它连接的两溶液保持电中性,盐桥保障了电子通过外电路从锌到铜的不断转移,使锌的溶解和铜的析出过程得以持续进行,在外电路形成持续稳定的电流。所以使用盐桥的锌铜原电池,即双液原电池,有两个优点:能量转化率高;能提供持续稳定的电流。
1.1.4 电池分类及各自的典型代表
1)一次电池
①碱性锌锰电池。负极是Zn,正极是MnO2,电解液是KOH溶液。负极反应为:Zn+2OH--2e-=Zn(OH)2;正极反应为:2MnO2+2H2O+2e-=2MnOOH(氢氧化氧锰)+2OH-;总方程为:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。(注:可以通过得、失电子能力的强弱,也可以通过化合价的升、降,来判断电池的正负极。)
②锌银电池。负极是Zn,正极是Ag2O,电解液是KOH溶液。负极反应为:Zn+2OH--2e-=Zn(OH)2;正极反应为:Ag2O+H2O+2e-=2Ag+2OH-;总方程为:Zn+Ag2O+H2O=Zn(OH)2+2Ag。
③锂亚硫酰氯电池。负极是Li,正极是石墨,电解质由非水的SOCl2和LiAlCl4组成。负极反应为:4Li-4e-+4Cl-=4LiCl;正极反应为:2SOCl2+4e-=S+SO2+4Cl-;总方程为:4Li+2SOCl2=S+SO2+4LiCl↓。生成的S和SO2溶解在SOCl2电解液中。
④镉镍电池。负极为海绵网筛状Cd粉和NiO粉,正极为NiOOH和石墨粉的混合物,电解液通常为KOH溶液。负极反应为:Cd-2e-+2OH-=Cd(OH)2;正极反应为:2NiOOH+2e-+2H2O=2Ni(OH)2+2OH-;总反应为:Cd+2NiOOH+2H2O=Cd(OH)2+2Ni(OH)2。
⑤氢镍电池。负极活性物质为H2,正极活性物质为NiOOH,电解液通常为30%的KOH溶液。负极反应为:H2-2e-+2OH-(aq)=2H2O;正极反应为:2NiOOH+2e-+2H2O=2Ni(OH)2+2OH-;总反应为:H2+2NiOOH=2Ni(OH)2。
2)二次电池(即可充电、放电的电池)
对这类电池的基本认识是:放电时按照原电池分析,充电时按照电解池分析。放电时失去的电子,在充电时要重新得到。放电时生成的物质,在充电时要将它消耗掉;放电时消耗的物质,在充电时要重新生成。所以放电时的负极,在充电时要跟外接电源的负极相连;放电时的正极,在充电时要跟外接电源的正极相连。
① 铅蓄电池
负极板上覆盖有Pb,正极板上覆盖有PbO2,电解液是H2SO4溶液。

② 聚合物锂离子蓄电池
负极采用锂-碳层间化合物LixC6,正极采用锂化合物LiCoO2或LiNiO2或LiMn2O4,电解质使用固态或胶态高分子电解质或有机电解液。放电时,负极反应为:LixC6-xe-=xLi++C6;正极反应为:Li1-xCoO2+xe-+xLi+=LiCoO2等;总反应为:LixC6+Li1-xCoO2=C6+LiCoO2。
参照上述铅蓄电池,容易写出该电池充电时的阴、阳极反应以及总反应,在此不再赘述。
3)燃料电池
燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电源。它工作时,燃料和氧化剂连续地由外部供给,在电极上不断地进行反应,生成物不断地被排除,于是电池就连续不断地提供电能。
燃料电池种类很多,现以氢氧燃料电池为例。该电池以H2为燃料,O2为氧化剂,使用酸性或碱性电解液。负极反应为:2H2-4e-=4H+(碱性电解液时为:2H2-4e-+4OH-=4H2O);正极反应为:O2+4e-+4H+=2H2O (碱性电解液时为:O2+4e-+2H2O=4OH-);总反应为:2H2+O2=2H2O。
除氢气外,烃、烃的含氧衍生物、肼、氨气、煤气等,均可作燃料电池的燃料;除纯氧气外,空气中的氧气也可以作氧化剂。
1.2 电解池
1.2.1 电极名称及微粒流向
电解池是将电能转变成化学能的装置,也可以理解为:电解池是由于外接直流电源而引起化学反应发生的装置。一般规定:与外接电源正极相连的一极是电解池的阳极,与外接电源负极相连的一极是电解池的阴极。
外电路中的电子流动方向由外接电源决定。电子从阳极流出,流入外接电源的正极,再由外接电源的负极流出,流入电解池的阴极。所以阳极发生氧化反应,阴极发生还原反应。根据“带相同电性的微粒,其运动方向一致”的原则,电解质溶液中,阴离子向阳极移动,阳离子向阴极移动。
1.2.2 典型电解池
1)氯碱工业
在氯碱工业中,烧碱的生产原理简图见图1。

图1 烧碱的生产原理简图
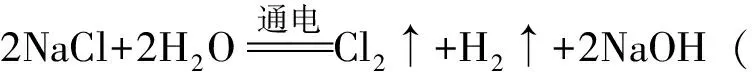
阳极的放电顺序一般是:活泼金属>S2->I->Br->Cl->OH->含氧酸根离子>F-。阴极的放电顺序一般是:Ag+>Hg2+>Fe3+>Cu2+>H+(浓度较大时)>Pb2+>Sn2+>Fe2+>Zn2+>H+(浓度很小时)>Al3+>Mg2+>Na+>K+。
2)电解精炼铜
用纯铜作阴极,粗铜作阳极,用CuSO4溶液作电解液。电解时,阳极反应有:Zn-2e-=Zn2+、Fe-2e-=Fe2+、Cu-2e-=Cu2+等,其它杂质,如Au、Ag等,沉积在电解槽的底部(阳极泥);阴极反应为:Cu2++2e-=Cu。
3)电镀
例如,若要将锌镀到铁件上,阳极为镀层金属锌,待镀金属铁作阴极,含锌离子的溶液如硫酸锌溶液作电解液。由于H+浓度很小,阳极反应为Zn-2e-=Zn2+,阴极反应为Zn2++2e-=Zn。
2 解决电化学问题的认知模型的建立
《普通高中化学课程标准(2017年版2020年修订)》[1]中对“证据推理与模型认知”的核心素养论述为:“具有证据意识,能基于证据对物质组成、结构以及变化提出可能的假设,通过分析推理加以证实或证伪;建立观点、结论和证据之间的逻辑关系。指导可以通过分析、推理等方法认识研究对象的本质特征、构成要素及其相互关系,建立认知模型,并能运用模型解释化学现象,揭示现象的本质和规律”。任何一个电化学问题(情境),其本质均为氧化还原反应的不同应用情境,因此对任何一个电化学问题(情境)的认识,都要基于对氧化还原反应知识的认识,进而建立解决电化学(含原电池和电解池)问题(情境)的认知模型:第一步,快速画出电池草图。目的是使分析过程变得直观。若问题情境中已经呈现了图示,则可以利用此图而无需再画。第二步,分析推理并标出电子流动方向。目的是可以清楚地判断哪一极发生氧化反应、哪一极发生还原反应等。原电池中的电子总是从更易失去电子的一极流出(此极发生氧化反应,涉及元素化合价的升高),经过外电路流入正极(此极发生还原反应,涉及元素化合价的降低);电解池中根据外界电源的正负极判断,电子总是从阳极流出(此极发生氧化反应,涉及元素化合价的升高),流入外接电源正极,再从外接电源负极流出,流入阴极(此极发生还原反应,涉及元素化合价的降低)。当然也可以根据元素化合价的变化情况等,逆向推出外接电源的正负极。第三步,关注电极材料。电解池中尤其要关注阳极材料,因为如果是活泼电极,电极材料本身要发生反应。第四步,关注电解质溶液中所有的阴阳离子。特别值得注意的是,要关注电解液是有水还是无水环境。若有水,要关注电解液的酸碱性,不要忘记任何水溶液中都有H+和OH-。目的是根据离子的放电顺序,准确判断出究竟是何种离子放电,离子的移动方向如何等等。
3 认知模型在解决电化学问题中的应用
在每一年的高考试题中,都有对电化学知识的考查。例如,2017年全国I卷第11题、2017年全国II卷第11题、2017年全国III卷第11题、2018年全国I卷第13题、2018年全国II卷第12题、2018年全国III卷第11题、2019年全国I卷第12题、2019年全国II卷第27题(节选)、2019年全国III卷第13题、2020年全国I卷第12题、2020年全国II卷第12题、2020年全国III卷第12题、2021年全国甲卷第13题、2021年全国乙卷第12题等等。本文以2017年全国III卷第11题为例,阐述电化学试题中的问题解决方法。
例题 全固态锂硫电池能量密度高、成本低,其工作原理如图所示。其中,电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )

A)电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4;
B)电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g;
C)石墨烯的作用主要是提高电极a的导电性;
D)电池充电时间越长,电池中Li2S2的量越多。
【解析】本题情境陌生,但类似于人教版《普通高中课程标准试验教科书化学选修4化学反应原理》[3]中提到的聚合物锂离子蓄电池。在陌生情境中应用化学基本知识和基本原理,学以致用,是高考试题以能力立意的必然要求,知识迁移能力以及心理承受能力等的考查历来受到极大重视。本题已提供图示,可在图上直接进行分析。根据Li+(正电荷)的移动方向,也可以根据S8→Li2S8→Li2S6→Li2S4→Li2S2的变化过程中S的化合价变化,推出电子移动方向即正电荷移动方向的反方向为:b极流出,进入用电器,流入a极,并在图中标出;推出电极a为正极,电极b为负极。根据氧化还原反应知识,b极失去电子,化合价升高,被氧化,发生氧化反应;a极得到电子,化合价降低,被还原,发生还原反应。b极的反应为:Li-e-=Li+,a极随着放电的不断进行,发生的反应有:S8+2e-+2Li+=Li2S8、3Li2S8+2e-+2Li+=4 Li2S6、2Li2S6+2e-+2Li+=3Li2S4、Li2S4+2e-+2Li+=2Li2S2。可知放电时间越长,电池中Li2S2的量越多;反之,充电时间越长,电池中Li2S2的量越少。所以本题的正确选项为D。本题的A、D选项考查的是电化学中的“变化”,B选项考查的是电化学中的“守恒”,很容易根据Li-e-=Li+计算而出,C选项考查的是涉及到的物质的物理及化学性质。
4 结语
电化学知识的考查,不外乎涉及“变化”“守恒”以及一些重要物质的基本物理及化学性质的考查。“变化”一般涉及对电极反应式的书写、总方程式的书写、电极的判断、电子流动方向、电流方向、阴阳离子移动方向、化合价的变化以及氧化还原反应的基本概念等的考查;“守恒”一般考查根据电化学中的两个极上得失电子相等进行的简单计算。通过对每一年高考试题的解答,可以发现试题情境虽较为陌生,但若建立起“四步曲”的解题模型,定会使看似陌生抽象的问题迎刃而解。

