靶向单纯疱疹病毒1型活性小分子化合物的筛选及鉴定*
蒋佩文,廖玉娇,余 欢,汪 林,黄 敏,吴泳洁,李润滋,李敏惠
1.成都医学院 基础医学院(成都 610500);2.成都医学院 科研实验中心(成都 610500);3.成都医学院 药学院(成都 610500);4.成都医学院 生物科学与技术学院(成都 610500)
单纯疱疹病毒(herpes simplex virus,HSV)属于α疱疹病毒亚科,具有复制周期短、感染速度快等特点[1]。人是其唯一的自然宿主,根据血清型分为HSV-1和HSV-2,其中HSV-1感染最普遍,几乎终身伴随被感染宿主。目前,临床常用的抗HSV药物主要抑制病毒DNA聚合酶的核苷类似物,如阿昔洛韦、伐昔洛韦等[2]。但这类抗HSV的核苷类似药物存在靶点单一、生物利用度低、半衰期短、不良反应大、易发生耐药等缺点[3],因此寻找新型有效的抗HSV药物至关重要。
随着肿瘤免疫治疗的发展,溶瘤病毒疗法(oncolytic viruses therapy,OVT)除直接靶向杀伤肿瘤细胞外,还可激活机体免疫反应,从而显示出独特的优势。HSV-1具有高效的感染能力及基因组容量大、利于改造,游离存在于细胞内、不整合等优点[4],使之成为极具研究前景的一类溶瘤病毒(oncolytic viruses,OVs)。至今已经有10余种oHSV-1处于临床前或临床研究阶段[5]。OVs经改造后具有更强的肿瘤靶向能力、溶瘤活性和更有效的抗肿瘤免疫;但单一的OVT仍存在因病毒在某些宿主中的复制受限而导致疗效不佳的问题。OVs与其他抗肿瘤药物的联合疗法已成为研究新趋势,靶向病毒复制的联合策略是当前研究热点之一[6],故筛选促进肿瘤细胞内病毒复制的小分子化合物尤为重要。
HSV-1的致病性和溶瘤性使得靶向HSV-1的活性药物筛选具有双向性,不论是抗病毒活性药物的筛选还是具有促进肿瘤细胞内病毒复制的活性药物筛选,均具有十分重要的作用。因此本研究基于小分子化合物库筛选对HSV-1有抑制或促进作用的活性药物,以期为后续抗病毒或溶瘤病毒的联合疗法奠定研究基础。
1 材料与方法
1.1 药物
佛司可林(Forskolin,FOR)(Cat.No.66575-29-9)及盐酸石蒜碱(lycorine hydrochloride,LYC)(Cat.No.2188-68-3)购自成都曼思特生物科技公司。
1.2 主要试剂
胎牛血清(Cat.No.10100147)、DMEM基础培养基(Cat.No.11995-065)购自美国Gibco公司;CCK-8检测试剂盒(Cat.No.CK04)购自日本同仁化学研究所;Annexin V-FITC/PI凋亡检测试剂盒(Cat.No.C1062L)、MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0(Cat.No.9766)、PrimeSTAR Max DNA Polymerase(Cat.No.R045A)购自日本宝日医生物技术有限公司;Universal ProbeLibrary Set(Human Probes #1-#90)(Cat.No.04683633001)购自美国Roche公司;中粘度甲基纤维素(Cat.No.9004-67-5)购自中国生工生物工程股份有限公司。
1.3 细胞
人脑胶质母细胞瘤LN229细胞(用于HSV-1溶瘤靶细胞研究)和非洲绿猴肾上皮Vero细胞(用于HSV-1病毒扩增研究),来源于成都医学院科研实验中心,用含10%胎牛血清的DMEM完全培养液传代培养。
1.4 病毒株的确定
NCBI网站上查找HSV-1 F病毒株的基因组DNA序列(GenBank:GU734771.1);选取HSV-1的基因RL1和UL12为目的基因,采用Primer Premier 5.0软件设计引物对其进行鉴定(表1);提取病毒基因组DNA,通过PCR扩增目的序列;目的序列切胶回收纯化,送生工测序。
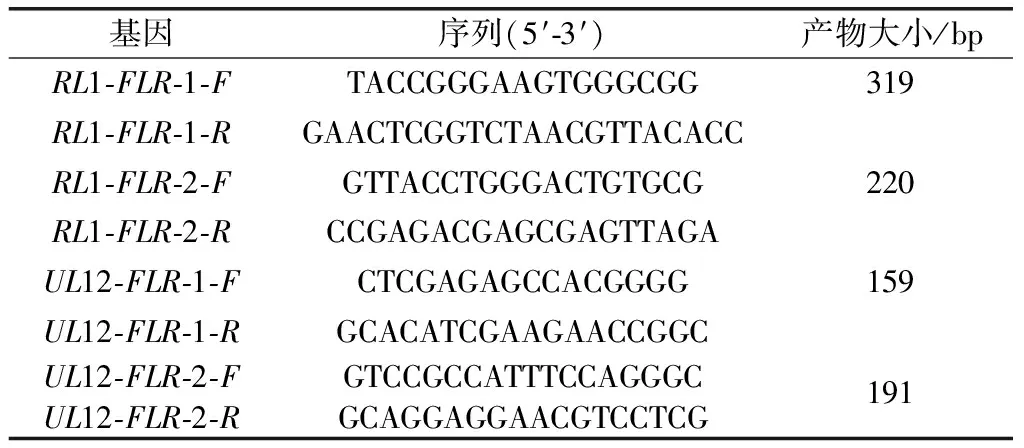
表1 PCR引物序列
1.5 病毒滴度测定
采用半数组织细胞感染剂量(50% tissue culture infective dose,TCID50)法测定病毒滴度。观察孔板中细胞病变效应(cytopathic effect,CPE),并记录每个病毒稀释梯度下的CPE孔数,Reed-Muench公式[7]计算病毒滴度,即TCID50=50%感染的高临界稀释度倒数的对数+距离比×稀释系数的对数;其中,距离比=(50%的临界感染率-50%)/(50%的临界感染率-50%的低临界感染率);而TCID50法与空斑形成单位(plaque forming unit, PFU)的换算关系为1TCID50/mL≈0.69 PFU/mL;病毒MOI与PFU和细胞数有关,即MOI=PFU/细胞数。
1.6 细胞内HSV-1基因表达情况测定
HSV-1吸附Vero细胞1 h后,于不同时间(即0、2、6、12、24 h)收集细胞,不同MOI(0.000、0.078、0.312、1.250、5、200)的HSV-1吸附Vero细胞1 h后,弃去病毒液,继续培养24 h后收集细胞;TRIzol法提取细胞总RNA,逆转录为cDNA;进行实时荧光定量PCR检测(探针法),定量引物及对应探针信息如下(表2)。以内参基因GAPDH的表达水平为标准,采用2-ΔΔCq方法分析HSV-1复制相关基因ICP4、ICP27、UL12及Us6的表达水平。
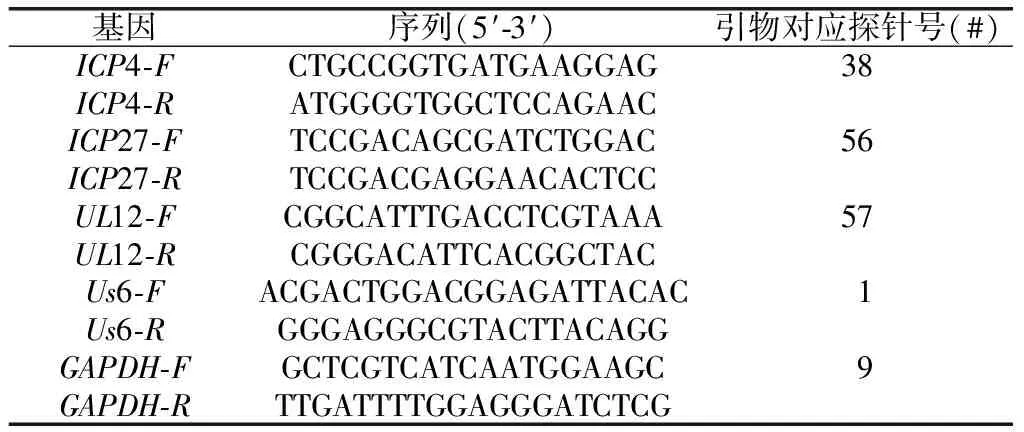
表2 实时荧光定量PCR引物序列及探针号
1.7 细胞增殖实验
CCK-8法检测LN229细胞增殖情况,用MOI=2.5的HSV-1吸附细胞1 h后去除病毒液,加入不同浓度小分子化合物(FOR:0~120 μmol/L;LYC:0~25 μmol/L)作用24 h,每孔加入10 μL的CCK-8,震荡混匀后孵育2~4 h,450 nm测定吸光度(absorbance,A),细胞活力=[A实验组-A空白]/[A对照组-A空白]×100%。
1.8 细胞凋亡检测
MOI=2.5和5.0的HSV-1吸附LN229细胞1 h弃去病毒液,10 μmol/L的LYC作用24 h,采用Annexin V-FITC/PI双染法、流式细胞仪(ACEA NovoCyte,美国)检测细胞的凋亡情况。
1.9 病毒空斑减数实验
MOI=0.000 1的HSV-1吸附Vero细胞1 h后,分别向6孔培养板中加入1 mL甲基纤维素-药物培养基(0.2、0.4、0.5 μmol/L的LYC,该浓度下对Vero生长无毒性)作用72 h,弃培养基,3%多聚甲醛室温固定20~30 min,0.1%结晶紫染色10 min,洗去多余结晶紫;正常细胞为蓝紫色,病毒空斑呈白色,统计空斑数,计算病毒空斑减数率。病毒空斑减数率(%)=(病毒对照组空斑数-药物处理组空斑数)/病毒对照组空斑数×100%。
1.10 统计学方法

2 结果
2.1 病毒株的鉴定
通过PCR扩增、产物测序对供试HSV-1病毒F株进行鉴定,核酸电泳及测序结果均显示目的片段的大小和序列正确,表明HSV-1病毒为F株,其基因号为GU734771.1(GenBank)(图1)。
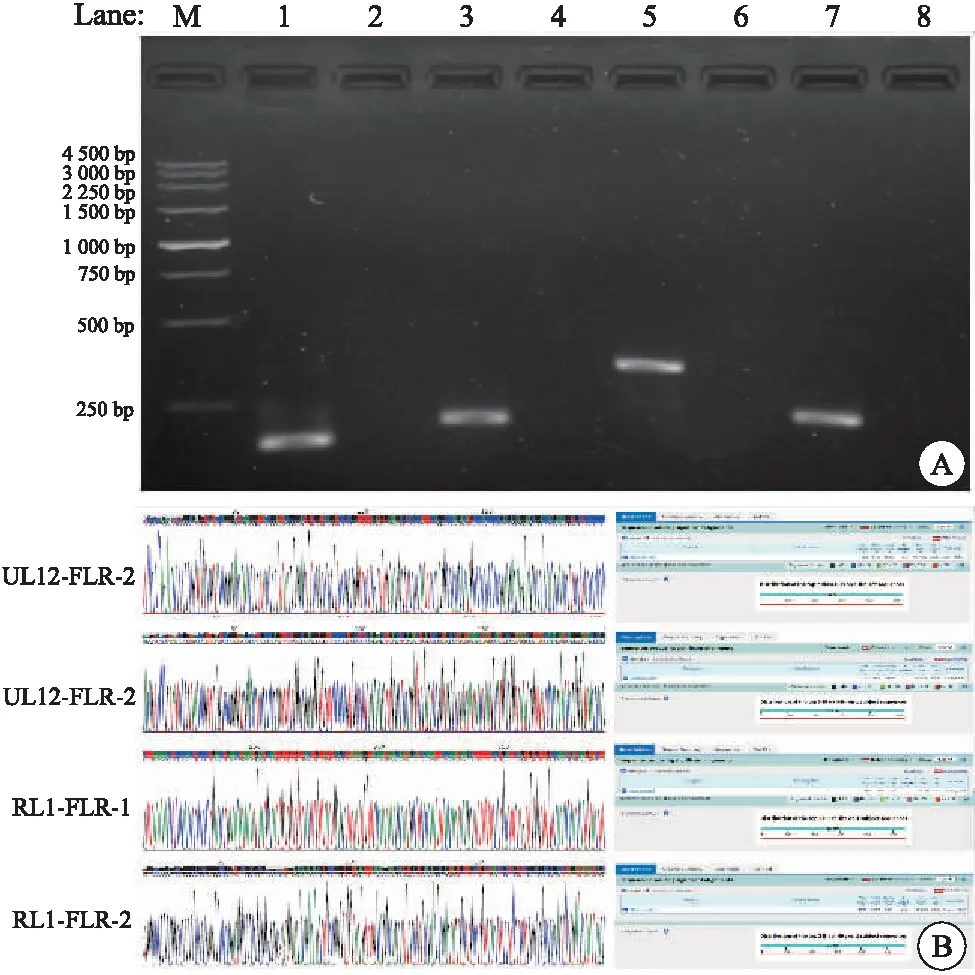
图1 HSV-1病毒株的鉴定
2.2 TCID50法测定病毒滴度
实验所用的HSV-1为第4代(T4)病毒且均为同一批次病毒;倒置显微镜对CPE观察、记录结果,通过Reed-Muench公式计算得到HSV-1(T4)的滴度1×108TCID50/mL,即6.9×107PFU/mL(表3)。
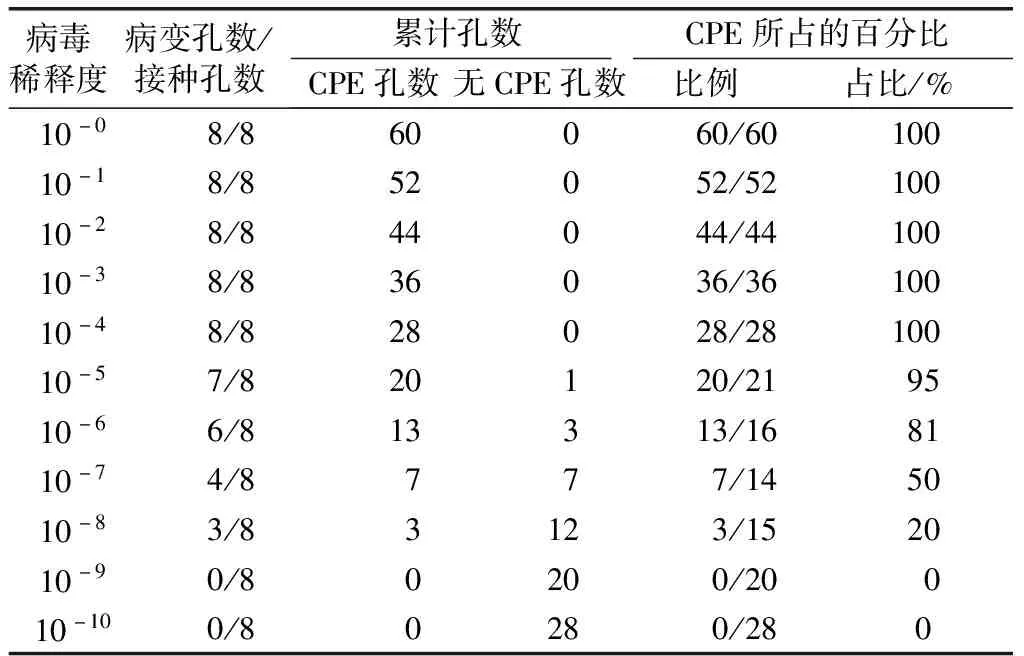
表3 第4代HSV-1(T4)的TCID50测定
2.3 实时荧光定量PCR检测细胞内HSV-1基因表达
为准确监控HSV-1在感染细胞中的复制能力,并对病毒复制拷贝数进行定量分析,研究采用实时荧光定量PCR检测HSV-1不同感染时间点复制关键基因的表达情况[8]。结果显示,Vero细胞中,极早期基因ICP4在病毒感染后2 h时开始表达;早期基因UL12和晚期基因Us6在6 h时开始表达,12 h时表达急速升高;在24 h病毒各复制关键基因表达均升高(图2A);病毒基因表达的实时荧光定量PCR检测结果与HSV-1病毒复制周期(18~20 h)相符,提示实时荧光定量PCR检测体系可用于胞内病毒核酸的实时定量检测。
在Vero细胞中,以极早期基因ICP4、ICP27和早期基因UL12表达水平为指标,对HSV-1感染的最适MOI进行确认。实时荧光定量PCR结果显示,MOI为1.25时,ICP4和ICP27基因表达水平增加;而MOI分别为1.25和5.00时,ICP27表达差异不明显;MOI为5.00时,ICP4、ICP27和UL12基因表达水平增加(图2B);综合考虑各时期基因表达差异及病毒吸附饱和量,提示MOI为1.25~5.00时,可用于后续活性药物的筛选(图2B)。
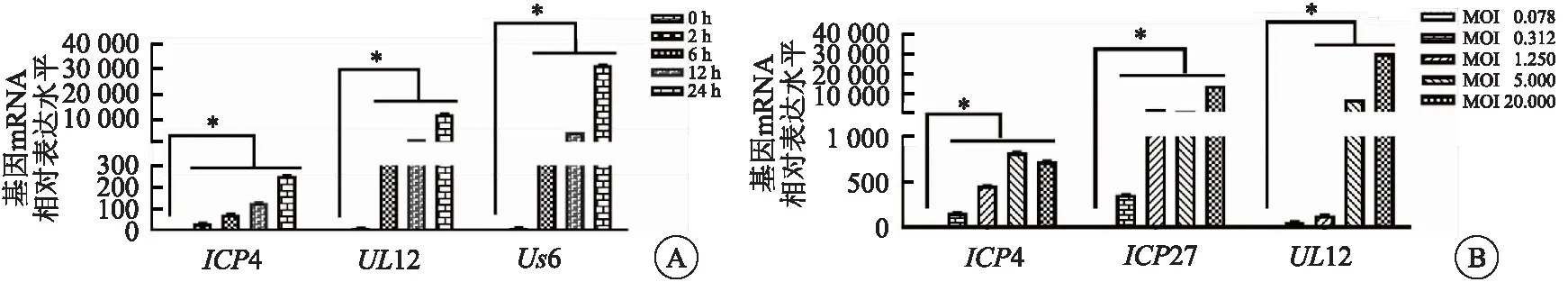
图2 HSV-1复制相关基因表达差异
2.4 FOR促进HSV-1复制基因表达升高
OVT的关键因素是病毒能够在肿瘤细胞中有效复制,促病毒复制的小分子化合物与OVs的联合策略具有广阔前景。CCK-8检测结果显示,FOR单独作用LN229细胞24 h的IC50为52.65 μmol/L,FOR与HSV-1联合作用的IC50为6.80 μmol/L(图3A),即FOR与HSV-1联合具有潜在协同溶瘤效应。实时荧光定量PCR结果进一步证实,FOR可促进HSV-1复制相关基因ICP4、UL12和Us6的表达升高,其中对ICP4和Us6的促进作用较明显(图3B),而ICP4和Us6在HSV-1基因转录和病毒附着、进入宿主细胞中起重要作用,对于溶菌性感染的发生必不可少;以上结果提示FOR极有可能通过促进HSV-1复制基因表达、增加子代感染性病毒量,进而发挥协同抗肿瘤的生物学效应。
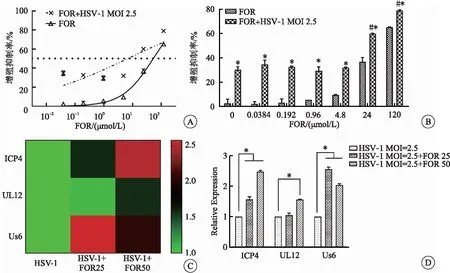
图3 FOR促进HSV-1复制协同发挥抗肿瘤作用
2.5 盐酸石蒜碱抑制HSV-1诱导的LN229细胞凋亡
CCK-8检测结果显示,LYC联合HSV-1较单一的HSV-1对LN229细胞的增殖抑制差异无统计学意义(P<0.05)(图4A~B);Annexin V-FITC/PI双染、流式检测结果显示,LYC与HSV-1联合作用,LN229细胞凋亡比例(即早凋与晚凋:Q3-4+Q3-2)相比病毒组(MOI=2.5和5.0)明显降低,分别从10.42%和18.37%下降到3.01%和3.59%(图4C~D),差异有统计学意义(P<0.05),提示LYC抑制HSV-1诱导的细胞凋亡,可能具有抗HSV-1活性。
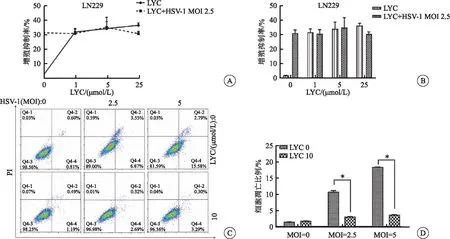
图4 LYC抑制HSV-1诱导的LN229细胞凋亡
2.6 盐酸石蒜碱具有抗HSV-1作用
细胞凋亡染色结果提示,LYC具有抑制HSV-1诱导细胞凋亡的作用,研究采用病毒空斑减数实验进一步确定LYC对HSV-1的直接抑制作用。结果显示,与病毒对照组相比,LYC药物组中的病毒空斑数目及空斑体积均缩减,0.2、0.4、0.5 μmol/L LYC对应的病毒空斑减数率分别为39.22%、50.98%、33.33%,差异有统计学意义(P<0.05)(图5),即LYC对HSV-1有抑制作用。

图5 LYC抑制HSV-1病毒空斑形成
3 讨论
由于HSV-1的致病性,其抗病毒活性药物的筛选一直是病毒研究领域的热点;另一方面基于HSV-1改造的溶瘤病毒oHSV-1被认为是最有潜力的OVs之一,在肿瘤生物治疗领域具有广阔的应用前景;而OVs的单一疗法具有一定局限性,与促进病毒复制的化合物联用是一种非常有效的联合策略,因此靶向HSV-1筛选可促进病毒复制的活性药物具有重要意义。
本研究通过建立快速、灵敏、可实时检测胞内HSV-1核酸拷贝数的实时荧光定量PCR法结合体外细胞模型,筛选得到促进病毒基因复制的化合物FOR,FOR是从毛喉鞘蕊花(ColeusForskohliiBriq.)中分离得到的二萜类化合物[9],具有激活环磷酸腺苷的活性,已被用于治疗高血压、肥胖、哮喘及青光眼等多种疾病。本研究发现,FOR可协同HSV-1抑制LN229细胞的增殖,且可促进病毒复制相关基因ICP4、UL12和Us6的表达。ICP4通过结合启动子[10],诱导病毒转录激活;UL12编码碱性核酸酶在病毒基因组复制和加工中起重要作用[11];Us6编码了非糖基化蛋白gD[12],对病毒附着和进入细胞很重要。这些结果提示,FOR可能通过增加HSV-1的复制、子代感染性病毒粒子的产生以及促进病毒对宿主细胞的附着与进入,极有可能成为oHSV-1溶瘤病毒联合治疗的潜在候选药物。另外,研究通过流式细胞术及病毒空斑减数实验筛选得到对HSV-1具有抗性的化合物LYC,是从植物石蒜的鳞茎中提取的异喹啉类环形生物碱[13],具有广泛的消炎、抗真菌、抗肿瘤[14]等药理活性。
综上所述,LYC可降低HSV-1诱导的肿瘤细胞凋亡,空斑减数实验证实LYC可减少HSV-1形成的空斑数、缩小空斑大小,即LYC具有潜在的抗HSV-1作用。后续研究将继续对LYC抗HSV-1作用机制及FOR与oHSV-1溶瘤病毒联合应用作进一步研究。

