狂犬病病毒糖蛋白29修饰的纳米复合物体内穿透血脑屏障的研究*
尧 月,苏炳银,李淑蓉△,韩玉萍△
1.成都医学院 发育与再生四川省重点实验室(成都 610500);2.成都医学院 病理学与病理生理学教研室(成都 610500);3.成都医学院 组织胚胎学教研室(成都 610500)
血脑屏障(blood brain barrier,BBB)是一种多细胞血管结构,主要由脑微血管内皮细胞、周细胞、星形胶质细胞和基底膜组成,将中枢神经系统(central nervous system,CNS)与外周血液循环分开。脑内皮细胞具有连续的细胞间紧密连接,无内皮窗孔且具有极低的胞吞率,极大限制了分子经细胞旁和跨细胞转运通过内皮细胞,导致大分子或亲水分子需要通过能量依赖性机制(如载体介导的转运)进行跨细胞转运[1-3]。半导体聚合物量子点(semiconducting polymer dots,Pdots)具有高荧光亮度、快速稳定的发射速率、优异的光稳定性及无毒特性,在生物成像上极具优势;Pdots与生物大分子共价连接,生物分子作为配体与细胞表面特异性受体相互作用,能够将该复合物递送至细胞[4]。狂犬病病毒糖蛋白29(rabies virus glycoprotein 29,RVG29),含有29个氨基酸,可通过烟碱型乙酰胆碱受体(nicotinic acetylcholine receptor,nAchR)和γ-氨基丁酸(gamma-aminobutyric acid,GABA)受体介导的转运作用有效跨越BBB,其受体广泛分布于脑微血管内皮细胞和神经元的细胞膜,为纳米复合物通过BBB并进入神经元提供了可能性[5-6]。目前国内外已有使用RVG29修饰纳米材料穿透BBB的研究[7-8],但使用Pdots作为纳米载体仅有体外穿透BBB模型的报道[9],尚无体内研究。本实验首先合成并表征Pdots与Pdots-RVG,体外检测神经细胞摄取纳米材料;随后腹腔注射Pdots与Pdots-RVG纳米复合物,通过流式细胞术检测各组织器官的Pdots阳性细胞率,以探究纳米颗粒的生物富集。本实验首次使用流式细胞术在细胞层面分析纳米材料的生物富集,该方法收样及检测快速、操作较简单、生物学重复结果较稳定,可作为纳米材料生物富集的初步探索。
1 材料与方法
1.1 试剂
小鼠中脑多巴胺能神经元细胞系(mouse midbrain dopaminergic cells,MN9D)由中国科学院典型培养物保藏委员会细胞库提供,DMEM/F12培养基、双抗(青霉素+链霉素)(penicillin-streptomycin,PS)、胎牛血清(fetal bovine serum,FBS)、0.25%胰酶均购自美国Gibico公司,超滤离心管(2 mL/100 kDa)购自美国Millipore公司,9,9-二辛基聚芴苯并噻二唑交替共聚物[poly(9,9-dioctylfluorene-alt-benzothiadiazole),F8BT]、四氢呋喃(tetrahydrofuran,THF)、聚苯乙烯-马来酸酐(polystyrene-co-maleic anhydride,PSMA)、多聚甲醛(paraformaldehyde,PFA)均购自德国Sigma-aldrich公司,RVG29-Cys购自上海吉尔生化公司,4-(2-羟乙基)-1-哌嗪乙磺酸[4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid,HEPES]、台盼蓝与4′,6-二脒基-2-苯基吲哚[2-(4-Amidinophenyl)-6-indolecarbamidine dihydrochloride,DAPI]购自上海碧云天公司,细胞增殖-毒性检测试剂盒(cell counting kit-8,CCK-8)试剂盒购自日本同仁公司,水合氯醛购自上海生工生物公司,细胞滤网购自北京Biosharp公司。
1.2 实验仪器
低速离心机(Sorvall ST16)(美国,Thermo Fisher),倒置显微镜(BX-63)(日本,Nikon),生物安全柜(1300 SERIES A2)(美国,Thermo Fisher),细胞培养箱(Forma 3111)(美国,Thermo Fisher),粒度电位仪(Zetasizer Nano ZS90)(英国,Malvern),激光扫描共聚焦显微镜(FV1000)(日本,Olympus),流式细胞仪(Accuri C6)(美国,BD)。
1.3 纳米颗粒制备与评价
1.3.1 Pdots制备 采用纳米共沉淀的方法制备Pdots。将36 mg F8BT、8.976 mg PSMA溶解于144 mL THF,迅速将混合液加入至正超声的双蒸水中,超声15 min至溶液澄清透明,将溶液置于通风橱通风过夜以蒸发多余THF。将得到的溶液用100 kDa超滤管离心提纯,将提纯后的溶液通过0.22 μm滤膜以得到浓度为1 g/L的Pdots原液,密封,4 ℃冰箱避光保存。
1.3.2 Pdots-RVG制备 按顺序依次加入Pdots(1 g/L)、HEPES(1 mmol/L)、RVG(1 mmol/L),充分混合20 min。其中Pdots与RVG按照3∶1(w/v)混合,HEPES终浓度为1 μmol/L。Pdots-RVG混合液现用现配,尽量避光操作。
1.3.3 动态光散射技术 采用动态光散射技术(dynamic light scattering,DLS)检测纳米颗粒粒径及Zeta电位。将样品稀释至合适倍数,使用粒度电位仪测量,获得其平均粒径(Z-average)、多分散系数(particale dispersion index,PDI)及Zeta电位。
1.4 纳米颗粒生物相容性及细胞摄取
1.4.1 细胞培养 取MN9D液氮冻存细胞于37 ℃水浴锅中迅速解冻,稀释离心并重悬后,加入含10%FBS、1%PS的DMEM/F12培养液中,于37 ℃、5%CO2的细胞培养箱中培养,每2 d更换新鲜完全培养基。待细胞长至80%~90%时,加入0.25%胰蛋白酶消化传代或铺板。
1.4.2 CCK-8检测细胞存活率 对数生长期细胞按照每孔5×104个/mL的密度接种至96孔板中,每孔100 μL。第2天待细胞完全贴壁后更换为含2% FBS细胞培养基,加入药物处理48 h,更换新鲜培养基并加入10% CCK-8,避光培养2~4 h直至培养液变为橙色,酶标仪检测450 nm处吸光度。细胞分组及处理:设置对照组、Pdots组、Pdots-RVG组,每组设置5个复孔;其中,对照组为空白对照组(只含CCK-8试剂,不含细胞)及阴性对照组(只含纳米材料及CCK-8,不含细胞)。Pdots浓度在实验组中均设置为5、25、50、200 mg/L。细胞存活率(%)=[A(实验组)-A(空白组)-A(阴性组)]/[A(对照组)-A(空白组)-A(阴性组)]×100%。
1.4.3 纳米材料的细胞摄取 24孔板中放置细胞爬片并润洗,取对数生长期MN9D细胞按照每孔5×105个/mL密度,接种至24孔板中。待细胞贴壁后,使用Pdots与Pdots-RVG(Pdots浓度为5 mg/L)分别与细胞共孵育1、2、4、8、12、24 h,经4% PFA固定后DAPI染色,于激光扫描共聚焦显微镜下观察细胞绿色荧光摄取,激发波长为364 nm(DAPI)及488 nm(Pdots)。
1.5 纳米材料体内蓄积
1.5.1 实验动物 雄性C57BL/6小鼠12只,体重20~25 g,购自成都达硕动物科技有限公司,饲养环境相对湿度40%~70%,温度约为25%,每日光照12 h,自由摄食饮水。实验用鼠均严格按照国际卫生研究机构的伦理指南处理,项目过程均在成都医学院实验动物福利伦理委员会监督下进行。
1.5.2 小鼠给药 小鼠随机分为PBS组、Pdots组、Pdots-RVG组3组,每组4只,均采用腹腔注射,Pdots注射剂量为1 mg/g,40 h后收样。
1.5.3 机械-酶消化法制备组织单细胞悬液 小鼠脏器单细胞悬液制备4%水合氯醛腹腔麻醉,75%乙醇浸泡后置于超净工作台,并固定四肢。膈下作横行切口暴露肝脏及隔膜,剪破隔膜并剪开胸腔皮肤和肋骨,暴露心脏及肺,使用磨平的注射器针头插入小鼠左心室;同时剪破右心耳使血液流出,灌注生理盐水,直至小鼠肝脏变白。取小鼠心、肝、脾、肺、肾各10 mg,取脑(嗅球、皮层、纹状体、海马、中脑黑质),置于4 ℃ PBS中漂洗;置于1.5 mL EP管中,加入胰酶,眼科剪剪碎组织至糊状,于37 ℃水浴消化30 min,每5 min吹打混匀1次;FBS终止消化,过700 μm细胞筛网得单细胞悬液。PBS洗3次,4%PFA固定10 min,流式细胞术检测,激发波长为488 nm。
1.5.4 台盼蓝活细胞检测 分别取各组组织单细胞悬液以1∶1加入台盼蓝溶液,染色3 min,取20 μL制作细胞涂片,显微镜下观察并计算细胞存活率。细胞存活率=活细胞数/总细胞数×100%。
1.6 统计学方法

2 结果
2.1 Pdots与Pdots-RVG的表征
PDI表示粒径分布的离散程度,PDI越小,说明粒子粒径分布越集中,PDI最佳范围为0.08~0.70。经粒度仪检测,Pdots平均粒径为105.10 nm,PDI为0.125,分散性好,Zeta电位为-33.83 mV;Pdots与RVG复合后,主要有两种粒径,但仅极少量Pdots-RVG粒径较大,平均粒径为339.13 nm,PDI为0.461,分散性良好,Zeta电位为-18.20 mV(图1、表1)。

图1 Pdots与Pdots-RVG粒径、Zeta电位分布图
表1 Pdots、PR平均粒径与Zeta电位
2.2 纳米材料的生物相容性
为研究Pdots-RVG作为药物载体的细胞毒性,使用梯度浓度的Pdots与Pdots-RVG与MN9D细胞共孵育48 h后,CCK-8试剂盒检测MN9D细胞的细胞存活率。实验结果显示,随着Pdots与Pdots-RVG浓度增加,细胞存活率均逐渐下降。在Pdots浓度为5 mg/L时,Pdots与Pdots-RVG组细胞存活率高于90.0%;当Pdots浓度为100 mg/L时,两组细胞存活率仍高于70%;且相同Pdots浓度下,两组间比较差异无统计学意义(P>0.05)。Pdots与Pdots-RVG均表现出较低的细胞毒性(表2)。

表2 不同浓度Pdots、PR处理后细胞存活率比较
2.3 MN9D细胞摄取纳米材料
制备的Pdots在荧光显微镜下呈点状散在绿色荧光颗粒。使用Pdots终浓度为5 mg/L的Pdots、Pdots-RVG与MN9D细胞共孵育1~12 h后,于激光扫描共聚焦显微镜下观察MN9D细胞对纳米材料的摄取。结果显示,Pdots在1 h时极少被摄取,随着共孵育时间延长,细胞摄取的Pdots材料逐渐增多,并较均匀散在分布于胞浆中。当Pdots连接了RVG后,1 h时已有部分材料被细胞摄取,随着时间延长,胞浆中纳米材料数量逐渐增多,荧光强度逐渐增强,并逐渐向核周聚集,但未穿透核膜进入核内。Pdots-RVG组与Pdots组相比,相同时间内Pdots-RVG组细胞摄取的Pdots更多(P<0.05),且在1 h时Pdots-RVG的细胞摄取量就已超过12 h时Pdots的摄取量(图2)。
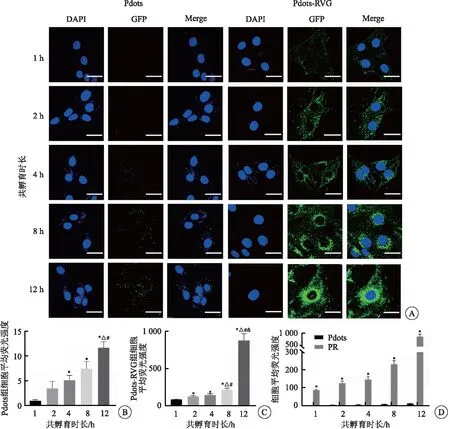
图2 MN9D细胞摄取纳米颗粒
2.4 Pdots-RVG穿过小鼠BBB并在脑及主要脏器中的分布
将组织制作为单细胞悬液,流式细胞术检测其Pdots阳性细胞数量,分析经腹腔注射后纳米材料的生物分布。经机械-酶消化的细胞呈分散状,少许粘连,杂质及细胞碎片较少,死亡细胞被台盼蓝染成蓝色(图3),共统计10个视野,计算细胞存活率为92.4%。经流式细胞术检测,Pdots在大脑中无分布,主要在心、肝、脾、肺中蓄积,在肾脏中有少量蓄积;Pdots-RVG则主要在脑(嗅球、皮层、纹状体、海马、中脑黑质)和心脏中蓄积,其余周围脏器中无蓄积(表3)。
图3 台盼蓝染色观察大脑皮层细胞完整性
表3 流式细胞术检测各组织中Pdots阳性细胞百分比
3 讨论
2020年世界卫生组织报道,包括阿尔茨海默病和帕金森病在内的神经退行性疾病、脑卒中的死亡人数日益上升,而大多数小分子药物和所有大分子药物(如重组蛋白、治疗性抗体和核酸)因分子大小、亲水性、解离度等特性均不能穿过BBB[10]。因此,开发能够有效将治疗剂转运到中枢神经系统的药物递送系统,对中枢神经系统疾病的治疗至关重要。
纳米颗粒在医学上广泛用于生物成像、药物输送、疾病的诊断和治疗[11-13],其中Pdots是近年研究热点。与传统有机小分子、半导体量子点和无机纳米材料相比,Pdots具有以下特点:1)高稳定性;2)明亮的荧光信号;3)低细胞毒性;4)可修饰及功能化的表面;5)可封装难溶于水的活性物质[14],能够作为荧光探针用于细胞标记及体内成像,同时封装药物进行递送。基于纳米技术,许多方法被广泛用于跨BBB转运治疗药物,例如受体介导的内吞作用、机械或超声破坏BBB、细胞穿透肽介导穿过BBB和纳米材料的鼻内递送等[15]。其中,受体介导的转运(receptor-mediated transport,RMT)是利用脑微血管内皮细胞的囊泡运输机制,通过BBB管腔侧的转铁蛋白受体、胰岛素和胰岛素样生长因子受体、低密度脂蛋白受体和nAChR等受体将相应蛋白质输送至大脑[16-17]。本研究采用特定配体RVG29对Pdots表面进行功能化,RVG29通过与脑微血管内皮细胞及神经元细胞上的nAChR特异性结合,使纳米复合物穿过BBB后进入神经元细胞内[6],以达到特异性递送至脑部的效果。
本研究结果表明,Pdots平均粒径为105.10 nm,Pdots-RVG平均粒径为339.13 nm,分散性均良好;Pdots Zeta电位为-33.83 mV,Pdots-RVG Zeta电位上升至-18.20 mV,表明Pdots与RVG成功复合。低浓度Pdots与Pdots-RVG的细胞毒性均较低,且两组间比较,差异无统计学意义(P>0.05)。Pdots-RVG与Pdots相比,能被神经细胞更多、更快地摄取。采用流式细胞术分析纳米颗粒的体内蓄积,尤其对脑部不同解剖学位置加以检测,以初步探究Pdots连接RVG后体内递送的改变。采用机械法与酶消化联合制备组织单细胞悬液[18-21],经台盼蓝染色后镜下观察细胞显示,单细胞悬液细胞存活率为92.4%,但细胞不够分散,可能是由于仅用胰酶消化,未采用胰酶-胶原蛋白酶联合消化所致。经流式细胞术检测,Pdots几乎不能通过BBB,并主要在心脏、肝脏和肺中蓄积;在制样中发现,脾脏的单细胞悬液呈淡红色,Pdots在脾脏中的高蓄积可能是由于未完全去除的红细胞所致。Pdots-RVG能够穿透BBB并在嗅球、皮层、纹状体、海马、黑质中蓄积,且在周围脏器的富集程度下降,表明Pdots连接了脑靶向生物分子RVG29后,能够穿过BBB并进入神经细胞内,但其递送速率及效率还有待研究。
综上所述,使用脑靶向分子RVG29与载体Pdots复合,建立Pdots-RVG纳米递送系统,能通过小鼠BBB并在脑内有明显蓄积。Pdots-RVG作为载体后续可搭载神经营养因子、抗氧化剂及基因靶向药物等神经治疗性药物,为治疗神经系统疾病提供了新的思路。

