鼠伤寒沙门菌CVCC541 rhs 基因内部元件缺失株的构建及其功能
王琬凝,董 震,2,3,王志林,陈启伟,吴锦燕,尚佑军,刘永生*,兰 喜*
(1.中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室,甘肃 兰州 730046;2.华南农业大学 兽医学院,广东 广州 510642;3.甘肃省定西市安定区畜牧兽医局,甘肃 定西 743000)
鼠伤寒沙门菌(Salmonellatyphimurium)是革兰阴性细菌,属于沙门菌 B 群,能广泛引起人和多种动物的胃肠炎和败血症,现在常被用作研究伤寒症的疾病模型[1-3]。研究发现革兰阴性菌已经进化出多种蛋白质分泌系统,利用不同的机制有效地将效应因子运输到胞外并发挥重要作用,到目前为止,已经在革兰阴性菌中发现有 9 种分泌系统[4]。其中 Ⅵ 型分泌系统(the type Ⅵ secretion system,T6SS) 最初在霍乱弧菌中被发现并广泛存在于革兰阴性菌中[5-6]。T6SS 能将效应因子由细菌细胞内膜转运到外膜并且直接刺入宿主细胞内[7]。在结构上 T6SS 类似于噬菌体尾鞘结构,呈针筒状[8]。rhs基因所表达的 RHS 蛋白为 T6SS 的效应因子,能通过 T6SS 输出到外界和宿主细胞[9]。目前在鼠伤寒沙门菌中发现了2个rhs基因,分别为rhs1 和rhs2,不同的是rhs1 内部可分为 3 段,为 N 端、核心区(core)和C 端,rhs2 没有 N 端,只有核心区和 C 端,因此,rhs1 和rhs2 一共有 5 个内部元件。各元件之间的分割标志是核心区两边的高保守区域,rhs2 只有核心区下游和C端之间的高保守序列[10]。在达卡气单胞菌中,序列“PVSMVTGEELL”位于 N 端之后且作为rhs核心的起点,而“TPDPxxLAGGxNxYxYxPNPTGWVDPLGL”为核心区和 C 端之间的高保守序列[11]。本研究所使用的菌株为 CVCC541,以菌株鼠伤寒沙门菌 14028s 的序列作为参考(CP001363.1)通过在 NCBI 上对高保守序列进行 BLAST 比对,在rhs1 (STM14_0340)和rhs2 (STM14_0342)中找到了与之对应的序列。“PVDVTTGQKIL”作为位于 N 端之后的rhs核心的起点;“ SQDPIGLRGGLNLYQYAPNPLKYIDPLGL ”在C 端之前作为rhs核心的终点,这一段在rhs1 和rhs2 中都存在。
本研究通过对 Red 同源重组系统各个步骤的条件进行摸索和优化,敲除了rhs1 基因中 N 端、核心区(core)、C 端以及rhs2 基因的核心区和 C 端,成功构建了缺失株Δrhs-1N、Δrhs-1core、Δrhs-1C、Δrhs-2core、Δrhs-2C以及回补株CΔrhs-1N、CΔrhs-1core、CΔrhs-1C、CΔrhs-2core和 CΔrhs-2C,并对缺失株、回补株和亲本株进行了对HeLa 细胞的黏附侵袭能力、小鼠腹腔巨噬细胞 RAW264.7 吞噬后存活能力和对小鼠毒力的探究。
1 材料与方法
1.1 菌株和质粒鼠伤寒沙门菌标准株 CVCC541、试验所需质粒 pKD46、pKD4、pCP20、pSTV28 均为实验室保存。本研究构建的缺失株为 Δrhs-1N、Δrhs-1core、Δrhs-1C、Δrhs-2core和 Δrhs-2C,回补株为CΔrhs-1N、CΔrhs-1core、CΔrhs-1C、CΔrhs-2core和 CΔrhs-2C。
1.2 主要仪器和试剂胶回收试剂盒、质粒提取试剂盒、高保真酶、PCR 酶、DL5000 Marker 购自大连 TaKaRa 公司;Fetal bovine serum (FBS)、0.25% Trypsin-EDTA(胰酶)、青链霉素(双抗)、RPMI-1640 培养基、DMEM 培养基购自美国 Gibco 公司;氨苄青霉素、卡那霉素、氯霉素购自北京索莱宝公司;L-(+)阿拉伯糖购自生工生物工程(上海)股份有限公司;小型离心机、24 孔细胞培养板购自美国 Thermo 公司;台式高速离心机、紫外分光光度计购自美国 Beckman 公司、PCR 仪、凝胶电泳仪、凝胶成像仪、电击仪、0.1 mm 电击杯、购自美国 Bio-Rad 公司。
1.3 引物设计以 NCBI 上公布的鼠伤寒沙门菌 14028s 的全基因组序列(CP001363.1)为参考序列,设计了目的基因打靶片段引物、缺失鉴定引物和回补扩增引物,目的基因打靶片段引物分别选取待敲除的元件序列前后 56 bp 作为同源打靶片段,并分别在其 3′端加上了从 pKD4 质粒上能扩增卡那霉素抗性基因的上下游引物作为打靶片段引物,引物序列如表1所示(j 为鉴定引物,h 为回补扩增引物,下划线为同源臂),由西安擎科泽西生物科技有限责任公司合成。

表1 引物序列及相关信息
1.4 鼠伤寒沙门菌rhs基因相关元件缺失株构建
1.4.1线性打靶片段的构建 将 pKD4 质粒稀释10倍作为扩增模板,使用相应的目的基因敲除引物和高保真酶进行 PCR 扩增,PCR反应条件:96℃ 5 min;98℃ 10 s,55℃ 5 s,72℃ 20s,32 个循环;72℃ 5 min。将获取的 PCR 产物进行二次扩增以消除 pKD4 质粒的影响,将 5~6 个凝胶孔中的产物收集起来进行胶回收,测定浓度后作为线性打靶片段于-20℃保存待用。
1.4.2CVCC541 感受态的制备及 pKD46 质粒的电转化 将 CVCC541菌液37℃,200 r/min 摇至D600≈0.8,在冰中放置30 min后分装至 50 mL 离心管,4℃、5 500 r/min 离心 5 min,弃掉上清后加入 20 mL 预冷的10%甘油,重悬后4℃、5 500 r/min 离心 5 min,重复 3 次后用 800 μL LB 重悬并分装至预冷的 1.5 mL EP 管中,每支 100 μL。将 5 μL pKD46 加入感受态中轻轻吹打混匀,转移至冷冻的电转杯中,电转仪电转条件为 200 Ω,25 μF,电压 2.3 kV,时间 2.5 ms,加入 1 mL LB 吹打后全部吸入至新的 1.5 mL EP 管中,28℃,200 r/min 复苏 2~3 h,取 100 μL 涂于含有 50 mg/L 氨苄青霉素抗性的 LB 平板上,28℃倒置培养 1~2 d。将长出的菌落挑单克隆,28℃ 摇至浑浊后通过 PCR 鉴定 pKD46,阳性的即为 CVCC541/pKD46。
1.4.3CVCC541/pKD46 感受态的制备及线性打靶片段的电转化 CVCC541/pKD46感受态制备过程见1.4.2。将 5 μL 线性打靶片段加入感受态中轻轻吹打混匀,转移至冷冻的电转杯中,使用电转仪进行电转,条件为 200 Ω,25 μF,电压为 2.3 kV,电击时间为 2.5 ms,加入1 mL LB 吹打后全部吸入至新的 1.5 mL EP 管中,28℃、200 r/min 复苏 2~3 h,取 100 μL 涂于含有 50 mg/L 卡那霉素的 LB 平板上,28℃ 倒置培养 2~3 d。挑单克隆菌落,28℃ 摇至浑浊后使用鉴定引物和 2 对交叉鉴定引物通过 PCR 鉴定待敲除片段是否被卡那霉素抗性片段替代,从而筛选出阳性重组子。
1.4.4pKD46 质粒的消除 将鉴定为阳性重组子的菌液在含有 50 mg/L 卡那霉素的 LB 平板上划线,挑取单克隆至含有 50 mg/L 卡那霉素的 LB 中,42℃,200 r/min 过夜摇振,第2天将浑浊的菌液分别在含有卡那霉素和氨苄青霉素的 LB 平板上划线,37℃ 倒置培养,挑选只在卡那霉素抗性的平板生长但不在氨苄青霉素抗性的平板上生长的单克隆,从而获得不含 pKD46 质粒且具有卡那霉素抗性的基因缺失菌株。
1.4.5卡那霉素抗性基因及质粒 PCP20 的消除 将不含 pKD46 质粒的且具有卡那抗性的基因缺失菌株按1.4.2制成感受态并加入 5 μL pCP20质粒进行电转化,涂布于含有 50 mg/L 氨苄青霉素的 LB 平板上,28℃ 倒置培养并使用鉴定引物通过 PCR 鉴定,将鉴定为已成功缺失的菌液在无抗性的 LB 平板上划线,挑单克隆在无抗性的 LB 中 42℃、200 r/min 过夜培养,将菌液分别在无抗性、含 50 mg/L 氨苄青霉素、含 50 mg/L 的 LB 平板上划线,挑选只能在无抗性平板上生长且在卡那霉素平板和氨苄青霉素平板上均不能生长的菌株进行 PCR 扩增,将 PCR 产物送至西安擎科泽西生物科技有限责任公司进行测序。
1.5 回补株的构建
1.5.1回补片段及质粒的构建 以 CVCC541 为模板,分别用相应的引物将需要回补的片段扩增出来并进行胶回收。使用限制性内切酶 EcoRⅠ和 HindⅢ对扩增片段和质粒 pSTV28 于 37℃ 双酶切 5 min 后再次胶回收。使用 T4 连接酶16℃ 过夜连接回补片段和pSTV28质粒后转化到 trans-T1 感受态中,通过含有 50 mg/L 氯霉素的LB平板筛选并通过 PCR 鉴定阳性克隆。将阳性克隆扩大培养后的菌液通过质粒提取试剂盒提出质粒并使用pSTV28质粒通用引物鉴定。
1.5.2制备缺失株的感受态及含回补片段质粒的电转化 缺失株感受态制备过程见1.4.2。将 5 μL 含回补片段的质粒加入感受态中轻轻吹打混匀,电转条件见1.4.3。37℃,200 r/min 复苏 2~3 h,取 100 μL 涂于含有 50 mg/L 氯霉素的 LB 平板上,37℃ 倒置培养过夜。将长出的菌落挑单克隆,37℃ 摇至浑浊后使用pSTV28质粒通用引物PCR鉴定,并将 PCR 产物送至西安擎科泽西生物科技有限责任公司进行测序。
1.6 CVCC541 亲本株与缺失株的生物学功能检测
1.6.1生长曲线测定 分别挑单菌落到 10 mL LB 中,37℃、200 r/min 培养到D600≈0.8 时,按 1∶100 转接到含 100 mL LB 培养基的锥形瓶中继续培养,每隔 1 h 测量D600的值,并使用 GraphPrism 软件绘制生长曲线图。取每个菌株D600≈0.7 时的菌液稀释涂板计数。做 3 个平行试验,试验重复 3 次。
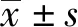
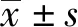
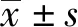
1.6.5小鼠致病力试验 将新鲜菌液培养至D600≈0.8,离心后用 PBS 重悬调整D600=1.0,将菌液稀释到 10-6,10-7梯度并涂板计数,调整细菌数为 2×109CFU/mL,实际计数以涂板菌落数为准。使用 20 g 的雌性昆明鼠,6 只为 1 组,每株菌 5 个梯度,分别为 2×109,2×108,2×107,2×106和2×105CFU/mL,每只小鼠注射 0.2 mL 菌液,阴性对照组每只注射 0.2 mL PBS。观察 7 d后记录死亡个数,并使用改良寇氏法计算 LD50。
2 结果
2.1 带同源臂的卡那抗性片段的扩增分别用目的基因rhs-1N、rhs-1core、rhs-1C、rhs-2core和rhs-2C的敲除引物扩增出目的条带为 1 628 bp 的带同源臂的卡那抗性片段,为二次扩增做准备(图1)。

M. DL5000 DNA Marker;1~10.扩增含 rhs-1N、rhs-1core、rhs-1C、rhs-2core和rhs-2C 同源臂的卡那霉素抗性片段
2.2 缺失株的构建分别用目的基因rhs-1N、rhs-1core、rhs-1C、rhs-2core和rhs-2C两侧的鉴定引物进行PCR 扩增 CVCC541 菌液,大小分别是 900,3 335,541,697和596 bp。用目的基因两侧的鉴定引物和 2 对交叉鉴定引物(目的基因鉴定引物-F/Kan-R、Kan-F/目的基因鉴定引物-R)进行 PCR 扩增由卡那霉素抗性片段替代目的基因的菌株,鉴定引物扩增大小分别为1 744,1 770,1 715,1 706和1 785 bp;交叉鉴定引物(目的基因鉴定引物-F/Kan-R,下文以Target gene-F/Kan-R表示;Kan-F/目的基因鉴定引物-R,下文以Kan-F/Target gene-R表示)扩增大小分别为1 047,1 007,1 184,1 189和1 210 bp;交叉鉴定引物(Kan-F/目的基因鉴定引物-R)扩增大小分别为1 186,1 252,1 020,1 006和1 064 bp;用目的基因rhs-1N、rhs-1core、rhs-1C、rhs-2core和rhs-2CPCR 扩增各自基因缺失株Δrhs-1N、Δrhs-1core、Δrhs-1C、Δrhs-2core和 Δrhs-2C菌液,大小分别为116,142,87,786和157 bp(图2)。测序结果显示,目的基因已被成功敲除,并且上下同源臂之间都残留了123 bp的疤痕序列。
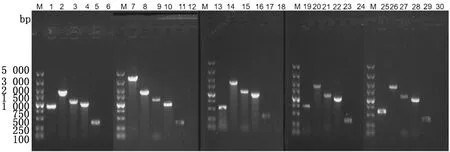
M.DL5000 DNA Marker;1,7,13,19,25.以目的基因rhs-1N、rhs-1core、rhs-1C、rhs-2core 和 rhs-2C两侧的鉴定引物分别进行菌液 PCR 扩增亲本株 CVCC541 菌液的结果;2,8,14,20,26.用两侧鉴定引物 PCR 扩增目的基因rhs-1N、rhs-1core、rhs-1C、rhs-2core 和 rhs-2C 被卡那霉素抗性片段替换的结果;3,9,15,21,27.用交叉鉴定引物(Target gene-F/Kan-R)PCR 扩增目的基因rhs-1N、rhs-1core、rhs-1C、rhs-2core 和 rhs-2C 被卡那霉素抗性片段替换的结果;4,10,16,22,28.用交叉鉴定引物(Kan-F/Target gene-R)PCR 扩增目的基因rhs-1N、rhs-1core、rhs-1C、rhs-2core 和 rhs-2C 被卡那霉素抗性片段替换的结果;5,11,17,23,29.用目的基因rhs-1N、rhs-1core、rhs-1C、rhs-2core 和 rhs-2C 两侧的鉴定引物PCR扩增缺失株Δrhs-1N、Δrhs-1core、Δrhs-1C、Δrhs-2core 和 Δrhs-2C的结果;6,12,18,24,30.阴性对照
2.3 回补株的构建分别用回补扩增引物扩增得到待回补的片段 CΔrhs-1N、CΔrhs-1core、CΔrhs-1C、CΔrhs-2core和 CΔrhs-2C,大小分别是1 363,3 874,1 120,1 058和1 168 bp,将构建好的回补质粒分别电转入用各缺失株制备的感受态,利用氯霉素抗性和PCR鉴定筛选阳性克隆,引物为pSTV28质粒的通用鉴定引物,构建好缺失株条带大小为1 456,3 967,1 213,1 151和1 256 bp(图3)。

M.DL5000 DNA Marker;1~5.扩增含 rhs-1N、rhs-1core、rhs-1C、rhs-2core和rhs-2C 的回补片段;6.阴性对照
2.4 生长曲线测定从图4可以看出 CVCC541、Δrhs-1N、Δrhs-1core、Δrhs-1C、Δrhs-2core和 Δrhs-2C的生长速率没有明显变化,说明 Δrhs-1N、Δrhs-1core、Δrhs-1C、Δrhs-2core和Δrhs-2C对细菌生长速率没有显著影响。回补株与亲本株和缺失株均无显著差异(图5)。D600≈0.7 时菌液的 CFU 均在 108这个数量级,没有显著差异。

图4 CVCC541、Δrhs-1N、Δrhs-1core、Δrhs-1C、Δrhs-2core 和 Δrhs-2C 的生长速率

图5 CVCC541、CΔrhs-1N、CΔrhs-1core、CΔrhs-1C、CΔrhs-2core 和 CΔrhs-2C 的生长速率
2.5 HeLa 细胞黏附试验CVCC541、Δrhs-1N、Δrhs-1core、Δrhs-1C、Δrhs-2core和 Δrhs-2C黏附率分别为 (10.36±1.32)%,(31.87±5.57)%,(36.55±6.10)%,(30.10±5.50)%,(35.34±7.80)%和(30.44±4.43)%;回补株的黏附率分别为(14.44±0.95)%,(15.29±2.10)%,(14.90±1.25)%,(14.93±2.15)%和(14.17±1.59)%(图6)。试验数据表明缺失株 Δrhs-1N、Δrhs-1core、Δrhs-1C、Δrhs-2core和 Δrhs-2C对 HeLa 细胞的黏附能力均有不同程度的上升,与亲本株相比黏附能力变化分别为 3.07(P<0.05),3.53(P<0.05),2.91(P<0.05),3.41(P<0.05)和2.94(P<0.05)。这表明rhs1、rhs2 基因每个元件都对细菌黏附能力有影响。回补株均与亲本株相比黏附能力无显著差异。

图6 CVCC541、Δrhs-1N、Δrhs-1core、Δrhs-1C、Δrhs-2core 和 Δrhs-2C对 HeLa 细胞的黏附率
2.6 HeLa 细胞侵袭试验CVCC541、Δrhs-1N、Δrhs-1core、Δrhs-1C、Δrhs-2core和 Δrhs-2C侵袭率分别为 (0.07±0.01)%,(1.89±0.38)%,(1.84±0.46)%,(1.51±0.38)%,(1.32±0.27)%和(1.62±0.4)%;各回补株的侵袭率分别为(0.27±0.09)%,(0.27±0.09)%,(0.29±0.07)%,(0.25±0.08)%和(0.28±0.07)%(图7)。试验数据表明缺失株Δrhs-1N、Δrhs-1core、Δrhs-1C、Δrhs-2core、Δrhs-2C对 HeLa 细胞的侵袭能力均有不同程度的上升,与亲本株相比侵袭能力变化分别为 2.58(P<0.01),2.51(P<0.05),2.06(P<0.05),1.88(P<0.05)和2.21(P<0.05),表明rhs1、rhs2 基因基因每个元件都对细菌侵袭能力有影响。回补株均与亲本株相比侵袭能力无显著差异。
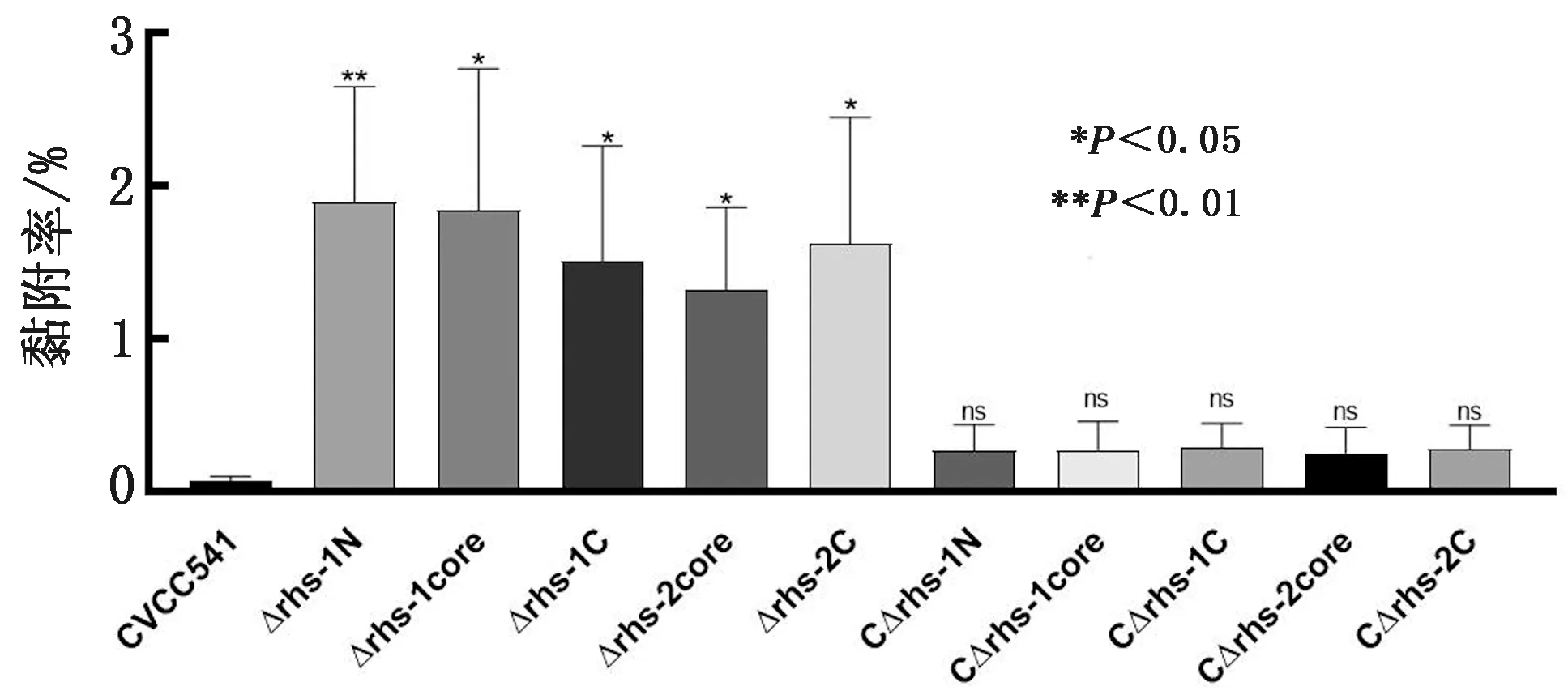
图7 CVCC541、Δrhs-1N、Δrhs-1core、Δrhs-1C、Δrhs-2core 和 Δrhs-2C 对 HeLa 细胞的侵袭率
2.7 小鼠腹腔巨噬细胞 RAW264.7 吞噬后存活试验CVCC541、Δrhs-1N、Δrhs-1core、Δrhs-1C、Δrhs-2core和 Δrhs-2C吞噬后存活率分别为(0.48±0.07)%,(3.30±0.62)%,(3.03±0.48)%,(3.17±0.56)%,(3.14±0.75)%和(2.69±0.51)%;各回补株的吞噬后存活率分别为(1.47±0.36)%,(1.42±0.32)%,(1.43±0.32)%,(1.45±0.34)%和(1.41±0.31)%(图8)。试验数据表明缺失株 CVCC541、Δrhs-1N、Δrhs-1core、Δrhs-1C、Δrhs-2core和 Δrhs-2C在巨噬细胞内的存活能力增强,与亲本株相比吞噬后存活能力变化分别为 6.85(P<0.01),6.30(P<0.01),6.59(P<0.01),6.52(P<0.01)和5.57(P<0.01)。回补株对RAW264.7细胞的吞噬后存活能力影响略有上升,且均有显著差异(P<0.05)。

图8 CVCC541、Δrhs-1N、Δrhs-1core、Δrhs-1C、Δrhs-2core 和 Δrhs-2C在小鼠腹腔巨噬细胞 RAW264.7 吞噬后的存活率
2.8 小鼠致病力试验通过菌落计数测得CVCC541、Δrhs-1N、Δrhs-1core、Δrhs-1C、Δrhs-2core和 Δrhs-2C注入老鼠腹腔菌量的原始浓度分别为 2.23×109,2.01×109,1.68×109,2.09×109,2.57×109和2.3×109CFU,根据小鼠死亡数通过改良寇氏法计算得出 CVCC541、Δrhs-1N、Δrhs-1core、Δrhs-1C、Δrhs-2core和 Δrhs-2C的 LD50分别为4.46×105,1.47×106,2.77×106,8.51×105,1.68×106和2.11×106CFU。由各菌株的 LD50得知Δrhs-1N、Δrhs-1core、Δrhs-1C、Δrhs-2core和 Δrhs-2C在小鼠体内的致病力下降了329%,621%,296%,377%和473% 。回补株对小鼠致病力分别下降了223%,426%,191%,354%和127%,但仍然未完全回复到亲本株水平。
3 讨论
在构建缺失株的过程中,大部分研究者在构建线性打靶片段时会使用 Dpn1 酶进行酶切,再进行胶回收,导致线性打靶片段的浓度很难维持在高水平,经过 2 次胶回收后片段质量浓度一般为 50~80 mg/L,经过摸索,我们对制备线性打靶片段的步骤进行了优化,改为第1步将鉴定好的 pKD4 质粒稀释10倍后进行 PCR 扩增,再对扩增的 PCR 产物分别使用相同的引物进行二次扩增,以消除 pKD4 质粒的影响,这样就能获得浓度很高(200~350 g/L)的线性打靶片段,且此方法操作简便,既节省时间又提高了重组的成功率。线性打靶片段和感受态最好在制备完成后立即使用。
rhs是一个复杂的基因,尽管它于 1984 年在大肠杆菌中就被发现,但对它的功能所知甚少[12]。关于rhs研究最多的是它与细菌的种内和种间竞争有关[9,13]。本研究中的rhs1 也被称为rhsmain,可分为 3 段,分别为富含 GC 碱基的 N 端、核心区和富含 AT 碱基的 C 端,也叫核心延伸;rhs2 也被称为rhsorphan,因为它缺少 N 端[14-15]。其中 N 端的的功能还不太清楚,可能通过 PAAR 起传递作用或者和 C 端一起作为分子伴侣使核心区更好地发挥功能;C 端是一个毒素结构域,与毒素的分泌相关,通过自身、main和orphan之间的 C 端以及与周围细菌中的rhsC 端不断的重组来获得可变的新的 RHS 毒素,从而达到抑制祖细胞的作用,对细菌的竞争和进化有着重要的作用[10-11,16]。PEI等[11]认为rhs的N端与核心区之间、核心区与 C 端之间可以通过自我切割而裂解,rhs1 的N端和 C 端作为分子伴侣协助核心区与 T6SS 的 VgrG 基因相互作用,但是 C 端又需要借助 N 端和核心区来传递所分泌的毒素。
细菌拥有一些毒素-抗毒素(toxin-antitoxin system,TA)模块,被称为TA系统。鼠伤寒沙门菌进入小鼠腹腔巨噬细胞后的复制由rhs基因发挥 Ⅱ 型毒素-抗毒素系统的作用,鼠伤寒沙门菌能够借助自身 TA 系统的毒素来调节自身的生化活性,而 TA 系统毒素的活性又受到该系统抗毒素的限制,当细菌响应不利环境条件时,毒素迅速从抗毒素中释放出来发挥毒性作用,从而减慢了细菌的生物学活性[17]。因此rhs1 和rhs2 无论是单缺失还是双缺失后,缺失株在巨噬细胞中的增殖能力都会变强,这可能是因为其缺少 RHS 毒素后在巨噬细胞内的生长速率提高造成的[10]。在前期研究中,实验室已有鼠伤寒沙门菌rhs1 基因和rhs2 基因的缺失株,并且发现无论是将rhs1还是rhs2 进行敲除,均会导致相较于亲本株,该菌对宿主的黏附侵袭及抗吞噬能力上升及对小鼠毒力下降。为了探究rhs基因内部元件对以上生物学功能的影响,本研究分别敲除了rhs的 N 端、核心区和 C 端元件后,结果发现,与亲本株相比缺失株在 LB 培养基中生长速率变化不大,但对 HeLa 细胞的黏附侵袭率和在小鼠腹腔巨噬细胞中的增殖能力均明显增强,而对小鼠的致病力均明显降低,表明rhs基因只要有部分缺失就会显著影响RHS自身毒性功能和对小鼠致病力的发挥,rhs基因似乎对黏附侵袭起着负调控作用,但却又在该菌的致病力方面承担着重要作用,因此,rhs基因可能起着复杂的双向调控作用,使细菌在进化或者免疫逃避中做出正选择,它可能在细菌与环境的相互作用以及细菌与宿主免疫系统的相互作用中具有重要作用[18]。本研究还发现,缺失rhs的 N 端、核心区或 C 端的任何一个元件,都会增强该菌的黏附侵袭和抗吞噬能力并且显著降低该菌对小鼠的致病力。但回补株对小鼠的致病力却并未完全回复,可能因为回补株是由质粒携带回补片段有关。因此rhs基因的每个元件都在维持RHS功能的正常发挥方面起着重要作用,rhs基因的各元件可能通过与彼此的相互作用来维持RHS结构的稳定组装并发挥相应的生物学功能,任何一个元件的缺失都会对其结构和功能的发挥造成很大的影响。
——一道江苏高考题的奥秘解读和拓展

