非洲猪瘟病毒野毒株与基因缺失株三重荧光定量PCR鉴别检测方法的建立及应用
郭振华,邢广旭,翁茂洋,金前跃,乔松林,张改平,2,3*
(1.河南省农业科学院 动物免疫学重点实验室,河南 郑州 450002; 2.河南农业大学 动物医学学院,河南 郑州 450002;3.江苏高校动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
自2018年8月非洲猪瘟(African swine fever,ASF)传入我国以来,给我国生猪产业带来了毁灭性的打击,生猪和猪肉价格高峰时是我国往常年份正常价格的3倍左右[1-2]。尽管通过生物安全的全面提升和精准剔除技术的应用,我国生猪产能得到了一定的恢复,但ASF的存在与流行,依然使得我国生猪产业显得相对脆弱。
ASF是由非洲猪瘟病毒(African swine fever virus,ASFV)引起猪的一种高度接触性传染性疾病,临床上以急性、热性、出血性、高发病率和高病死率为主要特征[3]。ASFV属于非洲猪瘟病毒科,非洲猪瘟病毒属,为有囊膜的双股DNA病毒,基因组大小为170~190 kb,编码150~200个蛋白[4]。根据B646L基因序列,ASFV可以分为至少23个基因型,当前在非洲以外地区(如中东欧、高加索和亚洲地区)流行的主要是基因Ⅱ型[5]。已有的研究显示,CD2v基因和MGF360/505基因簇是ASFV重要的毒力基因,通过两者的敲除可以显著降低ASFV的毒力,并且基因缺失株感染猪只后,可以对野毒株的攻击显示出一定的保护效果[1,6-7]。
早发现和早诊断对于ASF的防控至关重要,而荧光定量PCR检测技术因其高特异性、高敏感性和良好的时效性,已广泛应用于ASFV的诊断检测中[8]。但是ASF在我国流行2年多来,已经出现了一些新的情况,如农业农村部于2021年3月8日发布了《关于进一步严厉打击ASF假疫苗有关违法行为的通知》,表明我国ASF田间流行毒株已呈现出一定程度的复杂化。因此,有必要建立针对野毒株和基因缺失株的鉴别诊断方法。本研究旨在建立一种针对B646L、CD2v和MGF505-2R基因的三重荧光定量PCR检测方法,为ASFV的临床诊断提供技术支撑。
1 材料与方法
1.1 病毒核酸猪繁殖与呼吸综合征病毒HN07-1(KX766378)、伪狂犬病病毒HeNLH/2017(MT7-75883)、猪塞尼卡病毒HeNNY-1/2018(MK35-7116)、圆环病毒DF-1(JN119255)由本实验室分离保存。猪瘟弱毒疫苗、乙脑弱毒疫苗、流行性腹泻病毒和传染性胃肠炎病毒二联弱毒疫苗均购自武汉科前生物技术有限公司。
1.2 仪器设备与主要试剂荧光定量PCR仪(ABI 7500),美国ABI公司产品;核酸浓度测定仪NanoDrop One,美国ThermoFisher Scientific公司产品;病毒核酸提取试剂盒(TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0)、反转录试剂(PrimeScriptTMRT Master Mix)和探针法荧光定量试剂盒(Premix Ex TaqTM)均购自TaKaRa公司。
1.3 引物和探针设计合成根据ASFV株Pig/HLJ/2018(MK333180)的基因组序列,通过Primer3Plus(http://www.primer3plus.com)和Primer express 3.0.1软件针对B646L、MGF505-2R和CD2v基因进行引物和探针的设计。引物和探针均由生工生物(上海)股份有限公司合成(表1),引物和探针用无菌水稀释到10 μmol/L,于-20℃保存。

表1 引物和探针序列
1.4 标准质粒的制备B646L(1 941 bp)、MGF505-2R(1 581 bp)和CD2v(1 083 bp)基因委托生工生物(上海)股份有限公司直接合成到pUC57质粒上作为标准质粒,分别为pUC57-B646L、pUC57-MGF505-2R和pUC57-CD2v;质粒浓度用NanoDrop One进行测定,并进一步换算为拷贝数,作为荧光定量PCR的标准品。基因拷贝数计算公式如下:拷贝数(copies /mL)= [质粒DNA的质量浓度(g/mL)/(质粒DNA长度×660)]×6.02×1023。
1.5 敏感性及标准曲线的绘制经过引物和探针浓度的摸索,最终确定25 μL最佳反应体系为Premix Ex Taq 12.5 μL,引物和探针在反应体系中的终浓度为0.1 μmol/L,ROX Reference DyeⅡ0.25 μL,模板取5 μL,并用无菌水补足25 μL。反应条件为95℃ 20 s,95℃ 3 s,60℃ 30 s,共计40个循环。为进一步绘制标准曲线,3种标准质粒按照1∶1∶1的体积比进行混合,然后进行10×倍比稀释,在100~108拷贝数范围内进行扩增,初步确定所建立方法检测的敏感性;同时在循环次数(Ct值)15~30的范围内,以标准质粒的浓度为x轴,以Ct值为y轴,生成标准曲线。
1.6 最低检测下限的确定根据敏感性检测的结果,将混合的标准质粒做进一步的稀释,分别设101,0.5×101,100copies/μL 3个浓度,用建立的三重荧光定量PCR检测方法对每个浓度做12次重复检测,以全部检测阳性作为该方法针对基因的检测下限。
1.7 特异性试验以PRRSV、PEDV、TGEV、JEV、CSFV、JEV和SVA的cDNA,PCV2和PRV的DNA,ASFV的DNA和标准品pUC57-B646L、pUC57-MGF505-2R和pUC57-CD2v质粒为模板,同时设立以纯净水为模板的阴性对照,进行荧光定量PCR检测,以评估所建立检测方法的特异性。
1.8 重复性实验选取102~107copies/μL 6个稀释度的重组质粒标准品,分别做3批重复检测,每批次内每个稀释度均设3个重复,并计算批内和批间的标准差及变异系数,以评估所建立检测方法的稳定性和重复性。
1.9 临床核酸样品检测ASFV阳性样品的核酸提取物由某养殖企业提供,为2020年6-12月间,对运猪车表面残留的粪便和血渍进行常规采样监测而获得,共计30份核酸提取物。用本研究建立的方法和OIE推荐的方法进行平行检测,比较两者在临床样品检测中的一致性。
2 结果
2.1 质粒标准品浓度测定经测定换算,质粒标准品的最终浓度分别为2.6×108copies/μL(pUC57-B646L)、2.8×108copies/μL(pUC57-MGF505-2R)和3.2×108copies/μL(pUC57-CD2v),经10×倍比稀释至100备用。
2.2 条件优化及标准曲线绘制在25 μL的反应体系中,比较了引物和探针的终浓度分别为0.1,0.2和0.3 μmol/L时的扩增效果。最终选择的扩增体系如下:Premix Ex Taq 12.5 μL,引物和探针的终浓度为0.1 μmol/L,ROX Reference DyeⅡ0.25 μL,模板取5 μL,并用无菌水补足25 μL。使用ABI 7500 Fast Real-Time PCR System的最佳反应程序:95℃ 20 s,95℃ 3 s,60℃ 30 s,共计40个循环。
进一步在模板浓度为101~107copies/μL时,可以获得良好的扩增动力学曲线。如图1所示,B646L基因对应的标准曲线为y=-3.214x+37.54,相关系数R2=0.999,扩增效率为104.7%(图1A);MGF505-2R基因对应的标准曲线为y=-3.314x+38.43,相关系数R2=1,扩增效率为100.31%(图1B);CD2v基因对应的标准曲线为y=-3.326x+39.82,相关系数R2=1,扩增效率为99.85%(图1C)。
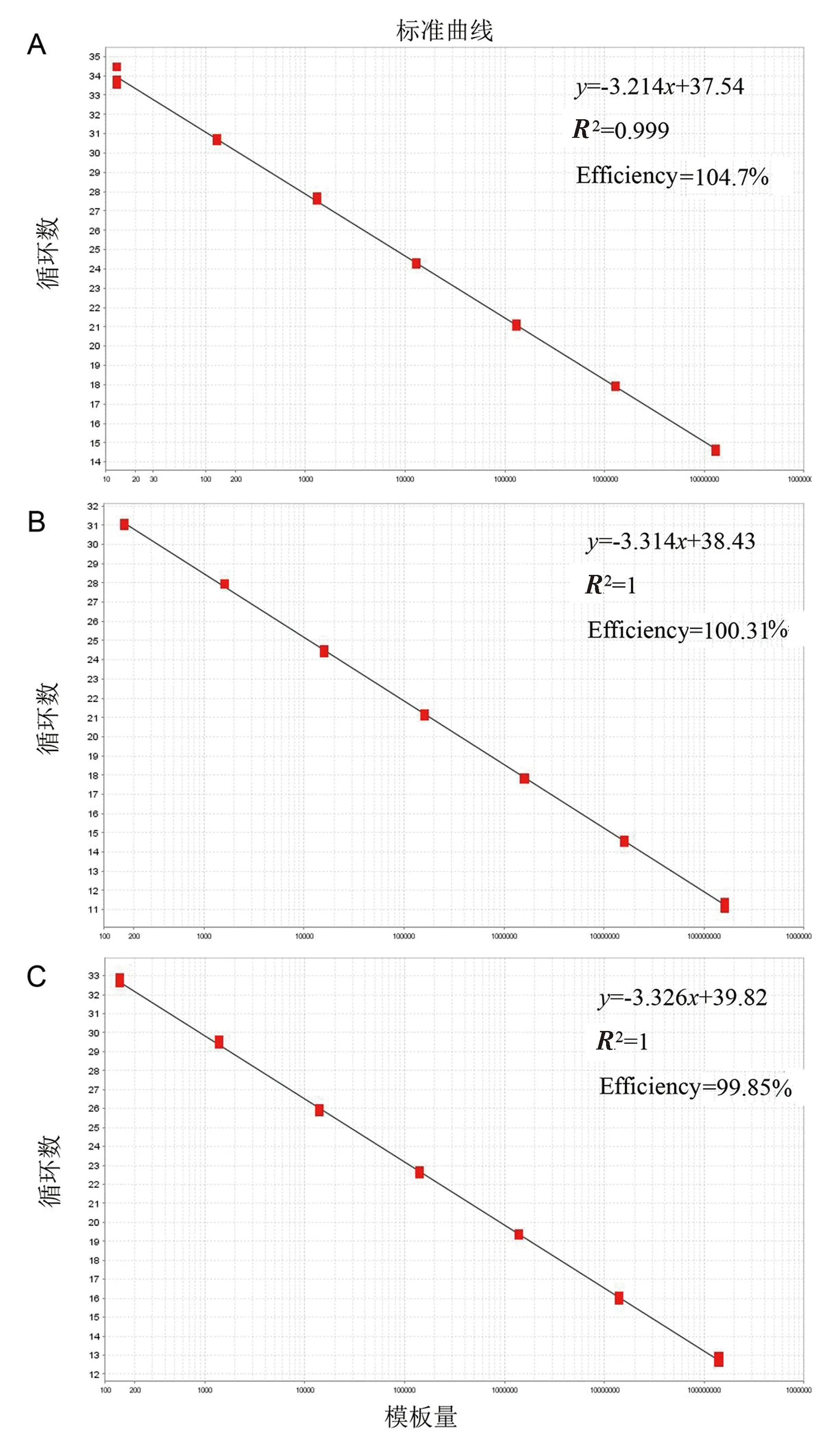
A~C.pUC57-B646L、pUC57-MGF505-2R和pUC57-CD2v标准质粒的稀释浓度分别为2.6×107~2.6×101,2.8×108~2.8×102和3.2×108~3.2×102 copies/μL
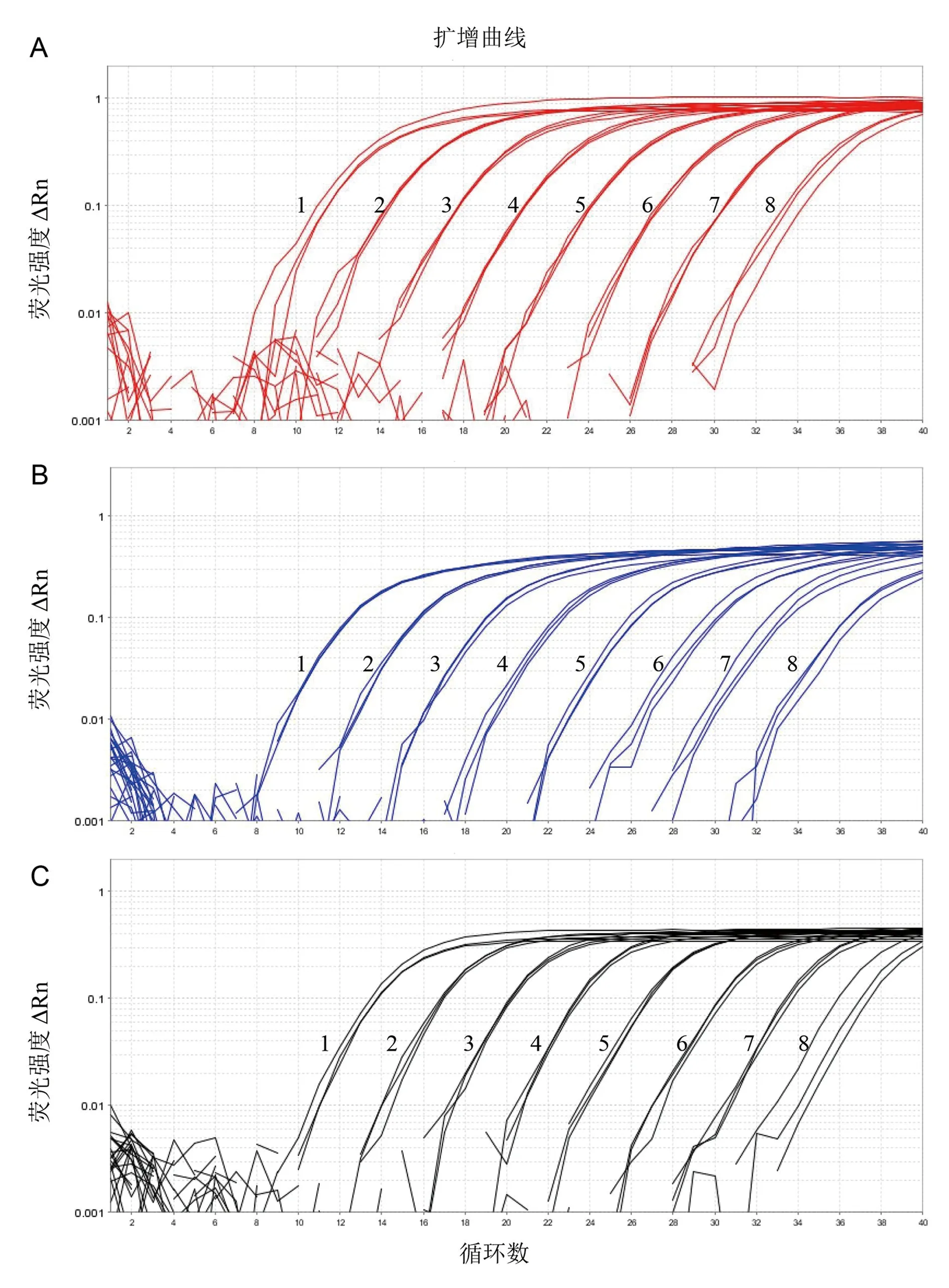
2.3 特异性试验以ASFV DNA和3个标准质粒的混合物为阳性对照,以PRRSV、PEDV、TGEV、JEV、CSFV、JEV和SVA的cDNA,PCV2和PRV的DNA为模板,以无菌水为阴性对照,用建立的三重荧光定量PCR检测方法进行检测,如图2所示,阳性对照组可以出现特异性的扩增曲线,而含有其他病原cDNA或者DNA的样品检测均为阴性,表明本研究建立的检测方法具有良好的特异性。
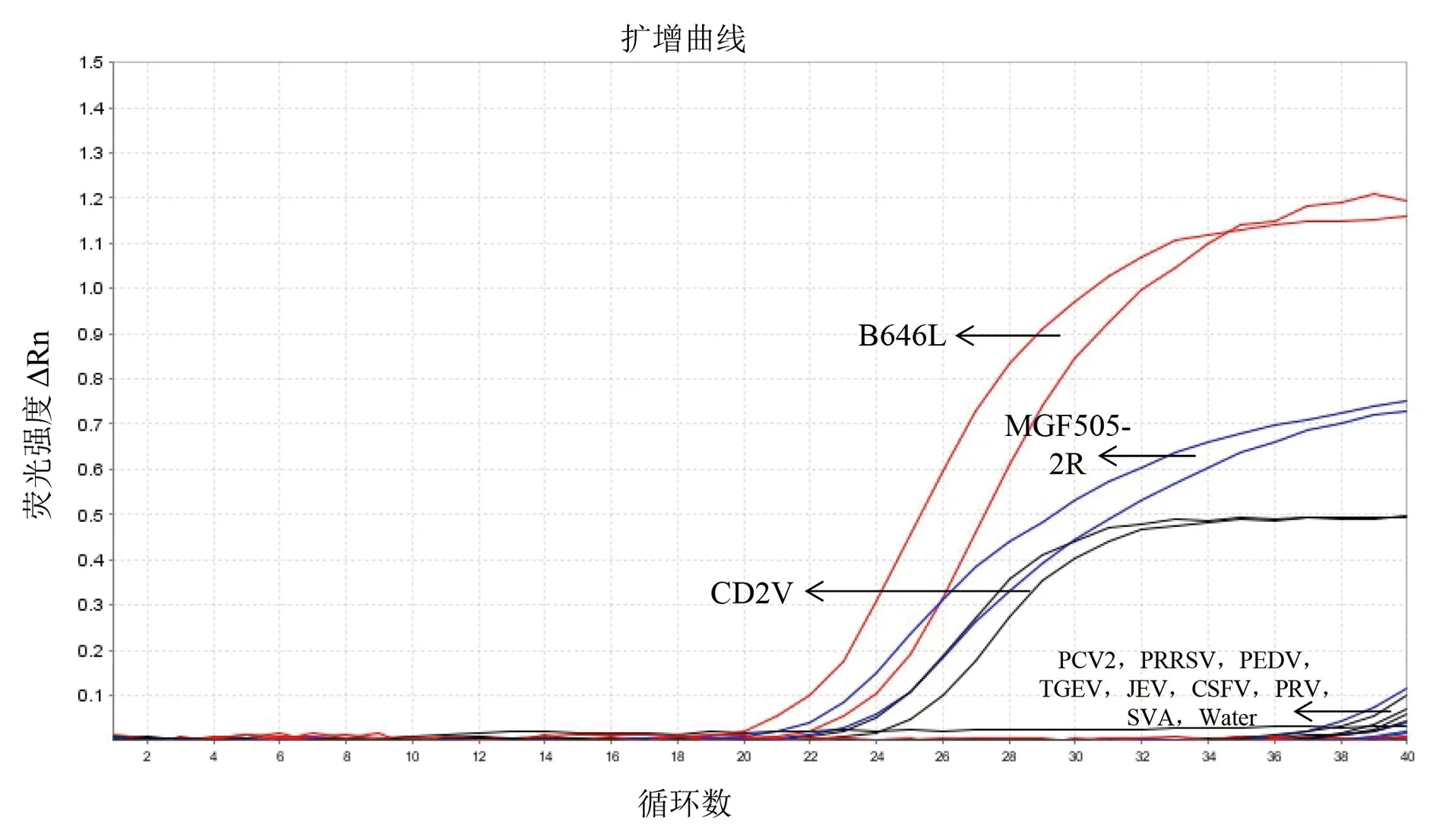
图2 三重荧光定量PCR特异性分析
2.4 敏感性试验对质粒标准品分别做10×倍比稀释,使标准品浓度在101~108copies/μL之间,用设计的引物和探针进行荧光定量PCR检测。如图3所示,建立的荧光定量PCR检测方法均可获得良好的扩增曲线。为进一步确定最低检测下限,进一步设定101,0.5×101,100copies/μL 3个浓度,用建立的三重荧光定量PCR检测方法对每个浓度做12次重复检测,以全部检测结果为阳性作为该基因片段的检测下限。结果见表2,针对B646L基因的检测下限为6.5 copies/μL,针对MGF505-2R基因的检测下限为8 copies/μL,针对CD2v基因的检测下限为14 copies/μL。
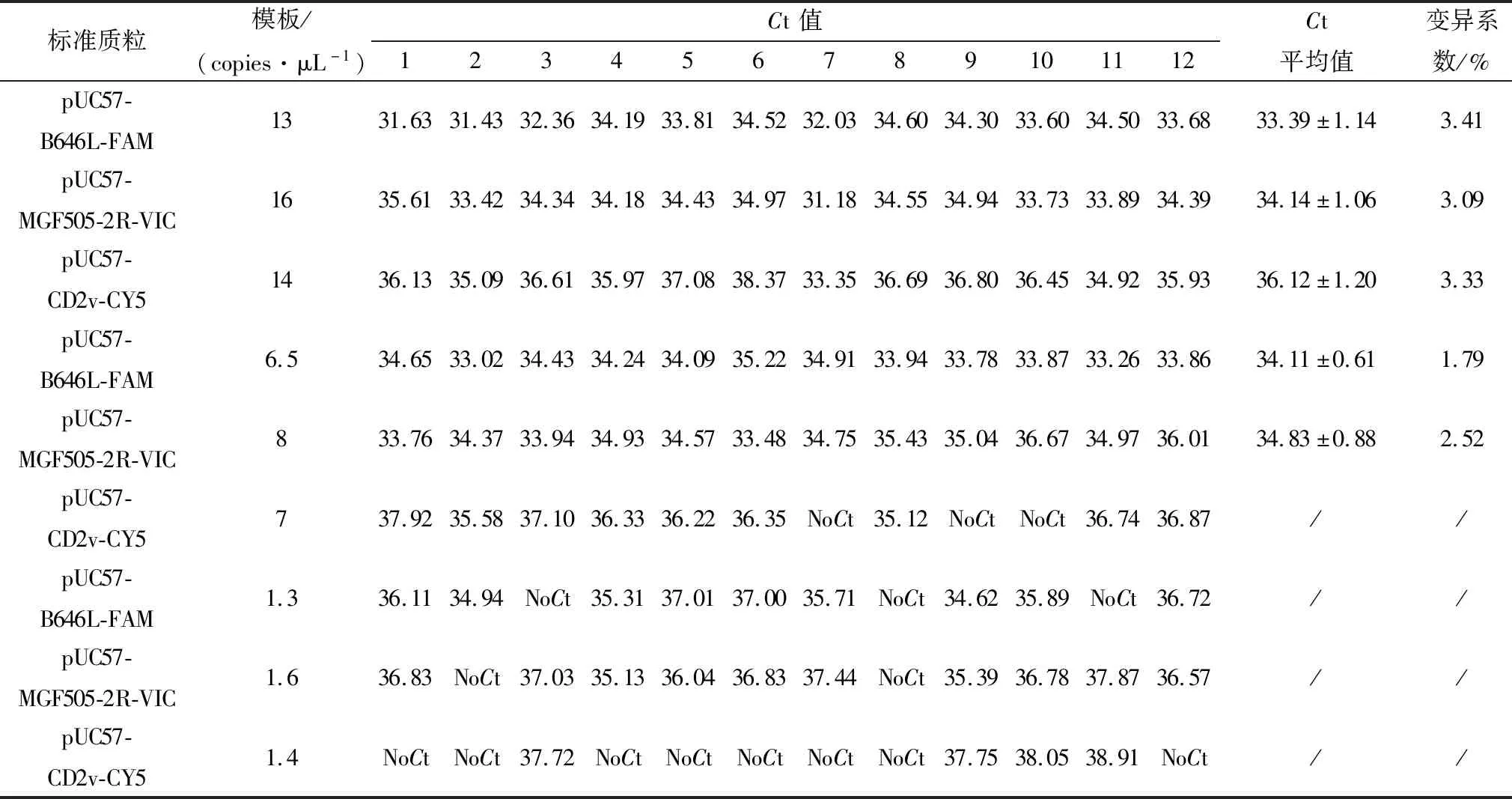
表2 最低检测限分析
2.5 重复性试验以不同浓度的质粒标准品为模板进行批次内和批次间的重复性检测,结果如表3所示,当模板浓度在102~107copies/μL之间时,对应Ct值在15~30之间时,组内变异系数为0.10%~1.17%,组间变异系数为0.05%~2.68%,表明建立的三重荧光定量PCR检测方法具有良好的稳定性和重复性。
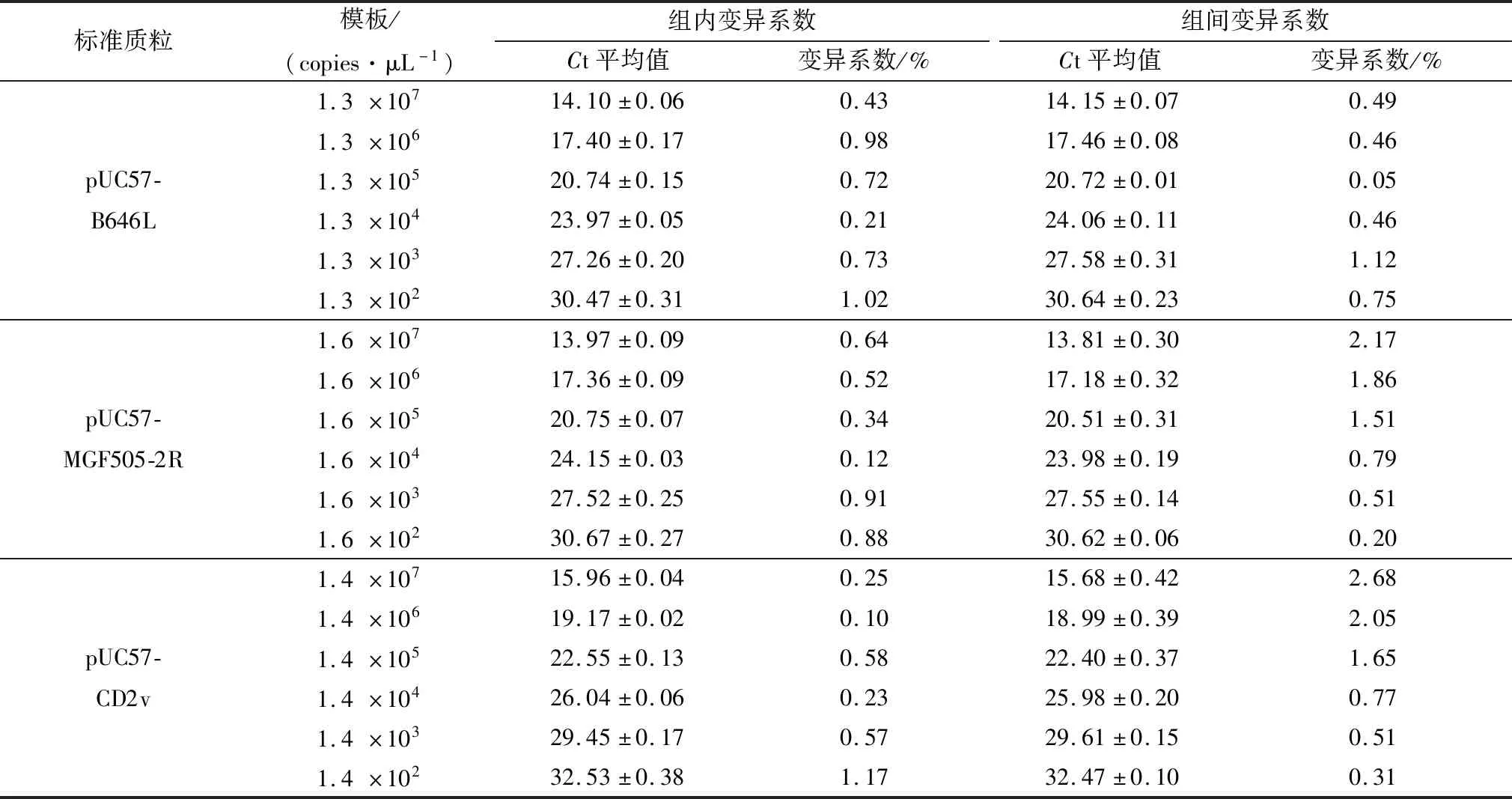
表3 ASFV核酸三重荧光定量PCR检测方法重复性试验结果
2.6 临床样品检测针对30份ASFV阳性样品的核酸提取物,分别用本研究建立的三重荧光定量PCR检测方法和OIE推荐的荧光定量检测方法进行平行检测(表4)。结果显示,建立的方法在检测B646L基因时,与OIE的检测结果具有良好的吻合性;此外,针对MGF505-2R和CD2v基因的检测也均获得了良好的扩增曲线,在检测的样本中,未发现有基因缺失株。
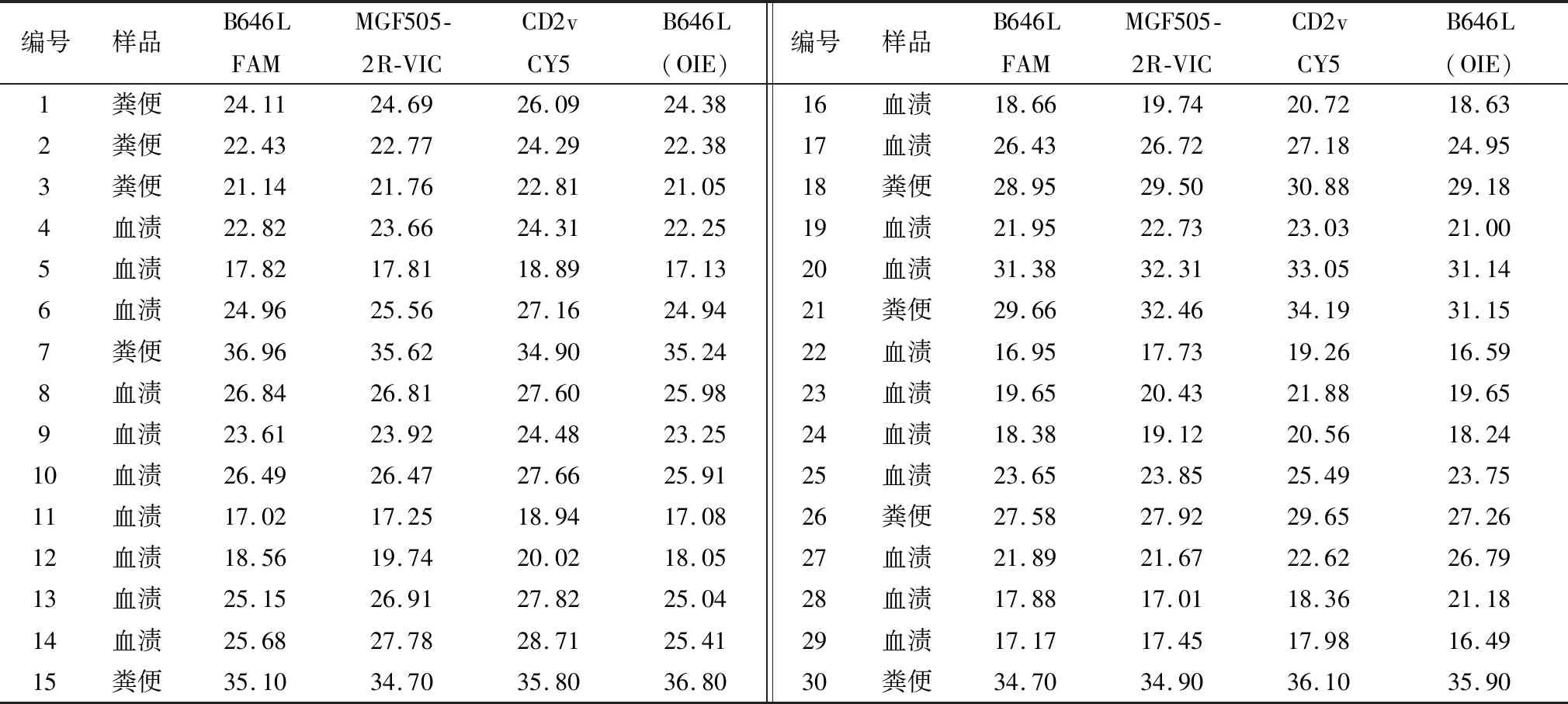
表4 临床样品检测结果 Ct 值
A~C.pUC57-B646L、pUC57-MGF505-2R和pUC57-CD2v标准质粒的稀释浓度分别为2.6×108~2.6×101,2.8×108~2.8×101和3.2×108~3.2×101 copies/μL
3 讨论
自2018年8月ASF在我国首次报道以来,已经给我国生猪产业造成了巨大的经济损失[11]。特别是2020年下半年以来,ASF在我国的流行出现了一些新的情况,如张艳艳等[12]报道了1株CD2v基因缺失株,SUN等[13]报道了CD2v基因自然变异导致吸附红细胞功能丧失的弱毒株;此外,以CD2v和MGF360/505为代表的单基因或者双基因缺失的假疫苗毒已经成为新的传染源和污染源[11],使得我国ASF的流行情况更为复杂,这些均对我国生猪产业的复产和ASF的防控构成了新的挑战。
荧光定量PCR/RT-PCR检测技术因其高特异性、高敏感性和快速高效的特点,是临床诊断中应用最为广泛的核酸诊断技术[9-10,14-16]。如任名等[17]和吴亚楠等[18]均建立了基于B646L基因的TaqMan荧光定量PCR检测方法;吴映彤等[19]利用重组酶聚合酶扩增等温检测技术建立了针对MGF360-12L基因的检测方法,最低检测限达到103copies/μL,与常规PCR方法检测限相当,但仅需35℃作用30 min,即可实现对目的片段的稳定扩增;王之莹等[20]将PCR技术和胶体金试纸条技术相结合,基于B646L基因,开发了一种简单、快速和低成本侧流核酸测定试纸条,最低检测限也和常规PCR相当。可见当前报道的以及OIE推荐的ASFV的核酸检测技术主要是基于B646L基因来进行开发的,无法对基因缺失毒株(如CD2v和MGF360/505)进行鉴别诊断。
本研究中,我们在前期B646L和MGF505-2R基因双重荧光定量PCR的基础上[16],针对CD2v基因设计了新的引物和探针,经过引物、探针的筛选,确立了FAM(B646L)、VIC(MGF505-2R)和CY5(CD2v)荧光标记的三重荧光定量检测方法,且整个反应可在1 h内完成。特异性分析显示,该检测方法与猪场常见的病毒核酸如PCV2、PRRSV、PRV、CSFV、JEV、PEDV和TGEV等均不发生交叉反应;敏感性分析显示,该检测方法针对B646L、MGF505-2R和CD2v标准质粒的最低检测下限分别为6.5,8.0和14.0 copies/μL;且该方法在模板浓度为101~107copies/μL之间具有良好的线性扩增关系,相关系数R2>0.999,扩增效率为99.85%~104.70%;稳定性分析显示,当模板浓度为102~107copies/μL 时,组内变异系数为0.10%~1.17%,组间变异系数为0.05%~2.68%,提示该方法重复性良好。进一步针对运猪车ASFV阳性样品的核酸提取物检测显示,针对B646L的基因检测结果和OIE推荐的检测方法完全一致,且针对MGF505-2R和CD2v基因均出现了特异性的扩增曲线。提示本研究中并未监测到基因缺失株,也说明基因缺失株在临床的流行率偏低,ASFV野毒株依然是当前主要流行毒株。
综上所述,本研究成功建立一种同时检测ASFV B646L、CD2v和MGF505-2R基因的三重荧光定量PCR检测方法,该方法具有良好的特异性、敏感性和稳定性,从而为临床ASFV的鉴别诊断提供了理论依据。
——一道江苏高考题的奥秘解读和拓展

