基于TLR4/MyD88/NF-κB信号通路探究N-乙酰半胱氨酸对肺气肿大鼠的干预效果
拉周措毛 德毛措
(1青海大学附属医院,青海 西宁 810001;2青海省海南州人民医院)
肺气肿是由支原体病原菌感染所造成,是急性呼吸感染类病症的一种,伴随当下患肺气肿人口基数不断上升,其发病、预防已变成全球公共健康问题〔1,2〕。作为治疗肺气肿的常用药物,N-乙酰半胱氨酸对治疗肺气肿引起的呼吸急促症状、肺部病灶组织、信号通路有优良的药理作用,同时也是国内治疗肺气肿的优等药物〔3~5〕。本研究基于Toll样受体(TLR)4/髓样分化因子(MyD)88/核转录因子(NF)-κB信号通路,探讨N-乙酸半胱氨酸对肺气肿大鼠的干预效果。
1 材料与方法
1.1材料 研究动物:选取60只SPF级雄性大鼠,购自成都岐黄博恩生物科技有限公司,动物许可证号:SYXK(川)2020-225,8~10周龄,平均体重(253.77±25.96)g,于湿度28%~35%、温度(21.73±1.76)℃下,培养10 d,给予持续光照18 h/d。本研究操作已获医院伦理委员会审批同意,且严格参照动物实验伦理要求相关规定进行。主要试剂:人胎盘脂多糖注射液由湖南一格制药有限公司提供(国药准字:S43020003,规格:12 ml),酶联免疫吸附试验(ELISA)试剂盒及有关试剂由江西艾博因生物科技有限公司提供,生理盐水由艾美捷科技有限公司提供,兔抗人TLR4由武汉益普生物科技有限公司提供,小鼠抗大鼠MyD88/NF-κB由上海梵态生物科技有限公司提供。N-乙酰半胱氨酸片(海南赞邦制药有限公司,国药准字:H20080326,规格:600 mg)。
1.2分组和建模 按照整群随机法将60只SPF级大鼠分为对照组、模型组、N-乙酰半胱氨酸低剂量组、高剂量组各15只,对照组不采取任何操作,正常喂养,模型组、N-乙酰半胱氨酸低剂量组、高剂量组均依据马凤萍等〔6〕研究构建肺气肿大鼠模型,各组大鼠适应性饲养7 d后采用熏烟结合气管内滴注脂多糖的方法进行造模。分别两次向大鼠气管内滴注脂多糖0.2 ml/只(1 mg/ml),将模型组、N-乙酰半胱氨酸低剂量组、高剂量组大鼠置于自制熏烟箱内熏烟,2次/d,每日11时、17时各点燃1次熏烟箱,每次熏烟数量12支(山东将军牌卷烟)。熏烟期间保证供给各组相同的食物、饮水,灌注脂多糖注射液后将大鼠仰卧位固定,旋转固定板使脂多糖均匀分布两肺。建模成功表现:观察建模过程中模型组、N-乙酰半胱氨酸低剂量组、高剂量组大鼠症状,是否符合肺气肿病理表现,即在建模过程中,随着时间推移,与对照组比较,模型组、N-乙酰半胱氨酸低剂量组、高剂量组大鼠开始出现活动量慢慢减少,喜蜷缩,撮毛,毛发缺少光泽、逐渐枯黄且容易脱落,喘息气促,呼吸表浅,偶尔可听见气道有辘辘水声。烟熏周期慢慢增加后,除对照组外,其余各组上述症状逐渐加重,且体重较对照组明显减轻,表明大鼠肺功能减退,符合肺气肿病理表现。
1.3药品干预方法 N-乙酰半胱氨酸低剂量组灌胃给予N-乙酰半胱氨酸片100 mg,3次/d,N-乙酰半胱氨酸高剂量组灌胃给予N-乙酰半胱氨酸片200 mg,3次/d,对照组、模型组等剂量生理盐水灌胃,连续给药2 w。
1.4样本采集 各组采集静脉血5 ml,之后随机选用各组3只大鼠,常规麻醉处死收集大鼠肺部脏器组织,分为3份,2份存于液氮内,以待后续指标检验,1份用于制备切片检验。
1.5大鼠肺组织肺气肿相关征象 提取肺部脏器组织并实施脱蜡、切片、脱水措施,且用苏木素-伊红(HE)对肺部脏器切片进行染色,利用光学显微镜观察其组织结构。采用肺组织病理半定量法,分析其平均肺泡面积(MAA)、肺泡平均内衬间隔(MLI)指标。
1.6肺功能相关指标水平检测 采用动物肺功能检测仪(安徽电子科学研究所)检测各组大鼠肺功能相关指标。随机选用各组2只大鼠麻醉、消毒、切开颈部皮肤,使其气管呈倒T形切开,使用食道插管经口插入大鼠食道中部,连接压力传感器记录采集信号,处死大鼠。通过肺功能分析系统(MPA)分析得出各组气道阻力(AR)、肺动态顺应性(Cdyn),峰流速值(PEF)水平,并取平均值。
1.7检验肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β、IL-6指标 ELISA检测TNF-α、IL-1β、IL-6水平,实验过程:样本采集、保存参照1.4;提前30 min取出西卡林试剂盒(SIKARU,加拿大),放置室温;将浓缩洗涤液以1∶30的比例用双蒸水稀释;配制酶结合物工作液,用试剂稀释液稀释浓缩酶结合物(1∶100)产生酶结合物工作液;打开试剂盒,将试剂稀释液混合样本添加于西卡林试剂盒酶标板孔中,放置10 min,观察数值并记录样本浓度;将不同浓度样本加入样本孔中,在每个样本孔中加入5 μl样本稀释液和样本,再依次加入50 μl生物素化抗体工作液,使用封板胶纸密封反应孔,放置30 min,读取数值;清洗酶标板孔5次,使洗涤液350 μl置入每孔,等待1.35 min后清理孔内液体,用吸水纸干燥;使用普卡自动微粒免疫器(PUKEI 日本)再次测验样本TNF-α、IL-1β、IL-6浓度并记录;对TNF-α、IL-1β、IL-6指标进行测验,95℃、5 min;60℃、持续30 s,共进行30个循环,室温处理30 min废弃液体,使用洗液清洗5次,3 min/次,遗弃废液;每孔加90 μl底物溶液,室温处理20~25 min,每孔加入50 μl终止溶液,终止反应;在酶标仪上450 nm波长下调节、读取指标数值。
1.8检验肺部病灶组织TLR4/MyD88/NF-κB信号通路指标 采用Western印迹检测TLR4、MyD88、NF-κB信号通路指标。先选用存储在液氮内的肺部病灶组织,收集其组织总蛋白,采集38 μg蛋白质,经电泳90 min后,传送到聚偏氟乙烯(PVDF)膜,于24℃下,实行封闭操作,再向其加1∶1 500的洗涤缓冲液(TBST)提供给稀释后的TLR4信号通路一抗,使用浓度为0.08%辣根过氧化氢酶标识MyD88/NF-κB二抗,于27℃下进行操作。在避光环境下,采用电化学发光(ECL)显色30 min,然后采用凝胶成像分析软件(LABWORK),进行扫描操作,获取胶片,计算TLR4、MyD88、NF-κB信号通路指标。
1.9统计学处理 采用SPSS26.0软件进行方差分析。
2 结 果
2.1各组肺组织肺气肿相关征象对比 对照组肺部细胞基质整齐排列、形态正常、结构明显;模型组肺部细胞基质排列参差不齐,出现重度气球样变形、坏死;N-乙酰半胱氨酸低剂量组肺部细胞基质排列不整齐,出现重度浮肿,局部的气球样变形、坏死;N-乙酰半胱氨酸高剂量组肺部细胞基质排列参差不齐,出现轻度浮肿,细胞形态正常、结构较为明显。与对照组相比,其余3组MAA、MLI显著升高(P<0.05);与模型组相比,N-乙酰半胱氨酸低剂量组及高剂量组MAA、MLI显著降低(P<0.05);与N-乙酰半胱氨酸低剂量组相比,N-乙酰半胱氨酸高剂量组MAA、MLI显著降低(P<0.05)。见图1,表1。

图1 各组肺部病灶组织病理学观察(HE染色,×400)

2.2各组肺功能相关指标对比 与对照组相比,其余3组AR明显升高、Cdyn、PEF明显降低(P<0.05);与模型组相比,N-乙酰半胱氨酸低剂量组及高剂量组AR明显降低、Cdyn、PEF明显升高(P<0.05);与N-乙酰半胱氨酸低剂量组相比,N-乙酰半胱氨酸高剂量组AR明显降低,Cdyn、PEF明显升高(P<0.05)。见表1。
2.3各组TNF-α、IL-1β、IL-6水平对比 与对照组相比,其余3组IL-1β、TNF-α水平显著降低,IL-6水平显著升高(P<0.05);与模型组相比,N-乙酰半胱氨酸低剂量组及高剂量组IL-1β、TNF-α水平显著升高,IL-6水平显著降低(P<0.05);与N-乙酰半胱氨酸低剂量组相比,N-乙酰半胱氨酸高剂量组IL-1β、TNF-α水平显著升高,IL-6水平显著降低(P<0.05)。见表2。
2.4各组肺部病灶组织TLR4/MyD88/NF-κB信号通路指标对比 与对照组相比,其余3组TLR4、MyD88、NF-κB信号通路指标显著升高(P<0.001);与模型组相比,N-乙酰半胱氨酸低剂量组及高剂量组TLR4、MyD88、NF-κB信号通路指标显著降低(P<0.05);与N-乙酰半胱氨酸低剂量组相比,N-乙酰半胱氨酸高剂量组TLR4、MyD88、NF-κB信号通路指标显著降低(P<0.05)。见表2,图2。
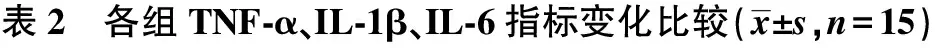
3 讨 论
研究认为,肺气肿目前已经成为临床上研究的热点,是一类高发生率病症,其发生与多种因素共同作用相关〔7~10〕。虽然诊治肺气肿的手段技术在不断提高,肺气肿的诊治方案也在不断改善,可其造成的病痛伤害是不可逆的〔11〕。肺气肿的特点是早期没有症状,极其不易被发现和忽略,易发生慢性阻塞性肺疾病等并发症〔12〕。
据研究报道〔13~15〕,N-乙酰半胱氨酸是一种治疗肺气肿的高效率药品,呈现植物蒜气味,乳白片剂,作为抑制肺气肿的优良药品,已在中国肺气肿临床使用上有悠久的历史。研究认为〔16~18〕,N-乙酰半胱氨酸在肺气肿里的作用机制是其与抑制线粒体呼吸链电子传递、抑制呼吸与氨基酸、糖和蛋白质代谢中间产物的氧化和脱氢有关,通过抑制核酸及蛋白质合成,抑制病原菌生长。N-乙酰半胱氨酸还可抑制肺部急剧感染,修复气道壁稳态细胞基质,继发感染状态下,N-乙酰半胱氨酸也可抑制肺部黏膜异常。通过这种手段N-乙酰半胱氨酸使肺部病灶组织细胞基质生长环境优良,抑制病原菌生长异常。N-乙酰半胱氨酸能第一时间作用于肺部病灶组织,极大地增加了肺气肿的诊断效能。由此本研究推测,N-乙酰半胱氨酸治疗后各项指标均优化,诊断效能较高。
TNF-α、IL-1β、IL-6指标常被用于评估肺气肿的病情,TNF-α是肺气肿检验中一项重要的检测方式,TNF-α具有维持肺部病灶组织细胞基质运转的作用〔19〕。IL-1β在治疗肺气肿过程中,数值大小影响治疗效果成效,是治疗过程中不可或缺的重要指标〔20〕。IL-6是肺气肿的一道天然生物屏障,当其数目过多会使炎性细胞在气道外积聚,产生肺气肿症状。故而寻找能控制肺气肿的相关基因表达,且及时调控分管细胞的信号通路,具有重大意义。治疗肺气肿离不开此两项指标,其作为监测肺气肿的关键指标,在肺气肿的治疗上起到显著辅助作用,同时也提升了肺气肿的诊断性能。
有研究认为〔21〕,信号通路分布于各种细胞中,包含了线粒体基质、内外膜。信号通路在内膜中作用于电子传递链聚集部位,而外膜主要作用是分泌离子通道蛋白。信号通路主要通过氧化磷酸化、三羧酸循环产生能量,进而为细胞进行各种生命活动。TLR4、MyD88、NF-κB信号通路调控发生肺气肿最为特别,三者互相协调,从而达成修复气道内膜、肺部病灶组织黏膜的作用〔22〕。其将受损的细胞基质修复,形成自噬体,最终降解于溶酶体,TLR4、MyD88、NF-κB信号通路如果表达异常,会致线粒体出现障碍,从而更易发生肺气肿症状〔23〕。TLR4一般表达在病原菌表面,而MyD88一般表达在肺部病灶组织细胞基质表面,TLR4、MyD88、NF-κB信号通路表达升高能促进病原体感染情况下免疫逃逸,因而判定TLR4、MyD88、NF-κB信号通路能降低肺部病灶组织中细胞基质炎性效应功能,成为肺气肿病原菌的一种逃逸方式。NF-κB能降低细胞基质的活化功能,进而影响肺气肿的治疗进展。3种信号通路影响着肺气肿的进程,其指标异常易患肺气肿。本研究显示,TLR4、MyD88、NF-κB信号通路对肺气肿耐受机制提供了细胞基质极性作用判断,对肺气肿的治疗、联合治疗具有重要意义。但本研究存在一定的狭隘性,应多做大样本、多中心分析,预防、减少N-乙酰半胱氨酸治疗肺气肿出现的不良因素。
综上,治疗肺气肿使用N-乙酰半胱氨酸效果明显,优化病灶组织细胞基质表达,有效缓解临床症状,促进细胞基质免疫功能恢复,抗炎反应明显改善,安全性很高。

