夏枯草通过miR-663a调控ILK对BRAF阳性甲状腺乳头状癌细胞侵袭的影响
陈红跃 武红园 娄永庆 杨萌萌 栗粟
(1河南省中医院甲状腺乳腺科,河南 郑州 450000;2河南中医药大学第二临床医学院外科学)
甲状腺乳头状癌(PTC)是常见的甲状腺恶性肿瘤病理类型之一,其发生与多种基因相关,研究表明鼠类肉瘤滤过性毒菌致癌同源体B1(BRAF)在PTC中存在普遍的突变与过表达,且BRAF突变型的PTC侵袭性强,预后差〔1〕。因此抑制细胞侵袭是治疗BRAF阳性PTC的重中之重。研究表明中药活性成分有抑制PTC的作用,如姜黄素可抑制PTC的TPC-1细胞侵袭和迁移〔2〕。夏枯草(PV)是临床常用中药,具有抗感染、免疫抑制、抗氧化、抗肿瘤、抗病毒等多种药理作用〔3〕。研究报道PV能抑制人PTC细胞K1和人甲状腺髓样癌TT细胞增殖并诱导其凋亡〔4,5〕。PV还能抑制PTC的TPC-1细胞增殖〔6〕。且PV提取物可抑制食管癌Eca-109细胞体外侵袭和转移〔7〕。但PV对BRAF阳性PTC细胞侵袭的影响及其机制尚不清楚。研究表明PTC患者血清中miR-663低表达,与PTC细胞侵袭和转移密切相关〔8〕。miR-663上调通过靶向转化生长因子(TGF)β1抑制PTC细胞的侵袭和迁移〔9〕。整合素连接激酶(ILK)是整合素和生长因子等多种信号通路中的效应分子,在肿瘤细胞的血管生成、凋亡、转移和细胞周期过程中发挥重要作用〔10〕。ILK影响PTC细胞的信号传导途径和迁移,并且是潜在的治疗靶标〔11〕。本研究旨在探讨PV通过miR-663a调控ILK对BRAF阳性PTC细胞侵袭的影响。
1 材料与方法
1.1材料 正常甲状腺细胞HT-ori3和PTC细胞TPC-1购自上海泽叶生物科技有限公司;RPMI1640培养基、胎牛血清购自美国Sigma公司;PV颗粒(编号:B14000020441,国药准字:Z20050519,规格:2 g×8袋)产自江苏晨牌药业集团股份有限公司;细胞计数试剂盒(CCK)-8购自上海善然生物科技有限公司;Transwell小室、基质胶购自美国 Bio-Rad公司;二喹啉甲酸(BCA)试剂盒、放射免疫沉淀试验(RIPA)裂解液购自上海羽朵生物科技有限公司;基质金属蛋白酶(MMP)-9、血管内皮生长因子(VEGF)、ILK、β-actin抗体购自上海斯信生物科技有限公司;山羊抗兔IgG二抗购自北京百奥莱博科技有限公司;Trizol试剂、反转录试剂盒、荧光定量聚合酶链反应(PCR)试剂盒购自北京麦瑞博生物科技有限公司;双荧光素酶报告检测试剂盒购自武汉纯度生物科技有限公司;Thermo FC酶标仪购自美国Thermo公司;荧光显微镜购自日本Olympus公司。
1.2细胞药物处理与分组 正常甲状腺细胞HT-ori3和PTC细胞TPC-1在含有10%胎牛血清的RPMI1640培养液中培养,取对数生长期细胞TPC-1,分别用浓度0.5、1.0、2.0、4.0 mg/ml的PV培养,作为不同浓度PV组,其中2.0 mg/ml PV组记为PV组;不作任何处理的细胞作为对照(Control)组。将anti-miR-con、anti-miR-663a、ILK过表达质粒转染至TPC-1细胞中,再用2 mg/ml PV处理,记为PV+anti-miR-con组、PV+anti-miR-663a组、PV+ILK组。
1.3CCK-8检测细胞增殖活力 各组培养48 h后,每孔中加入10 μl CCK-8试剂,孵育2 h后,酶标仪检测各组细胞490 nm波长处的吸光度值(OD)。细胞增殖活力(%)=实验组OD值/空白对照组OD值×100%。实验重复3次。
1.4Transwell检测细胞侵袭 Transwell小室上室加入100 μl稀释的基质胶,十字摇匀,静置凝固;然后加入100 μl细胞悬液,其中下室加入500 μl含血清培养液,37℃培养24 h,0.1%结晶紫染色30 min,磷酸盐缓冲液(PBS)漂洗2遍,棉签擦拭掉上层未穿过基底膜的细胞,光学显微镜(×200)下随机选择5个视野,拍照记录并进行细胞计数。实验重复3次。
1.5Western印迹检测MMP-9、VEGF、ILK蛋白表达 提取细胞总蛋白,BCA试剂盒检测蛋白浓度。将蛋白样品进行聚丙烯酰胺凝胶电泳后转至聚偏氟乙烯膜上,封闭液室温封闭1 h,加入一抗(1∶1 000)4℃孵育过夜,加入二抗(1∶2 000)室温孵育2 h,电化学(ECL)发光液显影,ChemiDoc XRS+系统成像,Quantity One分析蛋白条带灰度值,蛋白相对表达水平=目的条带灰度值/β-actin条带灰度值。每个蛋白样品设3个重复。
1.6实时荧光定量PCR(RT-qPCR)检测miR-663a和ILK mRNA表达水平 各组细胞培养48 h,提取总RNA,将RNA反转录成cDNA,按照荧光定量试剂盒使用说明进行PCR,每个样品设3个重复,循环条件为95℃ 5 min,95℃ 30 s,60℃ 30 s;72℃ 30 s,共40个循环;60℃延长5 min。相对表达量用2-△△Ct法计算。miR-663a和ILK分别以U6和β-actin为内参,miR-663a上游引物:5′-AGCAGAGGCGGGGC-GCCGCGGG-3′,下游引物:5′-GTGCA GGGTCCGAGGT-3′;U6上游引物:5′-CTCGCTTCGGCAGCACA-3′,下游引物:5′-AACGCTTCACGAA TTTGCGT-3′;ILK上游引物:5′-GGCTCAGGAT TTTCTCGCA-3′,下游引物:5′-CTGCTGAGCGTCTGTTTGTG-3′;β-actin上游引物:5′-TGGATGATGATATCGCCGC-3′,下游引物:5′-GTAGATGGGCACAGTGTGGGT-3′;引物由上海生工生物工程公司合成。
1.7双荧光素酶报告实验验证miR-663a和ILK的靶向关系 使用PCR扩增包含miR-663a结合位点的ILK序列片段,并构建至荧光素酶表达载体中,获得ILK野生型载体,将ILK序列GCCCCGCC突变为CGGGGCGG,获得ILK突变型载体,将其分别与miR-con、miR-663a共转染至TPC-1细胞中,转染48 h后,按照双荧光素酶报告检测试剂盒说明检测荧光素酶活性。
1.8统计学方法 采用SPSS20.0软件进行t检验、方差分析。
2 结 果
2.1PV对BRAF阳性PTC细胞TPC-1增殖的影响 与Control组细胞活力〔(1.07±0.08)%〕比较,0.5、1.0、2.0、4.0 mg/ml PV组〔(0.91±0.07)%、(0.79±0.06)%、(0.56±0.04)%、(0.40±0.04)%〕均显著降低(P<0.05)。后续实验选择浓度2.0 mg/ml的PV。
2.2miR-663a和ILK在TPC-1细胞中的表达 与正常甲状腺细胞HT-ori3相比,TPC-1细胞中miR-663a表达水平显著降低,ILK mRNA和蛋白表达水平均显著升高(P<0.05)。见图1,表1。

图1 Western印迹检测ILK在TPC-1细胞中的表达

表1 miR-663a和ILK在TPC-1细胞中的表达
2.3miR-663a与ILK的靶向关系 StarBase数据库预测显示miR-663a与ILK存在结合位点,见图2。荧光素酶报告实验显示,与miR-con组相比,miR-663a组转染野生型表达载体WT-ILK的TPC-1细胞荧光素酶活性显著降低(P<0.05);而转染突变型表达载体MUT-ILK的TPC-1细胞荧光素酶活性无显著差异(P>0.05),见表2。
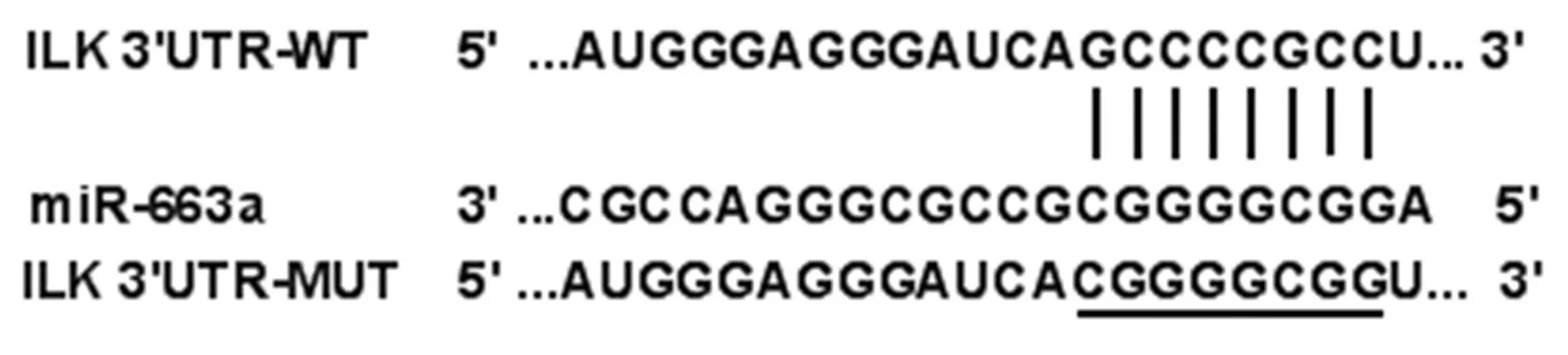
图2 miR-663a与ILK的结合位点

表2 双荧光素酶实验
2.4PV通过miR-663a抑制ILK的表达 与Control组相比,PV组miR-663a表达水平显著升高,ILK mRNA和蛋白表达水平显著降低(均P<0.05)。与PV+anti-miR-con组相比,PV+anti-miR-663a组miR-663a表达水平显著降低,ILK mRNA和蛋白表达水平显著升高(P<0.05)。见图3,表3。
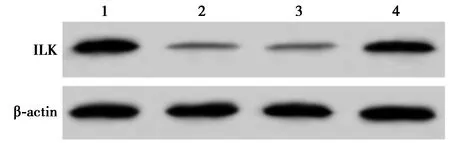
1~4:Control组,PV组,PV+anti-miR-con组,PV+anti-miR-663a组图3 Western印迹检测PV和miR-663a对TPC-1细胞ILK表达的影响

表3 PV和miR-663a对TPC-1细胞ILK表达的影响
2.5PV通过miR-663a调控ILK对TPC-1细胞增殖、侵袭的影响 与Control组相比,PV组细胞活力显著降低,侵袭细胞数、MMP-9、VEGF表达水平均显著降低(P<0.05);与PV组相比,PV+anti-miR-663a组和PV+ILK组细胞活力显著升高,侵袭细胞数、MMP-9、VEGF表达水平均显著升高(P<0.05)。见图4,图5,表4。
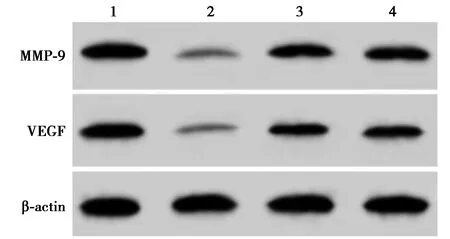
1~4:Control组、PV组、PV+anti-miR-663a组、PV+ILK组图4 PV通过miR-663a调控ILK对TPC-1细胞侵袭相关蛋白表达的影响

图5 PV通过miR-663a调控ILK对TPC-1细胞侵袭的影响(结晶紫,×200)

3 讨 论
PTC是最常见的甲状腺恶性肿瘤,大部分经手术治疗后预后较好,但仍有一部分PTC具有高侵袭性,难治愈〔12〕。研究报道PV对不同病理类型的人甲状腺癌细胞均有不同程度的抑制增殖作用〔13〕。PV可能通过激活线粒体通路诱导人PTC细胞凋亡〔14〕。PV能抑制人甲状腺癌细胞系SW579细胞生长,并诱导细胞凋亡而阻止细胞周期〔15〕。本研究结果说明PV可抑制TPC-1细胞增殖、侵袭。血管生成是肿瘤生长、侵袭、转移的基础,VEGF可调控血管生成,与肿瘤的增殖、侵袭和转移密切相关〔16〕。PTC组织中VEGF阳性表达率高,与TNM分期及有无淋巴结转移有关〔17〕。本研究结果表明PV抑制TPC-1细胞侵袭可能与VEGF有关。
研究表明miRNA参与PTC的多种生物学过程,与细胞侵袭性作用机制有关,还可作为临床诊断、复发监测及预后判断等标志物〔18〕。过表达miR-663a可显著抑制膀胱癌EJ和5637细胞的增殖、迁移和侵袭能力〔19〕。miR-663a通过调节TGFβ1抑制肝癌细胞的生长和侵袭〔20〕。本研究结果表明miR-663a低表达会促进TPC-1细胞增殖、侵袭;PV可能通过升高miR-663a的表达抑制TPC-1细胞侵袭。
研究显示miRNA通过与靶mRNA的3′UTR结合使靶基因降解或沉默,进而影响肿瘤的发生发展〔21〕。本研究结果说明PV可能通过miR-663a调控ILK的表达;ILK表达水平也会影响PV对TPC-1细胞侵袭的作用。且有研究报道VEGF和ILK均参与了胃癌细胞的生长、侵袭和转移过程,VEGF和ILK在胃癌中的表达存在正相关,ILK可能通过信号转导途径启动VEGF的表达,促进肿瘤早期的血管发生和形成〔22〕。提示ILK对TPC-1细胞侵袭的作用可能也与VEGF有关。
综上,PV可通过上调miR-663a进而下调ILK抑制BRAF阳性PTC细胞侵袭,且其可能与VEGF的表达有关。

