PCL-b-PNIPAM配位Eu(Ⅲ)构筑的超小尺寸稀土配合物荧光纳米探针用于肿瘤细胞双色成像
关晓琳 丁媛媛 来守军 杨学琴 韦镜玉张家铭 张丽媛 童金辉 雷自强
(1西北师范大学化学化工学院,生态功能高分子材料教育部重点实验室,甘肃省高分子材料重点实验室,兰州 730070)
(2兰州文理学院化工学院,兰州 730000)
0 引 言
荧光生物成像技术因其出色的时空分辨率、高灵敏度、多通道成像等优势,在生物成像和临床诊疗等领域前景巨大[1-3],其中具有高量子产率、超高光稳定性和优异的生物兼容性的各类荧光探针是荧光生物成像技术发展的关键。在众多的荧光探针中,稀土荧光配合物以其特殊的多孔腔和显著的发光特性被广泛应用于催化、传感器、生物成像和光学材料等领域[4-8]。稀土配合物的荧光来源于镧系离子的发光,可以起源于构型内4f-4f跃迁、构型间4fn→4fn5d1跃迁和电荷转移跃迁(ligand-to-metal charge transition 和 metal-to-ligand charge transfer)。这赋予了镧系元素独特的发光性能,适合于生物成像。稀土配合物的荧光有着与环境无关的元素特征发射、抗光漂白、荧光寿命长等优点,这有助于提高信噪比,使成像效果更好。在众多稀土配合物中,Eu(Ⅲ)配合物具有纯红荧光、寿命长、单色性好等优点。四川大学林云峰等以Eu/Ba共掺杂和F取代的透明质酸为模板制备的纳米粒子(HA@NFAP∶Eu/Ba),具有更高的掺杂效率、优异的单分散性和稳定性,并且HA@NFAP∶Eu/Ba在体内外均有肿瘤靶向性,且无明显毒副作用[9]。Sava Gallis等设计了一种基于稀土金属簇合物(Eu、Nd、Yb、Y、Tb)的新型材料,与细胞共培养后证明了其作为生物显像剂的可行性[10]。尽管已有文献报道了Eu配合物作为生物成像剂的优势,然而,仍有一些不足之处需要改善,例如热稳定性差、发光强度低、电子转移效率低等。
近年来,另一类基于聚合物的新型有机荧光纳米粒子——聚合物量子点(polymer dots,Pdots),渐渐引起研究者的关注。与传统的光学材料相比,Pdots具有荧光亮度高、光学稳定性好、纳米尺寸可调、生物毒性低等优点,在生物成像、传感检测、药物传递和治疗诊断等方面具有巨大的应用潜力[11-16]。然而,已报道的众多Pdots荧光探针[17-20]的组成中大部分含有大共轭结构,这将引发严重的聚集荧光猝灭现象(aggregation-caused quenching,ACQ),极大限制了高浓度或聚集态下半导体Pdots在生物方面的实际应用。为了解决这一问题,近几年,研究者通过共价键合的方式直接将具有聚集诱导发光(aggregation-induced emission,AIE)特性的荧光小分子键合于两亲性聚合物上,再自组装得到Pdots,通过该方法可以获得稳定的纳米粒子。目前,吉林大学的田文晶教授课题组和清华大学危岩教授课题组在利用共价键合方式制备AIE型非半导体Pdots方面均开展了多年研究工作,并取得了系列进展[21]。例如,田文晶教授课题组制备了一种基于AIE小分子9,10-二苯乙烯基蒽(DSA)的高荧光量子产率的Pdots,并将叶酸修饰在量子点的表面,成功实现了靶细胞成像[22]。危岩教授课题组则通过采用一种可控/活性自由基聚合方法(可逆加成-断裂链转移聚合,RAFT)制备了一种具有AIE性能的Pdots,该类荧光探针表现出优异的耐光漂白性能和生物相容性等优点,在细胞荧光成像等方面具有很大的潜力[23-24]。但是,目前荧光Pdots多为单发射短波长的荧光探针,在实际应用过程中容易受到复杂环境和激发波长等多种因素干扰。尤其是在生命科学应用中,短波长单发射荧光探针将对生物组织造成一定的光损伤,同时还会受到生物样品自发蓝色荧光的干扰,影响测试或成像效果,从而极大地限制了其在活体生物成像方面的应用[25]。相比之下,具有双荧光发射功能的Pdots则具有许多优势,例如强抗干扰能力、高分辨率、优异光学稳定性及测试重现性等,从而有效避免单荧光发射探针存在的缺陷,其中具有红光发射的Pdots更有利于深层组织的活体光学成像。因此,设计、合成具有红光发射的双荧光Pdots对生物荧光成像具有非常重要的应用价值。
因此,我们认为,将Pdots与发红光的Eu(Ⅲ)配合物相结合,不仅可以解决稀土离子本身发光强度较弱的缺点,同时可以提高传统Pdots的成像效果,使得基于Pdots的Eu(Ⅲ)稀土配合物荧光探针在临床成像方面具有很大的应用前景。但是,目前国内外有关通过共价键合方式制备含稀土元素的Pdots以及在生物成像方面的应用报道仍然很少[26-28]。
近几年,本课题组通过在AIE荧光小分子上原位引发聚合然后与稀土离子Eu(Ⅲ)发生配位最后自组装的方法,合成出多种具有双荧光发射的非半导体型Pdots。这些Pdots具有较低的细胞毒性,通过调节激发波长,对肿瘤细胞展现出了优异的蓝/红双色荧光成像能力和可逆双色荧光切换功能[27-28]。但是,由上述方法合成的Pdots具有粒径不可调,尺寸较大的缺陷。因此,在本研究中,我们采用开环和自由基聚合技术,先后将疏水性聚己内酯(PCL)和亲水性聚(N-异丙基丙烯酰胺)(PNIPAM)共价偶联于四苯乙烯(TPE)小分子上,再与Eu(Ⅲ)发生配位,分别制备出含有单臂、双臂和四臂的双亲性嵌段共聚物-Eu(Ⅲ)配合物1s-TPE-PCL-b-PNIPAM-Eu(Ⅲ)、2s-TPE-PCL-b-PNIPAM-Eu(Ⅲ)和4s-TPE-PCL-b-PNIPAM-Eu(Ⅲ)(简称为TPPE-1、TPPE-2和TPPE-4),最后自组装形成具有双荧光发射的小尺寸Pdots。系统研究Eu(Ⅲ)配位量与Pdots尺寸、双荧光性能、温敏性及细胞成像性能的关系,为设计、合成含Eu(Ⅲ)配合物的小尺寸Pdots材料提供有效制备方法,并为双色Eu配合物Pdots材料在可逆双色肿瘤细胞成像的生物应用方面提供理论支持。
1 实验部分
试剂及表征分析仪器信息详见Supporting information。此外,由于TPPE-1、TPPE-2、TPPE-4合成路线相似,为了避免重复,正文中仅给出TPPE-1的合成过程,TPPE-2和TPPE-4的合成过程详见Supporting information。
1.1 引发剂羟基四苯乙烯(TPE-OH)的合成
将 4-羟基二苯甲酮(19.8 g,0.1 mol)、二苯甲酮(18.2 g,0.1 mol)和Zn粉(13.0 g,0.2 mol)加入500 mL三颈烧瓶中,再加入300.0 mL无水四氢呋喃使固体溶解,在氮气保护和冰浴条件下,缓慢滴加四氯化钛(51.2 g,0.27 mol),搅拌30 min后缓慢升温至回流温度并过夜。加入150.0 mL 10%K2CO3水溶液猝灭反应,先过滤再用乙酸乙酯萃取,浓缩后通过柱层析分离提纯(洗脱剂:V石油醚∶V乙酸乙酯=10∶1)得目标产物。产率 43%。1H NMR(400 MHz,CDCl3):δ7.15~6.98(m,15H),6.87(d,2H),6.52(d,2H),4.61(s,1H)。13C NMR(100 MHz,CDCl3):δ153.96,144.28~143.62,140.29,136.37,132.71,131.52~131.16,127.63,126.24,114.57。
1.2 1s-TPE-PCL-OH的合成
将ε-己内酯(ε-CL,3.92 g,34.4 mmol)和TPE-OH(0.98 g,2.86 mmol)加入 100 mL 三颈烧瓶,再加入10.0 mL无水四氢呋喃,在氮气保护下,在130℃下搅拌至溶液混合均匀。加入辛酸亚锡(Sn(Oct)2,0.058 g,0.143 mmol)后反应24 h。反应结束后,用冰水猝灭反应并用冰甲醇沉淀。最终产物真空干燥,产率 97%。1H NMR(600 MHz,CDCl3):δ7.13~6.94(m,aromatic backbone),6.84(d,aromatic backbone),4.04(t,—CH2—CH2—OH),2.28(t,O=C—CH2—CH2—),1.62(d,—CH2—CH2—CH2—),1.36(t,—CH2—CH2—CH2—),1.23(s,—CH2—CH2—CH2—)。
1.3 大分子引发剂1s-TPE-PCL-AZO的合成
将1s-TPE-PCL-OH(0.002 mol)、偶氮二氰基戊酸(ACVA,0.002 mol)、4-二甲氨基吡啶(DMAP,0.006 mol)和100.0 mL无水四氢呋喃加入圆底烧瓶中,氮气保护下加入二环己基碳二亚胺(DCC,0.002 mol),然后升温至回流温度后过夜。反应结束后过滤浓缩,用乙醚沉淀离心。真空干燥得到白色粉末。1H NMR(600 MHz,DMSO-d6):δ7.14~7.16(s,aromatic backbone),7.05~6.80(q,aromatic backbone),3.95(t,O=C—CH2—CH2—),2.24(t,O=C—CH2—CH2—),1.51(d,—CH2—CH—C—),1.27(p,—CH2—CH2—CH2—)。
1.4 单臂共聚物1s-TPE-PCL-b-PNIPAM(TPP-1)的合成
将1s-TPE-PCL-AZO(0.1 mmol)和N-异丙基丙烯酰胺(NIPAM,10 mmol)加入100 mL三颈烧瓶中,再加入60.0 mL的无水四氢呋喃,氮气气氛下升温至回流温度反应过夜。反应结束后,在正己烷中沉淀并离心,真空干燥后得目标产物。1H NMR(600 MHz,D2O):δ7.89(s,—NH—C=O),7.61(d,aromatic backbone),4.64(s,O=C-CH2—CH2—),3.91~3.81(q,NH—CH—CH3),3.81~3.74(d,O=C—CH—CH2—),1.99(t,O=C—CH2—CH2—),1.58(t,—C—CH2—CH—),1.32(t,—C—CH3),1.02(q,—CH—CH3)。
1.5 TPPE-1的制备
将40.0 mL浓盐酸逐滴加入Eu2O3(7.02 g,0.002 mol)中,再加入氯化铵粉末后煮沸,真空干燥得EuCl3。用40.0 mL无水乙醇溶解TPP-1(50 mg),再加入EuCl3(100 mg),常温充分搅拌过夜,用正己烷沉淀并离心后得到目标产物。
1.6 单、双、四臂Pdots的制备
通过纳米沉淀法来制备单、双、四臂Pdots。用无水四氢呋喃溶解TPPE-1、TPPE-2和TPPE-4,制备浓度为2 mg·mL-1的溶液作为原液。将原液稀释至100 μg·mL-1,在超声作用下取10.0 mL注入到装有20.0 mL超纯水的50.0 mL比色管中。继续超声5 min,随后将比色管常温搅拌24 h,去除有机溶剂后用过滤头过滤得到单、双、四臂Pdots。所得Pdots非常稳定,在常温下保存数月后仍保持澄清透明,并且没有聚集现象发生。
1.7 细胞毒性检测
分别以人宫颈癌细胞系HeLa、人肝癌细胞HepG2、人肺癌细胞系A549为细胞模型,采用四甲基偶氮唑盐比色法(MTT法)检测TPPE-1 Pdots、TPPE-2 Pdots、TPPE-4 Pdots的细胞毒性。将HeLa、HepG2、A549细胞接种在96孔板内,每孔200.0 μL,而96孔板的边缘部分吸取磷酸缓冲盐溶液(PBS)进行填充,随后摇晃孔板并置入37℃、CO2体积分数5%的培养箱中孵育24 h。孵育结束后弃去原始培养基,将实验分成6组,其中第1个对照组每孔加入180.0 μL的含氨基酸和葡萄糖的培养基(dulbecco′s modified eagle medium,DMEM),剩余的实验组分别加入3种Pdots(40、80、120、160、200 μg·mL-1)及每孔180.0 μL的培养基后进行MTT实验。加样结束后摇晃孔板并置于37℃、5%CO2培养箱中再孵育24 h。随后每孔再加入20.0 μL MTT溶液(5 mg·mL-1),放入培养箱中继续孵育4 h后将液体吸出,并向每孔中加入150.0 μL二甲基亚砜使反应终止,摇晃孔板至结晶物质溶解即可。用酶标仪在490 nm处测定每孔的光密度(OD)值,进行3次平行实验。用以下公式计算细胞存活率(RCS):RCS=ODr/ODc×100%(ODr为实验孔测定的吸光度,ODc为对照组测定的吸光度)。
1.8 细胞成像实验
选取生长较好的HeLa、HepG2、A549细胞进行消化离心后,用显微镜在计数板上计数,随后接种于12孔板,并加入含有12%胎牛血清(FBS)的DMEM培养液,摇晃后放入37℃、5%CO2培养箱中孵育24 h后向每孔打入200 μg·mL-1的3种Pdots,再孵育24 h。最后用PBS洗涤取出的细胞爬片并进行最后的成像观察实验。细胞的观察和细胞的拍摄均在蔡司Axio Scope.A1正置荧光显微镜下完成。
2 结果与讨论
2.1 双荧光发射的两亲性嵌段共聚物和Pdots的设计与合成
两亲性嵌段共聚物易于在溶液中通过自组装形成具有形貌和尺寸可控的纳米结构,因此常被用作功能化的自组装材料。本研究依次采用开环聚合(ROP)和自由基聚合方法,分别在AIE荧光分子TPE的不同苯环位置上共价键合嵌段共聚物PCL-b-PNIPAM,分别得到含有单臂、双臂和四臂结构的两亲性聚合物。接着,通过Eu(Ⅲ)与侧链富含N、O原子的亲水片段PNIPAM发生配位,合成具有红光发射的两亲性稀土配合物。最后通过在水溶液中自组装构筑出蓝-红双荧光发射的小尺寸Pdots。3种两亲性共聚物的合成路线及Pdots组装示意图如图1所示。

图1 TPPE-1、TPPE-2和TPPE-4 Pdots的制备、自组装过程及细胞作用示意图Fig.1 Preparation,self-assembly and acting on cells of TPPE-1,TPPE-2,and TPPE-4 Pdots
首先参考文献[29],分别合成单、双和四羟基四苯乙烯(TPE-OH、TPE-2OH、TPE-4OH),然后以其作为引发剂,引发单体ε-CL开环聚合,合成以TPE为中心的单、双和四臂的疏水性聚合物1s-TPE-PCL-OH、2s-TPE-PCL-OH和4s-TPE-PCL-OH。然后利用聚合物末端羟基(—OH)与ACVA上的羧酸(—COOH)发生DCC酯化反应,合成3种大分子偶氮引发剂1s-TPE-PCL-AZO、2s-TPE-PCL-AZO和4s-TPE-PCLAZO,随后原位引发具有温敏性质的乙烯基单体NIPAM聚合,制得单臂、双臂和四臂型两亲性嵌段共聚物:TPP-1、TPP-2和TPP-4。上述所得中间体和聚合物均通过1H NMR(图 S1~S12)、13C NMR(图S13~S15)、IR(图S16~S21)和GPC(表 S1)等进行表征,确定了结构与分子量。最后,通过稀土元素Eu和嵌段共聚物侧链片段PNIPAM发生配位,合成嵌段共聚物-Eu(Ⅲ)配合物:TPPE-1、TPPE-2和TPPE-4,并通过自组装形成了小尺寸Pdots。通过IR、光电子能谱(XPS)、透射电子显微镜(TEM,100 kV)、扫描电镜-X射线能谱分析(SEM-EDX,5 kV)等测试确定共聚物-Eu(Ⅲ)配合物及Pdots的结构与微观形貌。
2.2 单、双、四臂两亲性嵌段共聚物-Eu(Ⅲ)配合物的结构表征
图S22为两亲性嵌段共聚物配位前后的IR谱图。由图可知,聚合物TPP-1、TPP-2和TPP-4中仲酰胺的N—H特征吸收峰分别位于3 439、3 437和3 498 cm-1处,而在与Eu(Ⅲ)发生配位后,该特征吸收峰分别位移至3 349、3 265和3 350 cm-1,均发生明显红移,且峰形变宽。此外,与Eu(Ⅲ)发生配位后,TPP-1、TPP-2、TPP-4聚合物中分别位于1 649、1 654和1 652 cm-1的酰胺Ⅰ带νC=O(主要是酰胺C=O伸缩振动)的特征吸收峰,均红移至TPPE-1、TPPE-2和TPPE-4中的1 622、1 618和1 629 cm-1,分别红移了27、36和 23 cm-1。同时,位于1 543、1 544和1 549 cm-1的酰胺Ⅱ带的特征吸收峰也分别移至1 562、1 551和1 544 cm-1。上述酰胺键特征吸收峰的峰形变化和红移结果表明,Eu3+与TPE-PCL-b-PNIPAM侧链的氮原子和羰基氧发生配位,吸电子诱导效应分别使C=O和N—H键间电子云密度下降,键力常数变小,致使振动频率降低,导致νC=O、νN—H和δN—H发生红移[30-31]。
XPS能够提供分子结构精确的结合能和共价电子结构信息[32],利用XPS测试共聚物TPP-1、TPP-2和TPP-4与Eu(Ⅲ)配位前后配位元素氧、氮的键合能的变化,可以进一步确定配合物的电子结构和成键特性。图S23分别为TPP-1、TPP-2、TPP-4共聚物与相应的共聚物-Eu(Ⅲ)配合物TPPE-1、TPPE-2、TPPE-4的XPS谱图以及能谱中相应元素的结合能变化谱图。由图S23可以观察到,配位前后共聚物和共聚物-Eu(Ⅲ)配合物上C元素对应的结合能没有发生明显变化,但是N、O两种元素的结合能发生了改变,从而证明Eu(Ⅲ)可能和共聚物的亲水片段 PNIPAM侧链上的N、O发生配位作用。为了更加清楚地比较共聚物与相应的共聚物-Eu(Ⅲ)配合物中各原子结合能的变化情况,我们将C、N、O和Eu(Ⅲ)结合能数据列于表1中。在单、双、四臂配合物中上述结合能与对应的未配位聚合物相比,C—N键上的N1s结合能分别增大了0.6、0.6、0.9 eV;同时,C=O键上的O1s的结合能分别增大了0.7、0.3、1.1 eV,而C元素结合能没有任何变化。这主要是因为核外电子分布变化会影响内层电子的屏蔽作用,配合物中羰基氧和酰胺氮的电子转移到Eu(Ⅲ)的外层空轨道上,使其外层电子密度减小,屏蔽作用减弱,内层电子的结合能增加,从而证明了O→Eu3+及N→Eu3+配位键的形成[33-34]。此外,在单、双、四臂配合物的XPS能谱中出现了Eu3d(1 133.3、1 133.5和1 140.0 eV)和Eu4d(136.7、136.8和140.3 eV)的电子结合能,进一步说明Eu配合物的生成。

表1 聚合物TPP-1、TPP-2、TPP-4与配合物TPPE-1、TPPE-2、TPPE-4 中 C1s、O1s、N1s、Eu3d 和Eu4d的键能Table 1 Binding energies of C1s,O1s,N1s,Eu3d,and Eu4d for polymers TPP-1,TPP-2,TPP-4,and complexes TPPE-1,TPPE-2,TPPE-4
此外,SEM-EDX是纳米材料微区分析的重要手段之一,它可以对材料表面微区成分进行定性、定量分析,其中的EDX元素成像分析技术(EDX-mapping)还可以进行关键元素的分布分析。为此,采用SEM-EDX技术对共聚物-Eu(Ⅲ)配合物进行了微区元素分析,结果如图2所示。其中,图2a1~2c1分别为TPPE-1、TPPE-2、TPPE-4的SEM-EDX谱图,由图可知在3种配合物中含有C、O、N和Eu,其中C、O、N为配合物的主要成分,Eu(Ⅲ)的含量相对较低。采用能谱自带的软件对单、双、四臂配合物的Eu元素质量分数进行计算,质量百分含量约为2.4%、7.2%和11.7%。此外,从配合物中各元素的EDX-mapping图(图2a2~2c2)可以观察到在3种配合物中分布着C、O、N和Eu四种元素,尤其是Eu分布均匀,表明Eu(Ⅲ)均已成功配位于3种共聚物上。

图2 (a1)TPPE-1、(b1)TPPE-2、(c1)TPPE-4的SEM-EDX谱图;(a2)TPPE-1、(b2)TPPE-2、(c2)TPPE-4中C、O、N和Eu的EDX-mapping图Fig.2 SEM-EDX spectra of(a1)TPPE-1,(b1)TPPE-2,and(c1)TPPE-4;EDX-mappings of C,O,N,and Eu of(a2)TPPE-1,(b2)TPPE-2,and(c2)TPPE-4
2.3 单、双、四臂Pdots自组装与微观形貌
本工作所制备的TPPE-1、TPPE-2和TPPE-4均包含典型的两亲性嵌段共聚物,其中疏水部分由TPE和PCL组成,亲水部分由PNIPAM组成,三者均易于在合适的溶液中自组装形成有序纳米结构。在此,我们选择四氢呋喃为溶剂,超纯水为分散介质,采用纳米沉淀法制备TPE-PCL-b-PNIPAM-Eu自组装体,得到外观均一稳定的TPPE-1 Pdots、TPPE-2 Pdots、TPPE-4 Pdots,这些Pdots是以疏水的TPE和PCL为核、亲水的PNIPAM为外壳的纳米小球。
图 3 为 TPPE-1 Pdots、TPPE-2 Pdots、TPPE-4 Pdots的TEM图、粒径分布图和水合粒径动态光散射(DLS)分布图。从图3a2~3c2的插图可以观察到3种Pdots的水溶液(0.05 mg·mL-1)均具有良好透明性和明显丁铎尔效应,表明TPPE-1、TPPE-2和TPPE-4在水溶液中能自组装形成纳米粒子。由图3a1~3c1可以观察到 TPPE-1 Pdots、TPPE-2 Pdots、TPPE-4 Pdots均为规则小球状,具有较好的分散性,平均粒径分别为4.8、4.3和2.7 nm。这主要是由于在水溶液中两亲性聚合物链发生折叠和塌陷,使聚合物链疏水部分收缩包覆于Pdots内部,聚合物链亲水部分暴露于Pdots的外部,从而自组装成小球,使得Pdots均匀分散于水相中。同时,由图3a3~3c3得到Pdots的水合平均粒径分别为8.7、9.3和5.8 nm,均大于由TEM测试所得的平均粒径。这主要是因为TEM测得的是干燥的纳米粒子的粒径,而DLS测试的是粒子在水溶液状态下的粒径,由于其在水溶液中发生一定的溶胀现象,导致水合粒径大于干燥粒子粒径。

图3 (a1)TPPE-1 Pdots、(b1)TPPE-2 Pdots、(c1)TPPE-4 Pdots的TEM图;(a2)TPPE-1 Pdots、(b2)TPPE-2 Pdots、(c2)TPPE-4 Pdots的粒径分布柱状图;(a3)TPPE-1 Pdots、(b3)TPPE-2 Pdots、(c3)TPPE-4 Pdots的水合粒径DLS分布图Fig.3 TEM images of(a1)TPPE-1 Pdots,(b1)TPPE-2 Pdots,and(c1)TPPE-4 Pdots;Particle size distribution histograms of(a2)TPPE-1 Pdots,(b2)TPPE-2 Pdots,and(c2)TPPE-4 Pdots;Hydrated particle size DLS distribution histograms of(a3)TPPE-1 Pdots,(b3)TPPE-2 Pdots,and(c3)TPPE-4 Pdots
值得注意的是,相比于TPPE-1 Pdots较好的形貌规整度和分散性,TPPE-2 Pdots和TPPE-4 Pdots的粒径规整度和分散性随着臂数的增加依次下降,粒径也不断降低。这可能是随着聚合物臂数的增加,共聚物中亲水链段PNIPAM的含量以及侧链上N、O原子的密度依次升高,致使共聚物与Eu(Ⅲ)配位能力增强,这与SEM-EDX测试得到的单、双、四臂配合物中Eu元素质量百分含量依次增加的实验结果相一致。当Eu(Ⅲ)离子在PNIPAM链内或链间与N、O原子发生配位时,将会不同程度地引起聚合物链的收缩。因此,随着单、双、四臂配合物中Eu(Ⅲ)离子含量的逐渐增加,聚合物分子链收缩卷曲程度愈严重,最终导致Pdots粒径规整度、分散性和粒径随聚合物臂数的增加依次降低。
此外,Pdots的尺寸稳定性对生物成像应用至关重要。为了考察形貌和尺寸的稳定性,我们对放置了30 d的TPPE-1 Pdots、TPPE-2 Pdots、TPPE-4 Pdots微观形貌进行测试。从TEM照片可以观察到被放置30 d的TPPE-1 Pdots、TPPE-2 Pdots、TPPE-4 Pdots仍呈小球状分散,平均粒径为5 nm,表明我们所制备的Pdots具有较好的尺寸稳定性(图S24)。
2.4 单、双、四臂Pdots的双荧光发射
图4a为四臂共聚物配位前后的UV-Vis吸收光谱图(单、双臂共聚物配位前后的UV-Vis吸收光谱图见图S25a和S25b)。由图可知,配位前聚合物在小于500 nm的紫外可见光区有吸收,且随着波长的增加吸光度不断下降。而与Eu(Ⅲ)发生配位后,配合物在395 nm处出现了一个强的紫外吸收峰,显然是由PNIPAM与Eu(Ⅲ)形成的配合物产生的[28],这也进一步证明Eu(Ⅲ)与两亲性共聚物TPE-PCL-b-PNIPAM发生有效配位。
另一方面,由于 TPPE-1 Pdots、TPPE-2 Pdots、TPPE-4 Pdots中包含TPE生色团(发射蓝光)和稀土Eu(Ⅲ)发光配合物(发射红光)2种发光单元,如果这2个发光单元发射波长和激发波长差距较大且不发生重叠时,则不会产生荧光共振能量转移(FRET)现象,那么3种Pdots可能会有双荧光发射性能。图4b为20 mg·mL-1的TPPE-4 Pdots水溶液在360~400 nm范围内不同激发波长下的荧光光谱(TPPE-1 Pdots、TPPE-2 Pdots水溶液的荧光光谱见图S25a1和S25b1)。由图可知,TPPE-4 Pdots能同时发射位于430 nm的蓝光和位于615 nm的红光,证明其具有双色荧光发射性能。其中,由Eu(Ⅲ)配合物发射的红色荧光峰是由位于594 nm的弱峰和位于615 nm的强峰所组成,两者分别对应于Eu3+磁偶极跃迁(5D0→7F1)和电偶极跃迁(5D0→7F2),尤其是在615 nm处非常强的锐线发射是Eu3+的超灵敏跃迁,具有较好的单色性[33,35]。同时,由图4c可以清楚地观测到TPPE-4 Pdots红、蓝荧光强度比I615/I430(I615和I430分别是红色发射和蓝色发射的荧光强度)随着激发波长的红移而增大(TPPE-1 Pdots、TPPE-2 Pdots的红、蓝荧光强度比见图S25a2和S25b2)。其中,激发波长在360~380 nm范围内I615/I430<1,且在360 nm的激发下,I615/I430最小,此时Pdots以发蓝光(由TPE发色团产生[27])为主;而当激发波长为390~400 nm时I615/I430>1,并且在395 nm的激发下,I615/I430最大,此时Pdots以发红光(由Eu配合物产生[27])为主。因此,TPPE-4 Pdots的蓝色和红色荧光的最佳激发波长为360和395 nm。
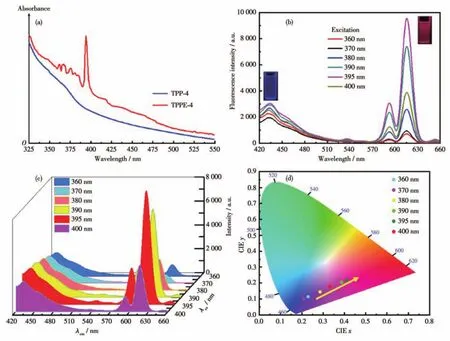
图4 (a)TPPE-4 Pdots水溶液的UV-Vis吸收光谱;(b)不同激发波长下TPPE-4 Pdots的荧光光谱(mTPP-4∶mEu=1∶1);(c)TPPE-4 Pdots溶液在不同激发下的双发射三维荧光光谱;(d)TPPE-4 Pdots在不同激发下的CIE色度图Fig.4 (a)UV-Vis absorption spectra of TPPE-4 Pdots in aqueous solution;(b)Fluorescence spectra of TPPE-4 Pdots under different excitation wavelengths(mTPP-4∶mEu=1∶1);(c)Dual-emission 3D fluorescence spectra of TPPE-4 Pdots under different excitations;(d)CIE chromaticity diagram of TPPE-4 Pdots under different excitations
同时,考虑到Pdots中Eu(Ⅲ)的含量会对Pdots水溶液荧光的I615/I430产生影响,我们又考察了制备配合物时不同物料比(共聚物与EuCl3的质量比)与Pdots水溶液荧光光谱中I615/I430的变化关系。如图S26可知,在不同的激发波长下,3种Pdots水溶液荧光光谱中I615/I430均随着EuCl3与共聚物的质量比增大而升高,这是体系中Eu配合物含量增大使红色荧光增强引起的。很明显,当EuCl3与共聚物的物料比为1∶1时,可实现Pdots水溶液在360 nm激发下I615/I430很小的同时在395 nm激发下I615/I430很大,这样更有利于获得在2个不同激发波长下的最佳双色荧光发射效果。图4d为EuCl3与TPP-4的物料比为1∶1时所得Pdots水溶液荧光相应的CIE色度图(TPPE-1 Pdots、TPPE-2 Pdots水溶液的CIE色度图见图S25a3~S25b3)。由图可知,随着激发波长在360~400 nm范围内红移,标注在标准色板上的复合光由蓝色渐变为红色,且荧光位点较好地处于一条直线上,表明可逆地调控发光颜色是可以通过调节3种Pdots的激发波长来实现的。
因此,光学测试结果表明,TPPE-1 Pdots、TPPE-2 Pdots、TPPE-4 Pdots在360 nm的激发下主要以430 nm处蓝光发射为主,而在395 nm激发时则主要以615 nm处红光发射为主,且蓝、红光发射波长间距高达195 nm,相互干扰较小,表现出优异的双荧光性质。更重要的是我们可以仅仅通过调节激发波长轻松实现Pdots发光颜色的可逆调控,使其在多通道生物成像领域具有较大的应用空间。此外,与TPPE-1 Pdots、TPPE-2 Pdots相比,TPPE-4 Pdots水溶液复合荧光颜色变化区间更宽,具有更好的双荧光效果,这有利于提高细胞成像的分辨率。
2.5 单、双、四臂Pdots的温敏性
PNIPAM是一种典型的温度响应型聚合物,在生物医学领域中被广泛应用。由于其分子链上同时具有亲水性的酰胺基和疏水性的异丙基,当温度升高至32℃以上时,PNIPAM的疏水性以及氢键的剧变会使其构象由亲水的膨胀态急剧转变为疏水的收缩态,此时水溶液会产生急剧的相变,该温度被称为PNIPAM的最低临界溶解温度(lower critical solution temperature,LCST)[36-38]。因此,含有PNIPAM结构的TPPE-1 Pdots、TPPE-2 Pdots、TPPE-4 Pdots也应该具有相似的温度敏感特性。为了考察3种Pdots的温敏性,我们首先测试在10~60℃区间内升温过程中Pdots水溶液的透光率变化情况。图5a为TPPE-4 Pdots水溶液的透光率随温度变化曲线(TPPE-1 Pdots、TPPE-2 Pdots水溶液的透光率随温度变化曲线见图S27a1和S27b1)。可以看出,在10~30℃区间内,TPPE-4 Pdots水溶液为澄清透明溶液,透光率接近100%。但随着温度的进一步升高,透明溶液渐渐变浑浊,透光率开始下降。温度超过40℃,变成白色乳状悬浮液。当升温到60℃后又慢慢冷却到20℃时,白色乳状悬浮液变成未升温前的澄清透明溶液状态。
然而,测试结果表明3种Pdots溶液的LCST并不相同,TPPE-1 Pdots、TPPE-2 Pdots、TPPE-4 Pdots的LCST分别约为32、36和37℃。很明显,3种Pdots的LCST随着键合于TPE分子上聚合物臂数的增加而升高。我们认为这可能是由于体系中Eu3+含量的变化导致的。对于PNIPAM含量较低的TPPE-1 Pdots,Eu3+的掺杂量相对较少,因而对PNIPAM的热敏性影响很小,使其LCST接近于PNIPAM的LCST。但是TPPE-2和TPPE-4 Pdots中PNIPAM含量增大,引起Eu3+含量的升高,从而对PNIPAM的热敏性产生较大的影响,致使两者的LCST分别升高了4和5℃。这可能是由于稀土离子Eu3+的配位能力较强,在水溶液中Eu3+不仅能与PNIPAM侧链酰胺上的O和N原子发生配位,同时也与水分子上的O发生一定配位作用。而配位键键能比氢键键能大,因此当体系温度升高至LCST附近时,就需要更多的能量才能破坏水分子与Eu3+之间的配位作用力,导致双臂和四臂Pdots在更高的温度才会发生相转变,使LCST升高。与此同时,我们又考察了3种Pdots的相变可逆性。图5b分别为在4次升-降温循环过程中TPPE-4 Pdots水溶液分别处于20和40℃时的透光率变化图(TPPE-1 Pdots、TPPE-2 Pdots水溶液的透光率变化图见图S27a2和S27b2)。由图可知,在温度(20℃)低于LCST时,Pdots可完全溶于水;温度(40℃)高于LCST时,Pdots从水中析出,呈乳液状;再次降温至20℃时,Pdots溶液又恢复到澄清透明状态,且在多次循环中表现出可逆的相转变能力。值得注意的是,TPPE-4 Pdots的LCST更接近人体的正常体温,且具有良好的可逆性,因此是一种优异的温敏型纳米材料。
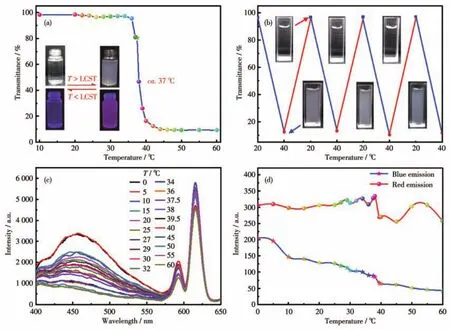
图5 (a)不同温度下TPPE-4 Pdots水溶液的透射率;(b)TPPE-4 Pdots水溶液在不同温度下的可逆相变图;(c)TPPE-4 Pdots水溶液(10 mg·mL-1)在不同温度下的荧光光谱(λex=360 nm);(d)不同温度下TPPE-4 Pdots水溶液的蓝、红发射光的荧光强度Fig.5 (a)Transmittance of TPPE-4 Pdots aqueous solution at different temperatures;(b)Reversible phase transition diagram of TPPE-4 Pdots aqueous solution at different temperatures;(c)Fluorescent spectra of TPPE-4 Pdots aqueous solution(10 mg·mL-1)at different temperatures(λex=360 nm);(d)Fluorescence intensities of blue and red emission from aqueous solutions of TPPE-4 Pdots at different temperatures
此外,为了考察Pdots双荧光随温度变化情况,我们对TPPE-4 Pdots水溶液进行了变温荧光光谱的测试,结果如图5c和5d所示(TPPE-1 Pdots、TPPE-2 Pdots水溶液的变温荧光光谱图见图S27a3、S27a4、S27b3、S27b4)。由双荧光强度随温度的变化趋势图可以观察到,随着温度的升高,TPPE-1 Pdots、TPPE-2 Pdots、TPPE-4 Pdots蓝色荧光强度逐渐降低,而红色荧光强度则略有升高,但变化相对较弱,这可能是由于从Eu3+的发射5D0能级到非辐射三重态的热活化[39-40]。通过仔细观察蓝色荧光在LCST附近的变化,我们还发现当TPPE-1 Pdots、TPPE-2 Pdots水溶液温度低于LCST时,其蓝色荧光强度会随着温度的上升而呈规律性下降趋势,但当环境温度超过其各自的LCST(32或36℃)后,其蓝光强度突然增强,然后又继续随着温度的升高而下降。引起这一反常现象的原因可能是温度的升高将会加速有机荧光小分子TPE的分子内旋转,增强非辐射跃迁程度,进而使蓝色荧光发射强度降低。而当体系温度高于LCST时,Pdots上PNIPAM链的构象由亲水的膨胀态急剧转变为疏水的收缩态,导致链上TPE聚集程度增强,引起AIE效应,从而使Pdots的蓝光增强。但随着继续升温,高温下TPE的分子内旋转导致荧光下降的程度高于AIE效应致使荧光上升的程度,导致蓝色荧光的强度再次下降。相比于TPPE-1 Pdots、TPPE-2 Pdots基于AIE展现出的明显变化,TPPE-4 Pdots在LCST附近并没有发生蓝光增强,仅仅表现出荧光强度下降趋势变缓。我们认为这可能是由于TPE在TPPE-4中相对含量较低,AIE响应较弱。由此可见,具有温敏性的PNIPAM链使Pdots水溶液荧光也具有了优异的温度响应性,由此可以说明我们合成的3种Pdots不仅具有TPE的AIE特性,同时还拥有PNIPAM的温敏特性,这为设计新型的具有功能性的AIE型高分子材料拓展了一种新的设计思路。
2.6 三种Pdots的细胞毒性及双色细胞成像
具有双荧光发射功能的TPPE-1 Pdots、TPPE-2 Pdots、TPPE-4 Pdots的细胞毒性是决定其能否成功应用于细胞成像的前提条件。我们首先选取3种不同类型的肿瘤癌细胞(人宫颈癌细胞HeLa、人肺癌细胞A549、人肝癌细胞HepG2)作为测试Pdots细胞毒性的样本,采用MTT法对TPPE-1 Pdots、TPPE-2 Pdots、TPPE-4 Pdots的细胞毒性进行了测试,结果如图6a1~6c1所示。当分别将HeLa、A549和HepG2肿瘤细胞置于50~400 μg·mL-1的Pdots水溶液中培养48 h后,对所有培养浓度来说,3种肿瘤细胞活性均在90%以上,这表明TPPE-1 Pdots、TPPE-2 Pdots、TPPE-4 Pdots对肿瘤细胞具有较低的细胞毒性,可以进一步应用于细胞成像实验。
在进行细胞成像实验时,先在生理环境下将HeLa、A549 和 HepG2 置于 100 μg·mL-1的 TPPE-1 Pdots、TPPE-2 Pdots、TPPE-4 Pdots水溶液中培养24 h,然后使用荧光显微镜拍摄不同激发光源照射下的细胞荧光显微照片,如图6a2~6c2所示。通过荧光显微照片,我们可以清楚地观察到:经由TPPE-1 Pdots、TPPE-2 Pdots、TPPE-4 Pdots染色后的 HeLa、A549和HepG2细胞在蓝色通道的激发光照射下,均可在细胞内接收到强烈的蓝色荧光信号;而当在红色通道的激发光照射下,3种细胞则呈现出强烈的红色荧光,即通过采用不同的激发波长,被Pdots染色的肿瘤细胞具有实现蓝/红双色荧光成像的能力,且这种双色成像同时具有很好的可逆性。同时,细胞成像测试结果证明:3种Pdots均可通过细胞内吞作用穿透细胞膜,从而进入HeLa、A549和HepG2细胞中进行染色,并呈现出几乎完整的细胞形态。此外,通过对图6a2~6c2的仔细观察,可以发现TPPE-4 Pdots在HepG2、A549和HeLa三种细胞内的成像效果均优于TPPE-1 Pdots、TPPE-2 Pdots。其中,TPPE-4 Pdots可对HepG2和A549细胞的细胞质进行染色,且在细胞质区域内荧光强度较强,呈现的细胞形态几乎完整,尤其对HepG2细胞具有较高的成像分辨率。这可能是由于TPPE-4 Pdots具有最小的粒径和最优的双荧光效果,更容易被细胞吞噬并表现出最佳的双色成像效果。因此,TPPE-4 Pdots是一种优良的细胞成像荧光纳米材料。除此之外,在测试中对染色后的3种细胞进行长时间照射后,细胞内所发射的蓝/红双色荧光强度几乎不变,表明所制备的Pdots具有很好的抗光漂白性。

图6 Hela、A549和HepG2细胞的双色共定位图像:用不同浓度(a1)TPPE-1 Pdots、(b1)TPPE-2 Pdots、(c1)TPPE-4 Pdots处理48 h后Hela、A549和HepG2细胞的毒性测试;用(a2)TPPE-1 Pdots、(b2)TPPE-2 Pdots、(c2)TPPE-4 Pdots(100 μg·mL-1)处理24 h的Hela、A549和HepG2细胞的蓝/红双通道荧光显微镜图像Fig.6 Dual-color co-localization images of Hela,A549,and HepG2 cells:cytotoxic tests for the cells treated with different concentrations of(a1)TPPE-1 Pdots,(b1)TPPE-2 Pdots,and(c1)TPPE-4 Pdots for 48 h,respectively;Blue/red dual-channel fluorescence microscope images of the cells treated with(a2)TPPE-1 Pdots,(b2)TPPE-2 Pdots,and(c2)TPPE-4 Pdots for 24 h,respectively
目前,市场开发和文献报道的细胞荧光染料多为单色显影剂,相比之下,本工作所制备的3种小尺寸Pdots纳米荧光粒子因具有智能的可逆双色荧光切换功能,使其具有高时空分辨率和高抗干扰性等优势。因而,TPPE-1 Pdots、TPPE-2 Pdots、TPPE-4 Pdots三种纳米荧光探针在生物荧光成像领域均显示出重要的应用价值。
3 结论
首先通过原位引发聚合方法分别合成单、双、四臂型两亲性嵌段共聚物:TPP-1、TPP-2和TPP-4。然后利用稀土元素Eu与嵌段共聚物侧链富含N、O原子的亲水片段PNIPAM发生配位,分别合成嵌段共聚物-Eu(Ⅲ)配合物:TPPE-1、TPPE-2和 TPPE-4。最后,通过配合物在水中自组装成功制备非半导体型Pdots。3种Pdots均具有优异的水溶性和低于5 nm的超小粒径。光学测试结果表明:单、双、四臂Pdots在360 nm的激发下主要以430 nm处蓝光发射为主,而在395 nm时则主要以615 nm处红光发射为主,蓝、红光发射波长间距高达195 nm,相互干扰较小,表现出优异的双荧光性质。此外,由于Pdots中PNIPAM链的构象随温度升高由膨胀态转变为收缩态,导致链上TPE聚集程度增强,从而赋予Pdots水溶液荧光的温度响应性。同时,细胞毒性及细胞成像研究表明,3种Pdots均具有低细胞毒性,并可通过细胞内吞作用分别进入HeLa、A549和HepG2肿瘤细胞中进行染色,在不同的激发波长下,可在细胞内接收到强烈的蓝色或红色荧光信号,呈现出几乎完整的细胞形态,展现出优异的蓝/红双色荧光成像的能力和可逆双色荧光切换功能。
此外,通过对比3种Pdots的结构和性质,发现如下变化规律:(1)随着聚合物臂数的增加,Pdots中Eu(Ⅲ)的含量升高;(2)随着聚合物臂数的增加,Pdots水溶液复合荧光颜色变化区间依次变宽;(3)随着聚合物臂数的增加,增强的Eu(Ⅲ)配位键键能导致Pdots的LCST依次升高,且TPPE-4的LCST更接近人体体温,具有良好的可逆性;(4)粒径最小、双荧光效果最优的TPPE-4更容易被细胞吞噬,表现出最佳的双色成像效果,是一种良好的活细胞双色荧光显影剂,在荧光传感、生物成像及临床生物医学材料研究等领域具有较大的应用前景。
Supporting information is available at http://www.wjhxxb.cn

