柴胡皂苷B2对LPS诱导的脓毒症肺损伤氧化应激和炎性反应的影响研究∗
余莉萍 余淑菁 李旭成 崔金涛 陆佳鑫
(1.湖北省武汉市中医医院,湖北 武汉 430000;2.湖北省武汉市优抚医院,湖北 武汉 430000)
脓毒症是由于感染导致机体反应异常引发的全身炎性反应综合征,发病过程迅速,于2017年被世界卫生组织列为全球卫生重点防治疾病[1]。脓毒症能引发机体内多种器官的感染,如肺损伤、脑膜炎、胆管炎等,其中肺损伤是常见的并发症,且脓毒症急性肺损伤具有较高发病率、病死率,尽管脓毒症急性肺损伤的相关研究已有所进展,但是病死率仍高达30%左右[2-3]。脂多糖(LPS)是细菌外膜的关键成分,也是诱发多种疾病的致病因素,常用来构建脓毒症急性肺损伤模型[4]。柴胡皂苷B2是从中药柴胡内提取的活性成分,现代药理实验证明具有抗炎、抗氧化、保护肝脏等多种药理活性[5]。有研究结果显示,柴胡皂苷B2能够减轻LPS/氨基半乳糖诱导急性肝损伤小鼠的氧化应激和炎性损伤,改善肝脏的能量代谢[6],但是对LPS诱导的脓毒症急性肺损伤的研究尚不明确。本研究采用LPS诱导建立脓毒症急性肺损伤模型,观察柴胡皂苷B2对LPS诱导的脓毒症急性肺损伤氧化应激损伤和炎性反应的影响。
1 材料与方法
1.1 实验动物 实验清洁级SD大鼠50只,雌性各半,体质量(200±20)g,8周龄,购买中国食品药品检定研究院,许可证号为:SCXK(京)2012-0068。大鼠饲养于无病原菌的环境内,温度为22~25℃,湿度为50%~65%。
1.2 试剂与仪器 LPS购于美国Sigma公司;柴胡皂苷B2购于成都曼思特生物公司,纯度>99%;TUNEL试剂盒、BCA试剂盒、显色剂购于碧云天生物;B淋巴细胞瘤(Bcl-2)抗体、Bcl-2同源二聚体X蛋白(Bax)抗体、p53抗体、β-actin抗体、辣根过氧化物酶标记的二抗购于美国Abcam公司;超氧化物歧化酶(SOD)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒、丙二醛(MDA)试剂盒购于南京建成生物研究所;肿瘤坏死因子-α(TNF-α)试剂盒、白细胞介素-1β(IL-1β)试剂盒、白细胞介素-6(IL-6)试剂盒购于Diaclone公司。
1.3 造模与分组 将大鼠随机分为5组,每组10只,分别为空白对照组、模型组和柴胡皂苷B2低、中、高剂量组。除空白对照组外,其余大鼠腹腔注射10 mg/kg的LPS建立急性肺损伤模型。
1.4 给药方法 造模6 h后,柴胡皂苷B2低剂量组、中剂量组、高剂量组分别腹腔注射柴胡皂苷B2药液5、10、20 mg/kg;空白对照组和模型组注射2 mL的生理盐水。连续给药7 d后,采用戊巴比妥钠麻醉处死大鼠。
1.5 标本采集与检测 1)肺组织湿干比。处死大鼠后,取出右叶肺组织,使用滤纸擦拭干净水分,然后称重。随后置于70℃烘箱内24 h称取质量,用于测定肺组织湿干比。肺组织湿干比=(湿重-干重)/干重×100%。2)TUNEL染色检测肺组织细胞凋亡。收集大鼠部分左叶肺组织,经过石蜡包埋制成切片后,加入乙醇、二甲苯清洗,室温下加入20 μg/mL蛋白酶K反应15 min,PBS清洗,加入内源过氧化氢酶灭活5 min,利用PBS清洗,加入Tunel试剂,加入DAB显色液孵育10 min,利用乙醇、二甲苯脱水,用中性树胶封片后,在光学显微镜下观察Tunel染色情况,然后计算细胞凋亡率。3)Western blotting检测肺组织Bcl-2、Bax、p53蛋白表达。收集各组部分左叶大鼠肺组织,加入蛋白裂解液进行裂解,然后提取各组的总蛋白,利用BCA试剂盒检测定量蛋白浓度。然后将蛋白煮沸5 min,取35 μg上样蛋白,用8%的分离胶和4%的浓缩胶处理蛋白样品,蛋白样品转膜,封闭在5%脱脂奶粉内60 min,加入Bcl-2、Bax、p53、β-actin抗体,4 ℃孵育过夜,次日加入辣根过氧化物酶标记的二抗,室温孵育60 min,加入显色剂用于显色、显影。使用Quantity One软件分析蛋白表达量。4)ELISA检测血清SOD活性、GSH-Px活性、MDA、TNF-α、IL-1β、IL-6含量。处死大鼠后,收集肺组织周围血清5 mL,4℃下2 000 r/min离心10 min,离心半径为3 cm,并收集各组的上清液,然后按照ELISA试剂盒说明书步骤,检测各组SOD活性、GSH-Px活性、MDA、TNF-α、IL-1β、IL-6含量。
1.6 统计学处理 应用SPSS21.0统计软件。计量资料以(±s)表示,多组间比较用单因素方差分析,组内间比较用LSD法比较。P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠肺组织湿干比及细胞凋亡率的比较 见表1。与空白对照组相比,模型组内肺组织湿干比及细胞凋亡率显著增高(P<0.05);与模型组相比,柴胡皂苷B2低剂量组、中剂量组、高剂量组内肺组织湿干比及细胞凋亡率显著降低(P<0.05);与柴胡皂苷B2低剂量组相比,柴胡皂苷B2中剂量组、高剂量组内肺组织湿干比及细胞凋亡率显著降低(P<0.05);与柴胡皂苷B2中剂量组相比,柴胡皂苷B2高剂量组内肺组织湿干比及细胞凋亡率显著降低(P<0.05)。
表1 各组大鼠肺组织湿干比及细胞凋亡率比较(%,±s)
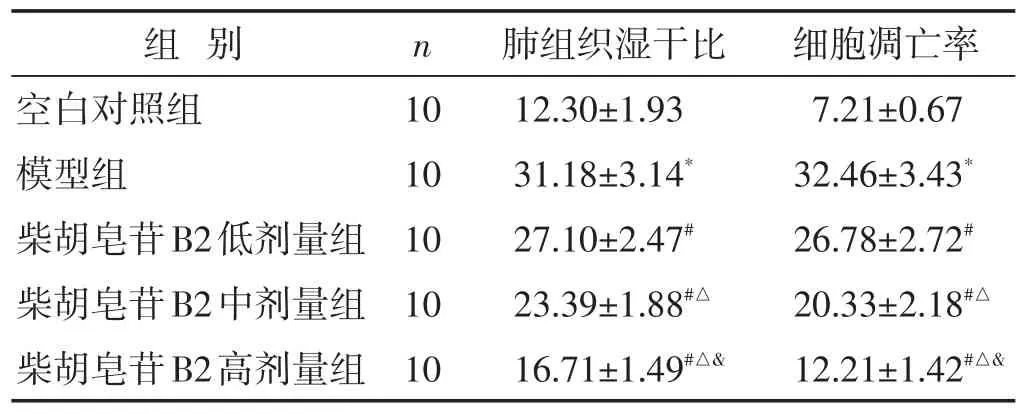
表1 各组大鼠肺组织湿干比及细胞凋亡率比较(%,±s)
注:与空白对照组比较,∗P<0.05;与模型组比较,#P<0.05;与柴胡皂苷B2低剂量组比较,△P<0.05;与柴胡皂苷B2中剂量组比较,&P<0.05。下同。
组 别n 肺组织湿干比 细胞凋亡率空白对照组模型组柴胡皂苷B2低剂量组柴胡皂苷B2中剂量组柴胡皂苷B2高剂量组10 10 10 10 10 12.30±1.93 31.18±3.14*27.10±2.47#23.39±1.88#△16.71±1.49#△&7.21±0.67 32.46±3.43*26.78±2.72#20.33±2.18#△12.21±1.42#△&
2.2 各组大鼠肺组织细胞凋亡相关蛋白表达的比较 见图1,表2。与空白对照组相比,模型组内Bax、p53蛋白表达显著增加(P<0.05),Bcl-2蛋白表达显著降低(P<0.05)。与模型组相比,柴胡皂苷B2低剂量组、中剂量组、高剂量组内Bax、p53蛋白表达显著降低(P<0.05),Bcl-2蛋白表达显著增加(P<0.05)。与柴胡皂苷B2低剂量组相比,柴胡皂苷B2中剂量组、高剂量组内Bax、p53蛋白表达显著降低(P<0.05),Bcl-2蛋白表达显著增加(P<0.05)。与柴胡皂苷B2中剂量组相比,柴胡皂苷B2高剂量组内Bax、p53蛋白表达显著降低(P<0.05),Bcl-2蛋白表达显著增加(P<0.05)。
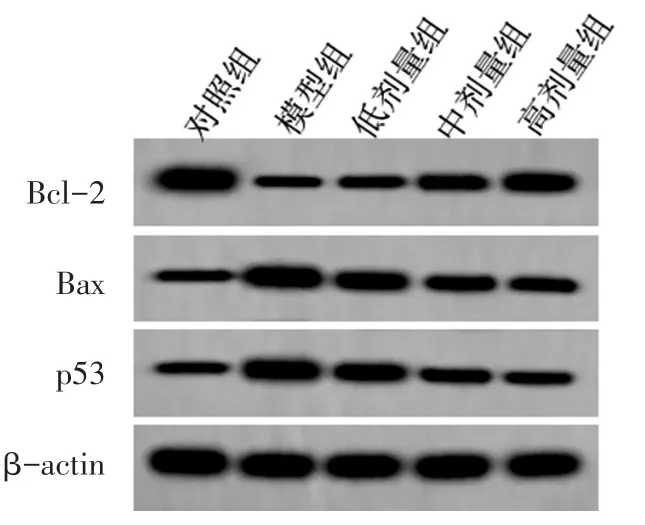
图1 各组肺细胞凋亡相关蛋白表达
表2 各组大鼠肺组织凋亡相关蛋白表达比较(±s)
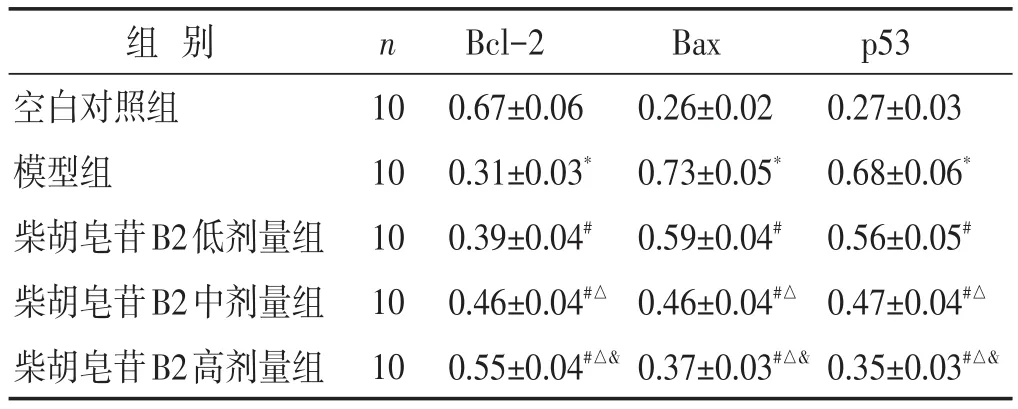
表2 各组大鼠肺组织凋亡相关蛋白表达比较(±s)
组别空白对照组模型组柴胡皂苷B2低剂量组柴胡皂苷B2中剂量组柴胡皂苷B2高剂量组n 10 10 10 10 10 Bcl-2 0.67±0.06 0.31±0.03*0.39±0.04#0.46±0.04#△0.55±0.04#△&Bax 0.26±0.02 0.73±0.05*0.59±0.04#0.46±0.04#△0.37±0.03#△&p53 0.27±0.03 0.68±0.06*0.56±0.05#0.47±0.04#△0.35±0.03#△&
2.3 各组大鼠血清内氧化应激水平的比较 见表3。与空白对照组相比,模型组内SOD活性、GSH-Px活性显著降低(P<0.05),MDA含量显著增加(P<0.05)。与模型组相比,柴胡皂苷B2低剂量组、中剂量组、高剂量组内SOD活性、GSH-Px活性显著增加(P<0.05),MDA含量显著降低(P<0.05)。与柴胡皂苷B2低剂量组相比,柴胡皂苷B2中剂量组、高剂量组内SOD活性、GSH-Px活性显著增加(P<0.05),MDA含量显著降低(P<0.05)。与柴胡皂苷B2中剂量组相比,柴胡皂苷B2高剂量组内SOD活性、GSH-Px活性显著增加(P<0.05),MDA含量显著降低(P<0.05)。
表3 各组大鼠SOD活性、GSH-Px活性、MDA含量比较(±s)
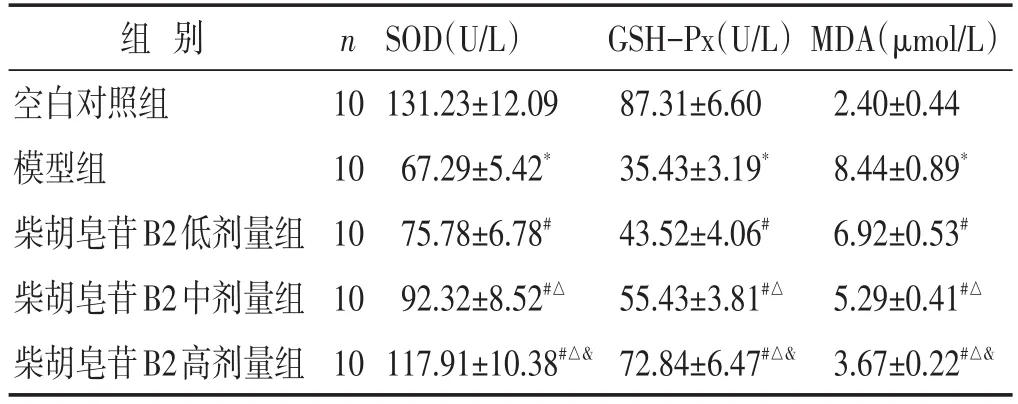
表3 各组大鼠SOD活性、GSH-Px活性、MDA含量比较(±s)
组别空白对照组模型组柴胡皂苷B2低剂量组柴胡皂苷B2中剂量组柴胡皂苷B2高剂量组n 10 10 10 10 10 SOD(U/L)131.23±12.09 67.29±5.42*75.78±6.78#92.32±8.52#△117.91±10.38#△&GSH-Px(U/L)87.31±6.60 35.43±3.19*43.52±4.06#55.43±3.81#△72.84±6.47#△&MDA(μmol/L)2.40±0.44 8.44±0.89*6.92±0.53#5.29±0.41#△3.67±0.22#△&
2.4 各组大鼠血清内炎性因子水平的比较 见表4。与空白对照组相比,模型组内TNF-α、IL-1β、IL-6显著增加(P<0.05);与模型组相比,低剂量组、中剂量组、高剂量组内TNF-α、IL-1β、IL-6显著降低(P<0.05);与柴胡皂苷B2低剂量组相比,柴胡皂苷B2中剂量组、高剂量组内TNF-α、IL-1β、IL-6显著降低(P<0.05);与柴胡皂苷B2中剂量组相比,柴胡皂苷B2高剂量组内TNF-α、IL-1β、IL-6显著降低(P<0.05)。
表4 各组大鼠TNF-α、IL-1β、IL-6水平比较(pg/mL,±s)
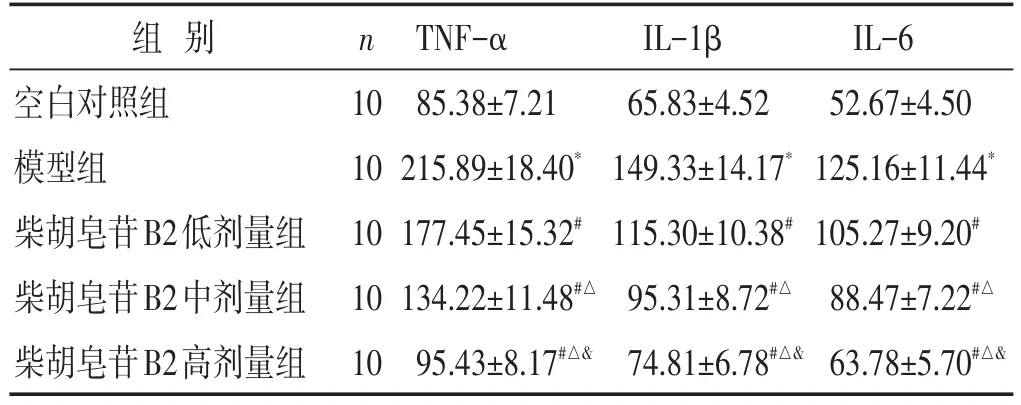
表4 各组大鼠TNF-α、IL-1β、IL-6水平比较(pg/mL,±s)
组别空白对照组模型组柴胡皂苷B2低剂量组柴胡皂苷B2中剂量组柴胡皂苷B2高剂量组n 10 10 10 10 10 TNF-α 85.38±7.21 215.89±18.40*177.45±15.32#134.22±11.48#△95.43±8.17#△&IL-1β 65.83±4.52 149.33±14.17*115.30±10.38#95.31±8.72#△74.81±6.78#△&IL-6 52.67±4.50 125.16±11.44*105.27±9.20#88.47±7.22#△63.78±5.70#△&
3 讨论
脓毒症急性肺损伤是多种因素导致的肺脏功能异常,使肺表面的活性物质降低,出现水肿、肺膨胀不全等表现[7]。目前,关于急性肺损伤的诊断方法和治疗方法相对较少,本研究通过采用LPS诱导建立脓毒症急性肺损伤动物模型,观察脓毒症急性肺损伤的发病机制。已有研究报道,LPS诱导建立急性肺损伤模型后,能改变肺组织湿干比,炎性因子TNF-α、IL-1β和IL-6等过度释放,增加活性氧产生和降低抗氧化物酶活性,导致肺组织产生损伤[8-9]。SOD、GSH-Px属于抗氧化物酶,具清除机体内氧自由基的能力,可以反映氧化应激损伤程度[10]。MDA是一种脂质过氧化物,其含量的高低能够反映氧化损伤的程度[11]。本研究结果显示,模型组内大鼠肺组织湿干比增加,细胞凋亡率上升,凋亡相关蛋白Bax、p53蛋白表达上调,Bcl-2蛋白表达下调,SOD活性、GSH-Px活性降低,MDA含量明显增加,炎性因子TNF-α、IL-1β、IL-6分泌明显增加,这说明本研究用LPS诱导建立的脓毒症急性肺损伤大鼠模型构建成功。
柴胡化学成分较为复杂,有皂苷类、挥发油类、多糖类和黄酮类等,其中皂苷类化合物据今已被报道的有100多种[12]。皂苷A和D是最早从柴胡内提出分离的,皂苷B2是齐墩果二烯型衍生物,现代药理实验证明,柴胡皂苷具有多种药理活性,如抗炎、抗氧化、抗凋亡、保肝、调节免疫等[13-14]。有研究结果显示,柴胡皂苷对大鼠肺组织具有保护用,能降低肺组织细胞凋亡数目,抑制IL-6、TNF-α和iNOS含量,减轻大鼠肺组织炎性浸润和纤维化程度[15]。高子涵等[16]研究结果发现,柴胡皂苷B2能够降低过氧化氢诱导的肝癌细胞凋亡,降低Bax蛋白表达,增加Bcl-2蛋白表达,提高肝癌细胞的抗凋亡能力。吕行直等[17]研究结果显示,柴胡皂苷B2可以降低四氯化碳诱导小鼠急性肝损伤血清内MDA含量,增加SOD活性,提高机体的抗氧化能力。以上说明柴胡皂苷具有良好的抗氧化、抗炎和抗凋亡能力,但是关于柴胡皂苷B2对急性肺损伤的研究尚不清楚。本研究发现,给予注射不同剂量的柴胡皂苷B2后,能降低LPS诱导的脓毒症急性肺损伤大鼠肺组织湿干比,减少细胞凋亡率,下调Bax、p53蛋白表达,上调Bcl-2蛋白表达,促进SOD活性、GSH-Px活性,降低MDA含量,抑制炎性因子TNF-α、IL-1β、IL-6分泌,说明柴胡皂苷B2能减轻LPS诱导的脓毒症急性肺损伤。
综上所述,柴胡皂苷B2对脓毒症急性肺损伤具有保护作用,能减轻其氧化应激和炎性反应,减少细胞凋亡,但具体研究机制需要进一步探究。

