血府逐瘀汤对COPD模型小鼠炎症因子及TLR4/MyD88/NF-κB信号通路的影响∗
王双乐 刘 欢 倪海滨
(南京中医药大学附属中西医结合医院,江苏省中医药研究院,江苏 南京 210028)
慢性阻塞性肺疾病(COPD)是临床常见的肺部咳喘疾病,每年在世界范围内导致300多万人的死亡[1],目前COPD的治疗目标是减少、减轻症状,提高运动耐量,并减少恶化的风险[2]。血府逐瘀汤是中医活血化瘀代表方,有活血化瘀、行气止痛之效,在治疗COPD方面有其独特功效[3]。研究表明血府逐瘀汤在一定程度上能够抑制COPD患者血清中肿瘤坏死因子-α(TNF-α)、白细胞介素-8(IL-8)以及核转录因子-κB(NF-κB)等细胞因子的表达[4],但具体作用机制尚不明确。炎症反应是COPD的重要发病机制,研究表明TLR4/衔接蛋白髓样分化因子(MyD88)/NF-κB信号通路参与COPD气道炎症发生[5],血府逐瘀汤是否参与及如何参与此通路控制COPD炎症反应尚不明确,本研究通过小鼠动物实验探讨血府逐瘀汤对COPD相关炎症因子及通路蛋白表达的影响。
1 材料与方法
1.1 实验动物 SPF级健康雄性C57BL6小鼠60只,体质量20~25 g,购自常州卡文斯实验动物有限公司,合格证编号:201720637,许可证编号:SYXK(苏)2016-0018。适应性饲养7 d。实验设计通过江苏省中医药研究院医学实验动物伦理委员会审议同意并批准。
1.2 试剂与仪器 血府逐瘀汤水煎剂:当归9 g,生地黄9 g,红花9 g,赤芍6 g,桃仁12 g,川芎6 g,枳壳6 g,柴胡3 g,桔梗5 g,牛膝10 g,甘草3 g。统一由江苏省中医药研究院中药房提供,由本研究院膏方室熬制,以上中药饮片加水分别制成1.56、0.78、0.39 g/mL 3种浓度的药液,灌胃所用药液需以此浓度当日配制并使用。脂多糖(索莱宝生物科技有限公司ABS38214368),红梅牌香烟[红塔烟草(集团)责任有限公司生产,货号6901028317511],地塞米松磷酸钠注射液(山东鲁抗辰欣药业有限公司,货号X02743),戊巴比妥(国药集团化学试剂有限公司,货号X03461),4%多聚甲醛(国药集团化学试剂有限公司,货号V900894),苏木精(武汉百仟度生物科技有限公司,货号C00400),伊红(武汉百仟度生物科技有限公司,货号C00400),PBS磷酸缓冲液(麦克林生物科技有限公司,货号AR0030),Mouse IL-6 ELISA Kit(赛默飞世尔科技公司,货号ZC-32446),Mouse IL-8 ELISA Kit(赛默飞世尔科技公司,货号ZC-32449),Mouse TNF-αELISA Kit(赛默飞世尔科技公司,货号JM-03277H1),Mouse IL-1β ELISA Kit(赛默飞世尔科技公司,货号JM-03336H1),Enzyme-linked Immunosorbent Assay Kit For Interleukin 17(IL-17)(赛默飞世尔科技公司,货号:ZC-32421),TLR4抗体(金唯智生物科技有限公司,货号AF7017),MYD88抗体(金唯智生物科技有限公司,货号AF4283),NF-κB抗体(金唯智生物科技有限公司,货号ABS131170)等。电子天平[梅特勒-托利多仪器(上海)有限公司PL-203],超声细胞粉碎机(宁波新芝生物JY92-Ⅱn),台式高速冷冻离心机(宁波新芝生物Neofuge 15R),全自动研磨仪(赛维尔生物KH-Ⅲ),自动洗板机(美国Rayto RT3100),酶标检测仪(美国BioTeK Epoch)等。
1.3 模型制备 本实验采用香烟联合LPS滴鼻法造模[6-7],将小鼠分别放置在50 cm×35 cm×50 cm的香烟熏箱中,每组10只小鼠,每次同时点燃10支香烟,30 min烟熏完毕后,将小鼠放回笼中继续正常喂养,每日烟熏2次,持续烟熏120 d。烟熏组小鼠分别于第1、30、60、90天予脂多糖LPS滴鼻,左手固定小鼠,右手持10 μL移液器,从鼻腔内滴入LPS 6 μL。
1.4 分组与给药 造模结束后分组:10只未进行烟熏的小鼠为空白组,采用尾巴染色标记法编号1~10,44只COPD模型小鼠根据体质量随机分组:模型组、阳性药物组、血府逐瘀汤高剂量组、血府逐瘀汤中剂量组、血府逐瘀汤低剂量组,模型组8只,其余各组9只小鼠,尾巴染色编号。血府逐瘀汤成人每日用量78 g,成人体质量按60 kg,人与小鼠之间给药倍数为9.1,算出小鼠正常给药剂量为11.8 g/(kg·d),中剂量组为23.6 g/(kg·d),高剂量组为47.2 g/(kg·d),制备不同质量浓度中药汤剂给药,从121 d起高剂量组、中剂量组、低剂量组小鼠按高、中、低给药剂量,采用灌胃方式,每日给药1次,持续给药30 d。阳性药物组予地塞米松腹腔注射,成人60 kg每日用量5 mg,小鼠按9.1倍换算为0.76 mg/(kg·d),从121 d起阳性药物组小鼠采用腹腔注射,每日给药1次。空白对照组、模型组小鼠灌胃等量0.9%氯化钠注射液。
1.5 标本采集与检测 给药结束后,称重并记录各组小鼠体质量,予戊巴比妥钠腹腔注射麻醉,眼球取血。打开小鼠颈前皮肤及胸腔,取双肺分别置于EP管中加入4%多聚甲醛固定,进行石蜡包埋、切片,左肺用于HE染色,右肺用于免疫组化。1)肺组织HE染色。将用多聚甲醛脱水后的左肺放入二甲苯中脱色,在石蜡中包埋过夜,切片厚度4 μm,放置在载玻片上,60℃烤箱中烘干。依次二甲苯、乙醇、蒸馏水充分浸洗5~10 min脱蜡。苏木精染色5 min,75%酒精、纯水冲洗,放到氨水中浸泡5~10 s,伊红染色5 min,依次放入95%乙醇、100%乙醇、二甲苯中各5 min。滴适量中性树胶,盖上盖玻片,烘干,显微镜下观察。2)血清炎症因子检测。将血液4℃环境中静置1 h,置于离心机离心,4 000 r/min,结束后取上清液,移液器移于EP管中,采用酶联免疫吸附试验法(ELISA)、根据ELISA试剂盒说明检测小鼠血清中TNF-α、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、IL-8、白细胞介素-17(IL-17)。3)免疫组化。将多聚甲醛中组织脱水后放入二甲苯中脱色,石蜡包埋,切片,烘干,依次二甲苯、乙醇、蒸馏水充分浸洗脱蜡。脱蜡后的切片加入枸橼酸修复液进行抗原修复,加入血清封闭,按照试剂盒中操作步骤,加入TLR4、Myd88、NF-κB一抗、二抗,室温下显色剂染色5 min,切片后镜下观察。
1.6 统计学处理 应用SPSS22.0统计软件。服从正态分布的计量资料以(±s)表示,方差齐者组间比较采用两独立样本t检验,组内比较采用配对样本t检验;方差不齐者采用t′检验。计数资料以例(%)表示,组间比较采用χ2检验;等级资料采用Wilcoxon秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠肺组织HE染色比较 空白组肺切片支气管、支气管形状规则,血管周围未见炎性细胞浸润,血管变形较少,肺泡明显扩张、塌陷、融合少见。模型组、阳性药物组、血府逐瘀汤各组小鼠肺切片,气管可见内皮损伤形态不规则,血管有轻度变形,血管平滑肌增厚、肺泡、血管周围中性粒细胞、单核细胞、淋巴细胞聚集较多,肺泡有融合、扩张、塌陷。阳性药物组及血府逐瘀汤低剂量组小鼠变化程度相似,居于空白组与模型组小鼠之间。与阳性药物组相比,血府逐瘀汤中、高剂量组小鼠小气道、肺泡、血管结构变化及炎性细胞浸润改变程度相对较轻。见图1。

图1 各组小鼠肺组织形态比较(HE染色,100倍)
2.2 各组小鼠炎症因子水平比较 见表1。与空白组比较,其余各组小鼠血清中TNF-α、IL-1β、IL-6、IL-8、IL-17含量均明显升高(P<0.05);与模型组比较,阳性药物组及血府逐瘀汤低、中、高剂量组小鼠肺血清中TNF-α、IL-1β、IL-6、IL-8、IL-17含量明显下降(P<0.05);与阳性药物组比较,血府逐瘀汤低剂量组小鼠血清中TNF-α、IL-1β、IL-6、IL-8、IL-17表达水平相近(P>0.05),血府逐瘀汤中、高剂量组小鼠血清中TNF-α、IL-1β、IL-6、IL-8、IL-17含量明显低于阳性药物组(P<0.05)。
表1 各组小鼠血清中炎症因子表达水平比较(pg/mL,±s)
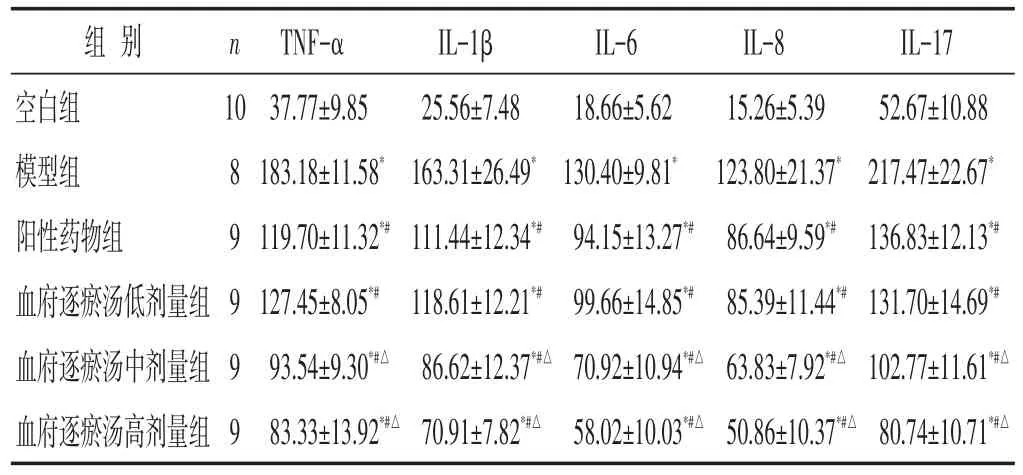
表1 各组小鼠血清中炎症因子表达水平比较(pg/mL,±s)
注:与空白组比较,∗P<0.05;与模型组比较,#P<0.05;与阳性药物组比较,△P<0.05。下同。
IL-17 52.67±10.88 217.47±22.67*136.83±12.13*#131.70±14.69*#102.77±11.61*#△80.74±10.71*#△组别空白组模型组阳性药物组血府逐瘀汤低剂量组血府逐瘀汤中剂量组血府逐瘀汤高剂量组n 10 8 9 9 9 9 TNF-α 37.77±9.85 183.18±11.58*119.70±11.32*#127.45±8.05*#93.54±9.30*#△83.33±13.92*#△IL-1β 25.56±7.48 163.31±26.49*111.44±12.34*#118.61±12.21*#86.62±12.37*#△70.91±7.82*#△IL-6 18.66±5.62 130.40±9.81*94.15±13.27*#99.66±14.85*#70.92±10.94*#△58.02±10.03*#△IL-8 15.26±5.39 123.80±21.37*86.64±9.59*#85.39±11.44*#63.83±7.92*#△50.86±10.37*#△
2.3 各组小鼠免疫组化比较 见表2,图2~图4。通过Image pro-plus6.0图像分析系统测量TLR4、MyD88、NF-κB免疫组化图片平均光密度值,进行TLR4、MyD88、NF-κB蛋白含量测定。结果显示,与空白组比较,其余各组肺组织中TLR4、MyD88、NF-κB表达水平明显升高(P<0.05),而通过阳性药物、血府逐瘀汤干预之后,小鼠肺组织中TLR4、MyD88、NF-κB表达水平均出现明显下降(P<0.05);与阳性药物组小鼠相比较,血府逐瘀汤中、高剂量组各组小鼠TLR4、MyD88、NF-κB表达水平更低(P<0.05)。

图2 各组小鼠TLR4免疫组化(200倍)

图3 各组小鼠MYD88免疫组化(200倍)

图4 各组小鼠NF-κB免疫组化(200倍)
表2 各组小鼠TLR4、MyD88、NF-κB表达水平比较(±s)

表2 各组小鼠TLR4、MyD88、NF-κB表达水平比较(±s)
组别空白组模型组阳性药物组血府逐瘀汤低剂量组血府逐瘀汤中剂量组血府逐瘀汤高剂量组n 10 8 9 9 9 9 TLR4 0.12±0.01 0.55±0.13*0.33±0.11*#0.38±0.10*#0.28±0.05*#△0.18±0.03*#△MyD88 0.11±0.01 0.44±0.09*0.29±0.04*#0.35±0.09*#0.22±0.04*#△0.19±0.03*#△NF-κB 0.12±0.02 0.53±0.11*0.26±0.05*#0.32±0.07*#0.25±0.05*#△0.21±0.04*#△
3 讨论
随着生态环境破坏、空气质量的恶化及吸烟人群的增加,COPD的发病率有着逐渐增高的趋势,COPD的防治工作存在诸多难题。COPD在中医上被认为是“肺胀”,肺胀反复发作、日久迁延不愈、气虚造成无力行血,血行缓慢,久之则成血瘀。最早在《灵枢·刺节真邪篇》中提到“宗气不下,脉中之血,凝而留止”。巢元方明确指出“诸痰者,皆由血脉壅塞,饮水积聚而不消除,故成痰也”,意为痰液的产生乃血脉不畅、饮入体内的水积聚津液不畅所形成[8]。后世认为痰瘀伏肺是COPD发病的夙根,既是COPD发病因素,也是其病理产物。临床研究表明血府逐瘀汤能够在一定程度上抑制COPD患者血清中IL-8、TNF-α以及NF-κB等细胞因子的表达,这可能与血府逐瘀汤中多种药物的抗炎及免疫调节作用相关[4]。
本课题组通过香烟烟熏联合LPS滴鼻成功构建了COPD小鼠模型[9],通过观察小鼠肺组织HE染色切片,可以看到与空白对照组相比,COPD小鼠气道的变形、肺泡的融合、塌陷、扩张,肺血管平滑肌增生及中性粒细胞聚集等现象明显增加。通过设置血府逐瘀汤3组不同的给药剂量,以地塞米松为阳性药物对照,30 d的给药后,发现与不干预的模型组相比,阳性药物组及血府逐瘀汤3组的肺组织镜下HE染色病理改变有不同程度减轻,炎症因子表达明显下降。免疫组化可以看到,与模型组小鼠相比,血府逐瘀汤各组小鼠肺组织中TLR4、MyD88、NF-κB蛋白表达下降明显,尤其是血府逐瘀汤高剂量组,蛋白表达优于阳性药物组。
TLR4/MyD88/NF-κB信号通路参与COPD气道炎症发生[10],Toll样受体(TLRs)是一组模式识别受体,参与机体的先天免疫系统,它可以识别病原体相关分子模式(PAMPS)[11]。TLR4是TLRs中一种重要的识别受体,有证据证明多种PAMPS可以刺激TIR4[12]。TLR4是LPS的一个重要的传感器,在识别LPS等PAMPS后,TLR4受体开始募集,并通过相关衔接蛋白传递给下游信号[13]。MyD88是一种常见的衔接蛋白[14],可以激活下游的核因子NF-κB。NF-κB是负责调节先天性和适应性免疫应答的主要转录因子,控制着炎症因子的释放[15-16]。
综合实验结果,COPD炎症反应与TLR4、MyD88、NF-κB等蛋白的高表达相关,血府逐瘀汤可能通过调节TLR4/MyD88/NF-κB信号通路减少了TNF-α、IL-1β、IL-6、IL-8、IL-17等炎症因子的释放,参与了COPD炎症反应的控制。

