2021 年江苏省化学中考优秀题例
优秀试题一
【原题呈现】(2021年扬州卷)
21.扬州被称为运河之都、文化之都和美食之都,自古人文荟萃。


(1)故人西辞黄鹤楼,烟花三月下扬州。
——唐·李白
①孟浩然“下扬州”的交通工具是木船,现代游船常用玻璃钢制造船体。玻璃钢属于▲(填“复合材料”或“金属材料”)。
②现代人远行可乘坐飞机。铝锂合金材料大量运用于国产C919大飞机的制造,下列不·属于铝锂合金性质的是▲(填字母)。
A.密度大 B.硬度大 C.抗腐蚀
③汽车是重要的陆路交通工具。燃油车辆须加装尾气催化净化装置,该装置将尾气中的CO 和NO 转化成CO2和一种无污染的气体,发生反应的化学方程式是▲。
(2)天下三分明月夜,二分无赖是扬州。
——唐·徐凝
①空气质量影响人们观赏明月。空气属于▲(填“混合物”或“纯净物”)。
②下列做法不·利于改善空气质量的是▲(填字母)。
A.风力发电 B.徒步出行
C.垃圾露天焚烧
③煤的气化和液化可实现能源清洁化,改善空气质量。水煤气中CO 和H2在高温、高压和催化剂条件下合成甲醇(CH4O),该反应的化学方程式是▲。
(3)前日扬州去,酒熟美蟹蜊。
——宋·梅尧臣

①蟹肉鲜美,富含蛋白质。蛋白质水溶液在加热时会生成沉淀,此沉淀▲(填“能”或“不能”)重新溶解于水中。
②各种酒中都含有乙醇(C2H6O)。在酿酒过程中,粮食中的▲(填糖类名称)先转化为葡萄糖,再经发酵生成乙醇。
③下列食品中富含维生素C 的是▲(填字母)。
A.盐水鹅 B.西红柿 C.大虾

【试题评析】
本题以“扬州与古诗词”为情境,综合了身边的化学物质,结合化学与社会发展,考查点涉及金属与金属材料、大气污染与环境保护、人类重要的营养物质、情境下化学方程式的书写等方面的知识。命题创新表现在“诗词意境与化学知识”的恰当融合,不显生涩和故弄玄虚。
优秀试题二
【原题呈现】(2021年盐城卷)
阅读下列资料,完成9~11题。
中华文明源远流长,“凝聚着深邃的哲学智慧和中华民族几千年理念及其实践经验”。
乃取蒙冲斗舰数十艘,实以薪草,膏油灌其中,……盖放诸船,同时发火。时风盛猛,悉延烧岸上营落。(晋·陈寿《三国志》)
墙角数枝梅,凌寒独自开。遥知不是雪,为有暗香来。(宋·王安石《梅花》)
烧铁器淬于胆矾水中,即成铜色也。(明·宋应星《天工开物》)
9.下列认知有误的是()
A“.薪草”“膏油”是可燃物
B“.同时发火”降低了“诸船”的着火点
C“.时风盛猛”提供充足的氧气
D“.膏油”着火不宜用水灭火
10.下列理解不当的是()
A.数枝梅的暗香指的是梅花的物理性质
B.梅花开的过程中发生的变化是化学变化
C.作者判断是梅而不是雪的依据是不同的物质具有不同的化学性质
D“.暗香来”是分子运动的结果
11.下列说法符合事实的是()
A“.烧铁器”中的“烧”属于反应条件
B“.即成铜色也”中的“铜色”指黄色
C“.成铜色”后“胆矾水”质量增加
D“.铁器”适宜盛放“胆矾水”
【参考答案】9.B;10.C;11.A
【试题评析】
本题汲取我国古代文化和科技典籍中的有关情境,展示了中华优秀科技成果和实践经验对人类发展和社会进步的贡献。以“赤壁之战”为背景,引导学生认识燃烧的条件、灭火和防火的方法,树立安全意识;以北宋王安石的《梅花》为背景,结合教材内容,认识物质变化的基本特征,判断物理变化和化学变化,并能用微粒的观点解释某些常见的现象;以明朝宋应星的《天工开物》结合教材内容和课标要求,帮助学生了解常见金属的物理性质、活动性强弱及相关应用。命题创新在于突出“中华科学史与化学基础知识”的关联性,恰当挖掘中国古代典籍中的科学价值。
优秀试题三
【原题呈现】(2021年南京卷)
21.某兴趣小组的同学对二氧化碳的制取和相关性质进行探究。
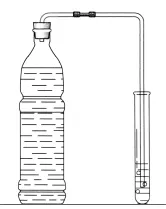
【实验探究】用实验证明碳酸型饮料(如汽水)中含有二氧化碳。兴趣小组同学用右图所示的装置进行实验:打开汽水瓶盖,立即塞上带导管的橡皮塞,将导管另一端伸入装有试剂的试管中。甲、乙两名同学分别用不同的试剂进行实验。
甲同学在试管中加入少量澄清石灰水,观察到试管内▲ ,由此得到结论:该汽水中含有二氧化碳。乙同学在试管中加入少量紫色石蕊溶液,观察到试管内▲,乙同学认为也能得到甲同学的结论。
【评价反思】兴趣小组的同学对甲、乙两名同学的实验方案进行评价。
(1)丙同学认为甲同学的方案比较合理,其试管中发生反应的化学方程式为 ▲ 。
(2)丁同学质疑乙同学的方案不够严密,认为也可能是该汽水中的柠檬酸随气体进入试管,而引起紫色石蕊溶液的变色。兴趣小组的同学针对丁同学提出的质疑进行了如下探究:
①查阅资料:柠檬酸为无色晶体,易溶于水和酒精;常温稳定,熔点153℃,熔化后沸腾前分解,分解温度约为175℃;柠檬、柑橘等水果中含有柠檬酸。
②乙同学在自己实验基础上,未增加任何试剂,接着进行了一步实验操作,该操作是 ▲ ,可观察到 ▲ ,该反应的化学方程式为 ▲ 。可以确认不是因为柠檬酸而引起紫色石蕊溶液的变色。

【试题评析】
本题以教材中的实验活动“二氧化碳的实验室制取与性质”为素材,考查学生利用实验探究二氧化碳的性质的能力。引导学生运用查阅资料等方式收集解决问题所需的证据,根据所要探究的具体问题设计简单的化学实验方案并对探究结果的可靠性进行评价,充分体现了化学学科的特点、学习化学的重要方法以及能用所学知识来解决问题的重要性。命题创新在于将“汽水中可能的干扰物质——柠檬酸”作为考点进行理性挖掘,对于“石蕊变红作为证据”的批判性反思,以及“排除柠檬酸干扰”的逆向操作设计,命题思路值得借鉴。
优秀试题四
【原题呈现】(2021年无锡卷)
18.H2是一种可持续研发的新能源和工业原料。
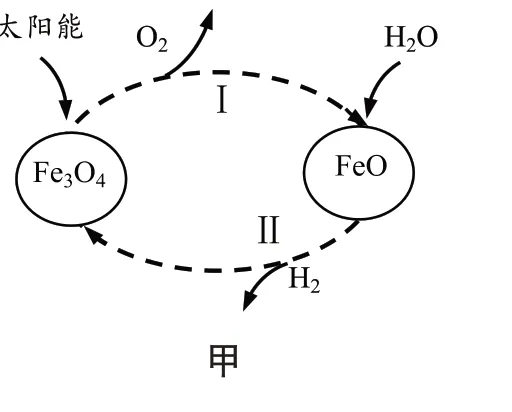
(1)利用太阳能将水转化为氢能是一种理想途径。某种光分解水的过程如图甲所示。
①该转化中循环利用的物质有:Fe3O4和▲。
②与电解水相比,该方法的优点是▲。
(2)CH4-H2O 催化重整是目前大规模制取H2的重要方法,生产过程中涉及的重要反应有:
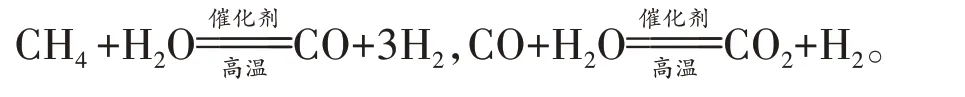
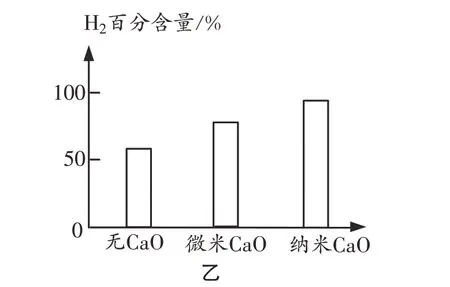
①向催化重整体系中投入一定量的CaO可提高H2的百分含量,原因是▲。
②如图乙所示,投入纳米CaO时,H2的百分含量最大的原因是▲。
【参考答案】(1)①FeO,②能耗低;(2)①吸收二氧化碳气体,②增大接触面积使反应更充分。
【试题评析】
本题以“氢能源研究”为主题,选择“太阳能分解水制氢”和“CH4-H2O 催化重整制氢”两个情境,体现化学在解决能源危机中的作用。“太阳能分解水制氢”主要考查“物质转化与应用”知识组块,“CH4-H2O 催化重整制氢”则侧重考查物质转化过程中的条件控制。试题全面考查学生面对复杂问题情境时有效获取情境信息、快速理解问题系统、准确描述结论观点等学科关键能力。命题创新在于“氢能源与碳化学”巧妙融合,“除杂问题的情境化设计”。
优秀试题五
【原题呈现】(2021年南通卷)
15.工业上用N2和H2合成NH3是人类科学技术的一项重大突破。
(1)①N2可通过分离液态空气获得,该方法利用了N2和O2沸点的差异。沸点属于物质的 ▲(填“物理”或“化学”)性质。
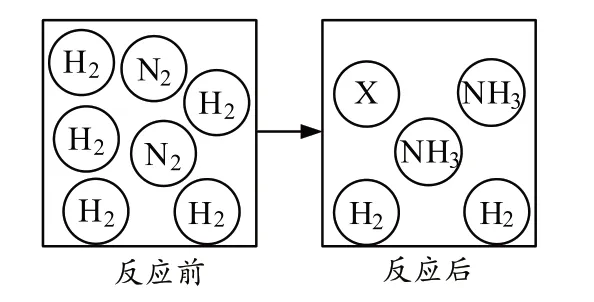
②一定条件下,向容器中充入一定量的N2和H2,充分反应生成NH3。反应前后物质的变化如下图,图中X 代表的分子为 ▲(填化学式)。
(2)NH3与氰酸(HOCN)反应生成尿素[CO(NH2)2]。
①尿素为农作物生长提供的主要营养元素为 ▲ 。
②尿素可用于去除大气污染物中的NO,其化学反应为6NO+2CO(NH2)25N2+2CO2+4H2O。若去除废气中6g NO,理论上所需质量分数为10%的尿素溶液的质量是多少?
【参考答案】(1)①物理;②N2;(2)①N(氮元素),②40g。
【试题评析】
本题以“氨气合成—氨气用于合成尿素—尿素在废气处理中的作用”这一完整过程为主线,设计了4 个基本问题:物质分离的基本方法、利用微观粒子示意图判断产物、氮肥在农业生产中的作用、尿素去除大气污染物NO。其中“微观粒子示意图”渗透化学平衡思想,体现初高中知识的衔接;尿素去除大气污染物NO 考查初中化学核心计算技能,利用方程式进行定量计算。命题创新体现在“关注合成氨化学”“含氮污染物的处理”,定量研究与定性相结合。
优秀试题六
【原题呈现】(2021年常州卷)
28.我国是全球规模最大的禽蛋生产国和消费国。对蛋壳中的钙源进行回收利用,可以变废为宝。蛋壳高温煅烧法制备乳酸钙的工艺流程如下:
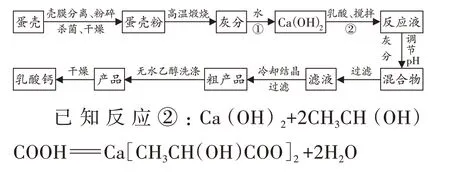
(1)蛋壳是生物活性钙源,含人体所需的硒,其属于 ▲(选填“常量”或“微量”)元素。(2)写出反应①的化学反应方程式:▲ 。(3)反应②的基本反应类型为 ▲ ,②中“搅拌”的作用是 ▲ 。
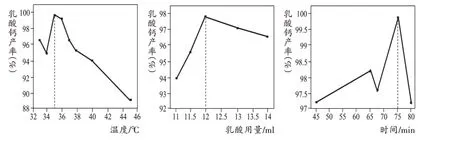
(4)某兴趣小组取4g“灰分”与乳酸反应,研究结果如下图,其最佳反应条件是 ▲ 。
(5)已知一个鸡蛋壳约5g,蛋壳中碳酸钙含量约90%。某品牌乳酸钙产品,每瓶180 粒,每粒含钙元素400mg,采用鸡蛋壳作为唯一钙源,制备这样一瓶钙片至少需要 ▲ 个鸡蛋壳。
【参考答案】(1)微量;(2)CaO+H2OCa(OH)2;(3)复分解反应,使反应物充分接触从而加快反应;(4)35℃时加12mL乳酸反应75分钟;(5)40。
【试题评析】
本题将真实而复杂的生产工艺进行简约化处理,以物质的转化为主线,实际操作为辅线,钙元素的转化守恒、回收利用为串联线,用化工流程图呈现主要信息,贯穿了核心价值和素养能力线,将实验从虚拟的实验室走向真实的工业生产。试题主要考查了“科学探究”“物质构成的奥秘”“物质的化学变化”三大主题相关知识,承载了分类表征、变化守恒、实验探究、绿色应用等素养。命题创新在于“生活化与应用性结合”“真实实验与定量计算相结合”。
优秀试题七
【原题呈现】(2021年泰州卷)
19.碳酸钙是初中阶段化学学习中的常见物质,某化学兴趣小组围绕此物质展开探究。
相关信息:一定体积的溶液中,离子数目越多,其离子浓度越大;电导率传感器用于测定溶液的导电性强弱,在其他条件相同情况下,溶液中离子浓度越大,溶液的电导率越大。
【实验探究Ⅱ】在试管中加入少量碳酸钙粉末,加入2mL水,振荡摇匀,制成碳酸钙悬浊液,滴加2滴酚酞试液,酚酞试液变红。
(1)酚酞试液变红证明碳酸钙悬浊液显▲性。
(2)在相同实验条件下,用电导率传感器测得水电导率为8.5,碳酸钙悬浊液电导率为74。与水比较,碳酸钙悬浊液中离子浓度较▲(填“大”或“小”),证明在碳酸钙悬浊液中有部分碳酸钙溶于水,形成碳酸钙▲ 溶液(填“饱和”或“不饱和”)。
(3)小组继续探究碳酸钙悬浊液使酚酞试液变红的微观原因,做了下面的对照实验:用pH 传感器分别测得在常温下五种混合体系的pH,如下表所示。
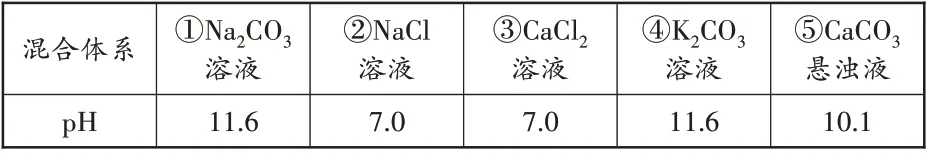
混合体系pH①Na2CO3溶液11.6②NaCl溶液7.0③CaCl2溶液7.0④K2CO3溶液11.6⑤CaCO3悬浊液10.1
从上表可知,“盐溶液一定显中性”的说法是▲(填“正确”或“错误”)的。
结合①②③④数据分析可知,Na2CO3溶液使酚酞试液变红与碳酸钠组成中▲离子(填离子符号)有关。查阅资料可知,碳酸钠能与水发生一定程度反应生成一种钠盐和另一种化合物,试写出此反应两种生成物的化学式▲。结合⑤的数据分析,碳酸钙悬浊液使酚酞试液变色原因与碳酸钠溶液使酚酞试液变色原因本质上是一致的。
【试题评析】
本题对于“碳酸钙是否具有碱性”这个问题提出质疑、设计方案、深入探究、展开反思,对培养学生的批判性思维与创新思维具有良好的导向作用。在解决“酚酞溶液变色原因”的问题后,进而深入研究“盐溶液是否都是中性”问题。试题通过给予足够资料信息,锻炼学生基于证据推理的理性思维、科学思维。命题创新在于“碳酸钙的再认识”,有利于培养学生的批判性思维。

