香瓜茄多组织部位和病害胁迫条件下qRT-PCR内参基因的选择
黄丽萍,李思鸿,钟启文,3*,王晋民
( 1.青海大学,青海 西宁 810016; 2.青海大学农林科学院,青海 西宁 810016;3.青海省蔬菜遗传与生理重点实验室,青海 西宁 810016)
香瓜茄(Solanummuricatum)原产于南美洲,属茄科茄属香瓜茄种,为多年生双子叶草本植物。其果实成熟后呈淡黄色并带有紫色或紫红色条纹,鲜嫩多汁,风味独特,口感清甜且热量低,富含多种矿物质和维生素[1],枝干造型独特,具有欣赏价值,因而近年来逐渐受到人们的喜爱。当前对香瓜茄的研究主要集中于园艺学性状、化学成分分析、栽培、贮藏等传统农学研究和功能性研究,随着香瓜茄市场规模愈加壮大,利用基因表达分析鉴定与香瓜茄种质资源、风味及营养相关的关键物质的调控基因,成为研究人员开展品质育种工作研究的重要方向[2]。qRT-PCR技术是研究基因表达的重要技术手段,主要应用于检测不同细胞类型和组织的mRNA表达水平,也能精确检测相关基因在各种情况下的表达丰度,如植物生长形成、品质、产量等相关基因表达,这些研究均离不开稳定的内参基因[3-4]。
目前,已有学者成功鉴定出多个物种不同条件下的内参基因,同时在IGG (http://icg.big.ac.cn)中已经收录了超过150种植物的多种内参基因信息[5]。在植物体中常用的内参基因包括β-微管蛋白基因(tubulin,TUB)、多聚泛素酶基因(ubiquitin,UBQ)、甘油醛-3-磷酸脱氢酶基因(glyceral-dehyde-3-phosphatedehydrogenase,GAPDH)、肌动蛋白基因(actin,ACT)、核糖体RNA基因(如18SrRNA、26SrRNA)、转录延伸因子基因(elongationfactors1alpha,EF1α)等[6]。内参基因在各个组织部位都有表达,但仍然受到组织部位差异和外界胁迫的影响,呈现不同的表达稳定性,并不存在在任何组织部位和任何条件下都能稳定表达的内参基因,如EF1α被认为是马铃薯在生物(晚疫病)和非生物胁迫(盐胁迫)下最稳定的内参基因,而EF1α和APRT则是冷胁迫下最稳定的内参基因[7]。所以需要寻找特定条件下表达变化最小的内参基因,以尽可能地反映靶基因真实的转录水平,或选择多个内参基因组合的方式来提高内参基因筛选的可靠性[8]。为了加强对新兴水果香瓜茄的深入研究,本研究以初花期香瓜茄的不同组织部位及病害胁迫下苗期香瓜茄的叶片为试验材料,选取9个常用内参基因GAPDH1、UBI、UK、β-TUB、GAPDH2、EF1α、ACT、APT、18SrRNA,对比分析它们在香瓜茄中的表达水平,采用geNorm、NormFinder和BestKeeper软件评估候选内参基因表达稳定性,旨在为香瓜茄的相关基因分析提供稳定的内参基因。
1 材料与方法
1.1 试验材料
采集青海大学农林科学院种子繁育的初花期香瓜茄植株,取根(O1)、茎(O2)、叶(O3)和花(O4)等4个组织部位作为多组织样品。采集青海西宁地区含4种病毒(未完全脱毒)的香瓜茄组培苗苗期植株叶片(S1)及含1种病毒的香瓜茄种子繁育实生苗苗期植株叶片(S2),甘肃武威地区出现花斑、卷叶等症状的香瓜茄苗期植株叶片(S3),云南石林地区出现疫病症状的香瓜茄苗期植株叶片(S4),作为病害胁迫条件下的样品。采集的样品先进行液氮速冻,然后置于-80 ℃冰箱保存取用。
1.2 RNA提取和逆转录
采用Trizol法提取样品总RNA,利用1%(w/v)琼脂糖凝胶电泳验证总RNA完整性,通过NanoDrop 2000超微量分光光度计(美国,NanoDrop Technologies)测定RNA的纯度,通过Fast-King cDNA第一链合成试剂盒反转录系统(中国,生工生物工程(上海)股份有限公司)进行反转录获得cDNA,对总RNA样本进行反转录时总量需调配至100 ng。
1.3 候选内参基因及qRT-PCR引物设计
在IGG中选取近缘茄科作物的9个内参基因作为候选内参基因,运用Primer Premier6设计引物,得到9个候选内参基因引物,引物由生工生物工程(上海)股份有限公司合成,基因名称、引物序列及片段扩增长度如表1所示。

表1 候选内参基因qRT-PCR引物序列
1.4 qRT-PCR反应及分析
取1.2中的cDNA样品(cDNA样品稀释至10-1)为模板,以表1中的引物序列为引物,进行qRT-PCR反应。采用Roche LightCycler480Ⅱ实时荧光定量PCR系统,按照SYBR Green法进行qRT-PCR反应,荧光定量染料选用Premix Ex Taq(TaKaRa)。反应体系(20 μL):1 μL模板,各0.6 μL的正向及反向引物(10 μmol/L),10 μL 2X SanTaq PCR Mix预混液及7.8 μL ddH2O。反应程序:95 ℃预变性30 s;95 ℃变性5 s,退火30 s,72 ℃延伸30 s,反应40个循环。58 ℃至95 ℃范围内连续测定荧光强度获得熔解曲线,用于评估引物特异性;每个样品内荧光信号达到设定阈值时所经历的循环数为Cq,分析内参基因稳定性。每个样品重复3次。
1.5 数据处理和分析
运用geNorm、NormFinder和BestKeeper等3种软件[9]对9个候选内参基因在初花期香瓜茄不同组织部位及病害胁迫条件下苗期香瓜茄叶片中的表达稳定性进行分析。geNorm和NormFinder是基于微软Excel软件下的算法。geNorm作为使用最广泛的软件,以配对差异值(V)和M值作为衡量内参基因表达稳定性的主要指标,M值越低的基因表达越稳定[10]。通过计算单个基因和所有其他被测对照基因之间的平均两两变异,测量基因表达稳定性M。使用时首先需要在微软Excel软件中将qRT-PCR所得到的候选内参基因Cq值,根据公式Q = 2Cq(min)-Cq(sample)转化为基因相对表达量Q(Cq(min)为各组织样本和病害胁迫下候选内参基因的最小Cq值);然后将基因相对表达量Q数据导入geNorm程序,得到候选内参基因稳定性折线图,该图最左边基因的M值与基因的稳定性呈负相关,即M值越小,代表基因的稳定值越高,反之则越低。由于本试验中的候选内参基因大于3个,需要对数据进行归一化处理,在2个连续的归一化因子(NFn和NFn+1)之间计算Vn/n+1(其中n为基因表达归一化的内参基因的数量),配对差异值(V)以0.15为界限,大于临界值需要引入该内参基因对后一位内参基因进行标准化。
NormFinder软件是根据给定样本集和试验处理中的多个内参基因的表达稳定性进行排序,排序等级最低的为该条件下表达最稳定的基因,即M值越小,表示基因的稳定性越高。其数据前处理同geNorm软件一样,处理后导入的同样是基因相对表达量,根据软件的不同算法得到表达稳定值M,根据M值进行稳定性排序。
BestKeeper软件则是通过比较各候选内参基因在不同样品间Cq值产生的标准偏差(SD)、变异系数(CV)及相关系数(r)来确定候选内参基因的稳定性。当内参基因表达稳定性越好,内参基因一般呈现较高的r值,较小的SD值和CV值。此外,当SD值大于1 时,则表明候选内参基因的表达不稳定。较前两个软件其优势在于,它不单单能够评估内参基因的稳定性,而且可以对多种目的基因的转录水平进行评估。
最后,通过对三种软件分析结果进行比较,从多个候选基因中筛选出最优的内参基因。
2 结果与分析
2.1 总RNA提取及质量检测
对初花期香瓜茄不同组织部位及病害胁迫条件下苗期香瓜茄叶片提取的总RNA,使用1.0% 琼脂糖凝胶电泳检测总RNA质量时发现,电泳条带清晰,28S∶18S条带接近2∶1。同时,利用NanoDrop 2000超微量分光光度计进行纯度检测,结果如表2所示,A260/A280 比值均在1.615~2.565,证明RNA完整性良好。对于本试验中出现的A260/A280≥2,但A260/A230≤1,可能是胍盐残留;A260/A280≤2,但A260/A230与A260/A280相比显著下降,可能是出现了蛋白残留;1≤A260/A280≤1.5,1≤A260/A230≤1.5,可能是由于酚残留。综合考虑凝胶电泳检测与NanoDrop 2000检测结果,提取的RNA可用于后续试验。
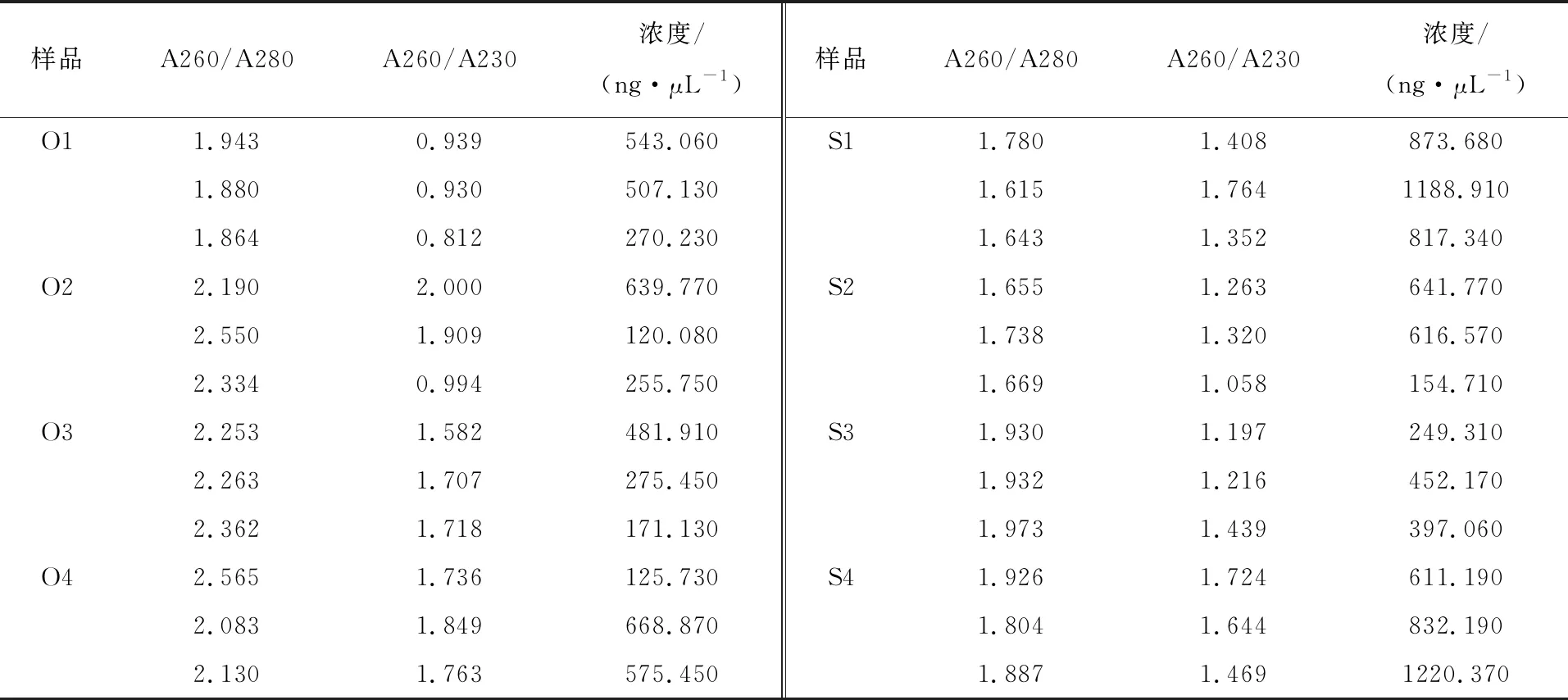
表2 香瓜茄不同样本的总 RNA 质量和纯度检测
2.2 内参基因qRT-PCR特异性分析
对内参基因进行qRT-PCR,结果显示9个内参基因的熔解曲线只有单一信号峰出现;再对内参基因引物qRT-PCR产物进行检测,发现琼脂糖凝胶电泳结果显示单一条带。综合以上结果说明9个内参基因引物无二聚体且特异性良好,可以在该qRT-PCR条件下进行后续试验研究。
2.3 内参基因稳定性分析
2.3.1 geNorm分析 由图1可知,在8个不同样本中,除了叶片(O3)的V2/3=0.154和病毒病感病苗叶片(S3)的V2/3= 0.169,配对差异值均大于0.15,需要引入第3个内参基因。其余6个样本候选内参基因的配对差异值均小于0.15,表明可使用2个内参基因在香瓜茄多组织部位和病害胁迫条件下进行qRT-PCR归一化;由图2可知,各样本结果略有差异,但所有样本候选内参基因的M值均在1.5以下。当以香瓜茄不同组织为材料时,根(O1)中M值最小的为18SrRNA和APT,茎(O2)和花(O4)中M值最小的为GAPDH2和APT,叶(O3)中M值最小的为EF1α和APT;当以香瓜茄不同病害胁迫条件下苗期香瓜茄叶片为材料时,组培苗叶片(S1)、病毒病感病苗叶片(S3)和疫病感病苗叶片(S4)中M值最小的为GAPDH2和APT,实生苗叶片(S2)中M值最小的为UBI和APT。结合图1和图2分析可知,香瓜茄根部内参基因最理想的为18SrRNA和APT;香瓜茄茎和花,组培苗叶片和疫病感病苗叶片内参基因最理想的为GAPDH2和APT;组织处理中叶片(V2/3=0.154)及病害胁迫条件下病毒病感病苗叶片(V2/3=0.169)由于V2/3超过0.15,需要引入第3个基因进行矫正,内参最适数目为3个,均含APT。由以上分析可知,geNorm软件分析得到不同条件下香瓜茄最适的内参基因为APT。

图1 geNorm软件分析内参基因最适数目

图2 候选内参基因的平均表达稳定值
2.3.2 NormFinder分析 由表3可知,9个候选内参基因的稳定性在初花期香瓜茄不同组织部位及病害胁迫条件下苗期香瓜茄叶片中排序不同,根、茎、叶和花中表达稳定性最好的内参基因为APT,其次是18SrRNA,而GAPDH1基因在根、茎、叶中表达稳定性最差,β-TUB基因在花中表达最不稳定;在病害胁迫处理下,表达稳定性最好的内参基因是APT,其次是18SrRNA和UBI,而β-TUB在病毒病感病苗叶片中稳定性最差,ACT在组培苗和疫病感病苗叶片中的表达稳定性最差。该软件排序稳定性分析结果与geNorm软件稳定性分析结果基本一致。

表3 NormFinder软件分析香瓜茄中9个候选内参基因稳定性
2.3.3 BestKeeper分析 由表4可知,9个候选内参基因中18SrRNA(SD = 0.767)和UBI(SD = 0.902),SD值低于1.0,其他内参基因的SD值均大于1.0,说明基因18SrRNA和UBI表达稳定性最好。而在9个候选基因中,GAPDH2基因的SD值最高(SD = 2.127),表明该基因表达稳定性最差。
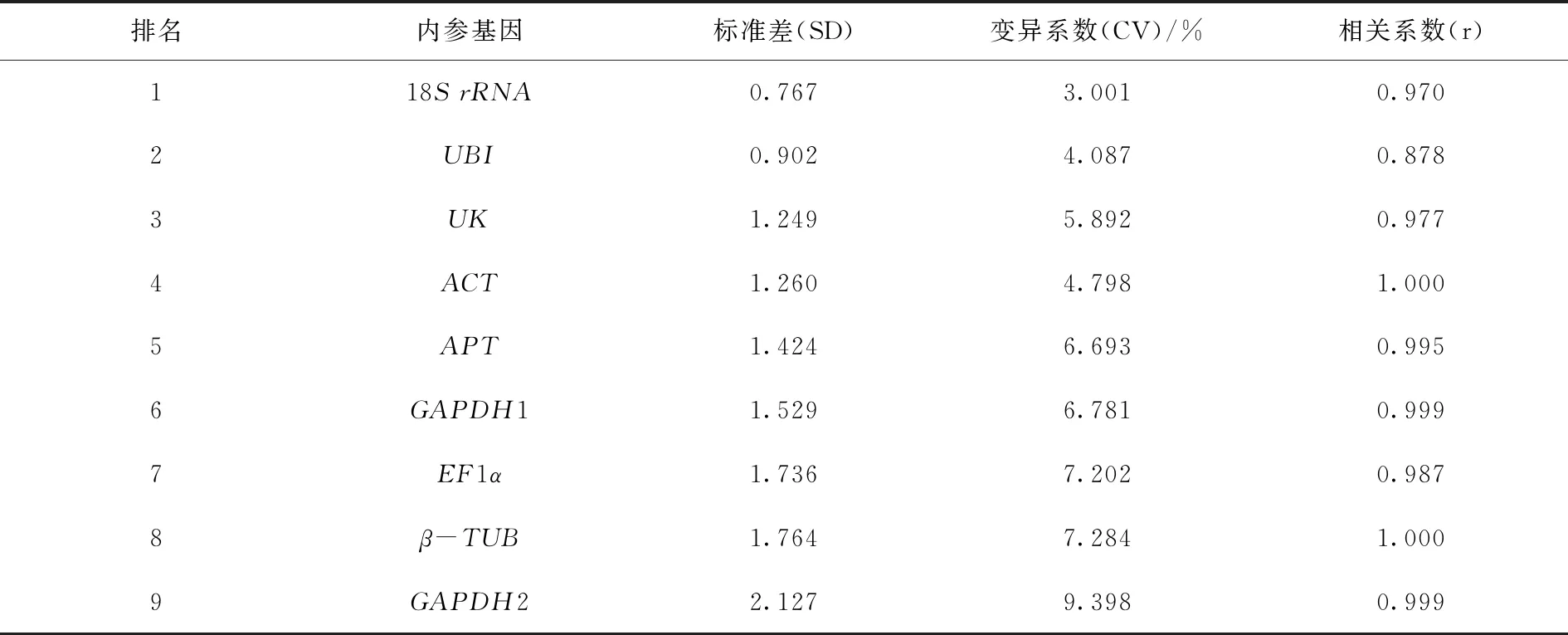
表4 BestKeeper软件分析香瓜茄中9个候选内参基因稳定性
因此,综合BestKeeper软件稳定性分析结果与geNorm和NormFinder软件稳定性分析结果,从9个不同的候选内参基因中,筛选获得香瓜茄3个表达稳定性良好的内参基因APT、18SrRNA和UBI。
3 讨论与结论
为了筛选香瓜茄的稳定内参基因,本文分析对比了香瓜茄在不同组织部位及病害胁迫条件下9个内参基因的表达稳定性,结果表明:geNorm软件分析确定的最理想内参基因是APT;NormFinder软件分析确定的稳定性最好的内参基因为APT,其次是18SrRNA和UBI;BestKeeper软件分析确定的符合条件的稳定内参基因为18SrRNA和UBI。Tang等[11]用geNorm、NormFinder、BestKeeper和RefFinder 4种软件分析了马铃薯的稳定内参基因,在干旱和渗透胁迫条件下EF1α和sec3基因是马铃薯中表达最稳定的内参基因;但Mariot等[12]用geNorm、NormFinder和BestKeeper 3种软件在分析马铃薯不同块茎内参基因时发现,geNorm和NormFinder软件确定的稳定内参基因非常相似,均为C2和sec3基因为稳定内参基因,而BestKeeper软件分析的结果与其他2个软件不同,确定了第三内参基因CUL3A。本文在利用geNorm、NormFinder和BestKeeper 3种软件分析香瓜茄不同组织部位和不同非生物胁迫条件下稳定内参基因时出现了与Mariot等[12]研究结果同样的情况,筛选到了3个(APT、18SrRNA和UBI)相对稳定的内参基因,证明不同分析软件的评估方法会影响内参基因稳定性的最后排名。
内参基因的表达水平在不同物种中不是恒定的,甚至在同一物种不同组织部位表达也不完全相同。相关研究表明,茄科中马铃薯、番茄、辣椒的稳定内参基因是不同的[13-15],如马铃薯块茎中最稳定的内参基因是C2、sec3和CUL3A[12]; Cheng等[15]研究发现UBI基因是辣椒果实发育中最稳定的内参基因;在番茄中,DNAJ、GAPDH和TUA基因[12]早就被用作番茄中基因表达分析的内参基因,而Exposito-Rodriguez等[14]在研究番茄发育过程中的内参基因时,认为以CAC和TIP41基因为内参基因可以可靠地标准化整个番茄发育过程中的基因表达情况。本研究结果同样证明内参基因在同一物种的不同组织部位及病害胁迫条件下的稳定性是不完全相同,如NormFinder软件分析结果表明:APT在香瓜茄叶片中的稳定表达值(M)为0.8,花中的稳定表达值为 0.472,而在香瓜茄苗期病毒病感病苗叶片中的稳定表达值为0.525。
综上可知,利用geNorm、NormFinder和BestKeeper 3种分析软件筛选得到APT、18SrRNA和UBI为香瓜茄稳定内参基因,其中APT在不同组织部位及病害胁迫条件下都有着良好的表达稳定性,最终确定APT基因是本试验条件下定量检测香瓜茄基因表达的最理想内参基因。

