右美托咪定预处理调控PINK1/Parkin通路对H9C2细胞缺氧/复氧损伤线粒体自噬的影响
吴华兵
缺血性心脏病是心血管疾病死亡的主要原因之一,占全部心脏病死亡的50%左右。心肌缺血/缺氧是心脏不能正常工作的一种病理状态,由心脏血流灌注减少,导致供氧减少,使得心肌能量代谢异常所致[1-2]。目前,缺血性心脏病的主要治疗手段是血流再灌注,而研究表明,血流再灌注治疗可导致心肌出现血流再灌注损伤,主要表现为心肌细胞氧化应激损伤,损害心脏功能[3]。因此,探寻有效的预防心肌再灌注损伤的药物是临床研究热点。右美托咪定是一种α2-肾上腺素受体激动剂,研究显示,其对心肌具有保护作用[4]。罗敏等[5]研究显示,右美托咪定可抑制心肌缺血再灌注模型大鼠心肌细胞凋亡,减少心肌梗死面积,进而缓解心肌损伤。邹田田等[6]研究显示,右美托咪定可通过稳定线粒体膜电位抑制高糖诱导的心肌H9C2细胞线粒体损伤及细胞凋亡。线粒体自噬是细胞清除受损线粒体的过程,研究表明,线粒体自噬功能障碍与心肌缺血再灌注氧化应激损伤有关[7]。目前,有关右美托咪定减轻心肌缺血再灌注损伤的机制尚未明确,因此,本研究以右美托咪定干预缺氧/复氧(hypoxia/reoxygenation,H/R)条件下的心肌细胞,观察其对心肌细胞内线粒体自噬的影响,为明确右美托咪定的心肌保护作用提供一定参考。
1 材料与方法
1.1 主要材料与仪器 大鼠心肌细胞系H9C2细胞株(bio-73030)购自北京百欧博伟生物技术有限公司;DMEM培养基(CDLG-3719)、3-2(4,5-二甲基噻唑-2)-2-四甲基偶氮噻唑蓝(MTT)购自美国Sigma公司;JC-1荧光探针线粒体膜电位检测试剂盒(J8030)、超氧化物歧化酶(superoxide orgotein dismutase,SOD)活性检测试剂盒、丙二醛(malonaldehyde,MDA)含量检测试剂盒均购自南京建成生物研究所;活性氧(reactive oxygen species,ROS)含量测定试剂盒购自上海前尘生物科技有限公司;蛋白提取试剂盒(BC3710-100T)购自上海吉至生化科技有限公司;兔抗微管相关蛋白轻链3(microtubule-associated protein 1 light chain 3,LC3)、家蚕隔离体蛋白1(p62)抗体(H00008650-A01)、PTEN诱导激酶1(PTEN induced kinase 1,PINK1)抗体(FNab09992)、E3泛素连接酶(E3 ubiquitin ligase,Parkin)抗体(bs-1865R)、β-actin抗体(ATA40114)、山羊抗兔HRP(SE12-0.1)二抗均购自北京索莱宝科技有限公司。CO2培养箱(型号NHD DYE1738)购自日本Sanyo公司;Elx800酶标仪(型号HSG9832)购自美国Thermo公司。
1.2 方法
1.2.1 细胞培养 取H9C2细胞解冻、复苏,于含10%灭活胎牛血清(fetal bovine serum,FBS)及1%链霉素的DMEM培养基、37 ℃、5%CO2、95%O2培养箱中培养,2 d或3 d换液1次,无菌操作,传代培养。
1.2.2 H/R细胞模型的建立 实验时弃去细胞培养基,更换饱和的模拟缺氧液,将细胞置于缺氧盒中持续通入95%N2、5%CO2的混合气体37 ℃下缺氧3 h,弃去缺氧液,更换饱和的模拟复氧液,持续通入95%O2、5%CO2的混合气体37 ℃下复氧3 h[8]。
1.2.3 细胞分组及处理 取1.2.1制备的对数生长期的H9C2细胞重悬并接种至24孔板(2.5×105个/孔)上,随机分成5组。空白对照组:只含H9C2细胞,在37 ℃、5%CO2、95%O2培养箱中以无FBS的培养基正常培养细胞48 h;H/R组:依据1.2.2操作后,更换为正常培养基继续培养48 h;右美托咪定低剂量组、中剂量组、高剂量组:H/R处理前分别加入0.1 μmol/L、1.0 μmol/L、10.0 μmol/L右美托咪定溶液预处理[9],后更换为正常培养基继续培养48 h。
1.2.4 MTT法检测各组H9C2细胞增殖能力 取1.2.3各组培养48 h的H9C2细胞重悬并接种至24孔板(2.5×105个/孔)继续培养48 h,各孔加MTT 20 μL(5 g/L),继续培养4 h后,加入150 μL二甲基亚砜(DMSO),振荡、溶解。在酶标仪490 nm处测定各孔细胞光密度(optic density,OD),重复3次,取平均值。细胞增殖抑制率(%)=(空白对照组OD-实验组OD)/空白对照组OD×100%。
1.2.5 H9C2细胞氧化应激水平检测 取1.2.3各组培养48 h的H9C2细胞,重悬并接种至24孔板(2.5×105个/孔)。收集各组培养上清液或细胞,分别采用SOD活性检测试剂盒、MDA含量检测试剂盒、ROS含量测定试剂盒检测培养上清液SOD活性、MDA含量及细胞ROS水平变化。
1.2.6 透射电镜下观察细胞自噬体 收集1.2.3各组培养48 h的H9C2细胞,重悬并接种至24孔板(2.5×105个/孔),胰酶消化(0.25%),细胞密度达70%~80%时刮取细胞,离心10 min,细胞沉淀采用磷酸缓冲盐溶液(PBS)清洗,2.5%戊二酸醛固定,4 ℃冰箱保存过夜,50%乙醇常规脱水,环氧树脂包埋,60 ℃聚合48 h,切片(厚度80 nm),枸橼酸铅染色,置于透射电镜下观察细胞中自噬体,采用Image Pro Plus 6.0图像分析软件检测。
1.2.7 JC-1法检测线粒体膜电位(mitochondrial membrane potential,MMP) 取1.2.3各组培养48 h的H9C2细胞,重悬并接种至24孔板(2.5×105个/孔)。参照试剂盒说明书配制JC-1染色工作液、缓冲液,并向细胞中加入JC-1染色工作液(0.5 mL)混匀,37 ℃孵育15 min后,离心,弃上清,用JC-1染色缓冲液冲洗,后加入JC-1染色缓冲液(500 μL)重悬,接种至24孔板(2.5×105个/孔),立即采用多功能酶标仪检测荧光强度。检测JC-1单体时(低膜电位下以单体形式存在)激发光设置为490 nm,发射光设置为530 nm,呈绿色荧光;检测JC-1聚合物时(高膜电位下以聚合物形式存在)激发光设置为530 nm,发射光设置为590 nm,呈红色荧光。MMP(%)=红色荧光强度/绿色荧光强度×100%。
1.2.8 免疫印迹法检测自噬、PINK1/Parkin通路相关蛋白表达情况 收集1.2.3各组培养48 h的H9C2细胞,以RIPA裂解并提取总蛋白,检测浓度及纯度,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜,放入脱脂奶粉(5%)溶液室温封闭2 h,分别加入一抗LC-3、p62、PINK1、Parkin及内参β-actin,均为1∶500的稀释比,4 ℃过夜,加入HRP标记山羊抗兔二抗(1∶1 000),室温孵育1 h,显影、定影,分析各蛋白含量。
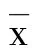
2 结 果
2.1 各组H9C2细胞增殖情况比较 与空白对照组比较,H/R组H9C2细胞增殖抑制率明显升高(P<0.05);与H/R组比较,右美托咪定低剂量组、中剂量组、高剂量组H9C2细胞增殖抑制率均明显降低(P<0.05),呈剂量依赖性。详见表1。

表1 各组H9C2细胞增殖抑制率比较(±s,n=6)
2.2 各组H9C2细胞氧化应激水平比较 与空白对照组比较,H/R组H9C2细胞SOD活性明显降低(P<0.05),MDA含量、ROS水平明显升高(P<0.05);与H/R组比较,右美托咪定低剂量组、中剂量组、高剂量组H9C2细胞SOD活性明显升高(P<0.05),MDA含量、ROS水平明显降低(P<0.05),呈剂量依赖性。详见表2。

表2 各组H9C2细胞氧化应激水平比较(±s,n=6)
2.3 透射电镜下观察线粒体自噬结果 与空白对照组比较,H/R组H9C2细胞自噬小体数量明显增多;与H/R组比较,右美托咪定低剂量组、中剂量组、高剂量组H9C2细胞自噬小体数量明显减少,呈剂量依赖性。详见图1。

图1 各组H9C2细胞线粒体自噬情况比较(标尺:2 μm,×8 000)
2.4 各组H9C2细胞MMP比较 JC-1法检测结果显示,与空白对照组比较,H/R组H9C2细胞MMP水平明显降低(P<0.05);与H/R组比较,右美托咪定低剂量组、中剂量组、高剂量组心肌H9C2细胞MMP水平明显升高(P<0.05),呈剂量依赖性。详见图2、表3。

图2 各组H9C2细胞JC-1染色(×200)

表3 各组H9C2细胞MMP 比较(±s,n=6) 单位:%
2.5 各组H9C2细胞自噬相关蛋白表达变化 与空白对照组比较,H/R组H9C2细胞LC3-Ⅱ/LC3-Ⅰ比值升高(P<0.05),p62蛋白表达明显降低(P<0.05);与H/R组比较,右美托咪定低剂量组、中剂量组、高剂量组心肌H9C2细胞LC3-Ⅱ/LC3-Ⅰ比值明显降低(P<0.05),p62蛋白表达明显升高(P<0.05),呈剂量依赖性。详见图3、表4。

图3 各组H9C2细胞自噬相关蛋白表达条带图

表4 各组H9C2细胞自噬相关蛋白表达水平比较(±s,n=6)
2.6 各组H9C2细胞PINK1/Parkin信号通路蛋白表达比较 与空白对照组比较,H/R组H9C2细胞PINK1、Parkin蛋白表达明显升高(P<0.05);与H/R组比较,右美托咪定低剂量组、中剂量组、高剂量组心肌H9C2细胞PINK1、Parkin蛋白表达明显降低(P<0.05),呈剂量依赖性。详见图4、表5。

图4 各组H9C2细胞PINK1、Parkin蛋白表达条带图

表5 各组H9C2细胞PINK1、Parkin蛋白表达比较(±s,n=6)
3 讨 论
缺血性心脏病是国际公认的公共健康问题之一,心肌缺血/再灌注是其主要治疗策略,然而缺血心肌在恢复血流灌注后极易引起缺血再灌注损伤,仍然是阻碍缺血性心脏病治疗的一大难题[10],因此,如何防治缺血再灌注损伤具有重要的现实意义。右美托咪定属于高选择性的α2肾上腺素能受体激动剂,是一种手术全身麻醉辅助药,有镇静、镇痛、抗炎及抗氧化作用[11]。心肌细胞缺氧使得心肌细胞膜受损,再复氧时产生大量氧自由基,使细胞内的抗氧化酶(如SOD)活性降低,导致ROS含量升高,引起脂质发生过氧化,破坏细胞结构,同时会生成大量MDA,导致细胞发生氧化应激从而损伤[12]。王茜等[13]研究显示,右美托咪定能够减轻缺血性心脏病病人体外循环瓣膜置换术中心肌缺血再灌注损伤。吴志林等[14]研究显示,右美托咪定能够抑制心肌缺血再灌注损伤模型大鼠心肌细胞氧化应激从而改善心肌缺血再灌注损伤。目前,有关右美托咪定对心肌细胞缺血再灌注损伤保护作用的机制尚未明确。研究表明,细胞氧化应激损伤在缺血再灌注诱导的线粒体自噬途径中发挥重要作用,且适度自噬可促进细胞存活,过度自噬可诱导细胞凋亡[15]。因此,本研究建立H/R条件下体外培养的心肌H9C2细胞损伤模型,用右美托咪定进行干预,结果显示,右美托咪定处理后,H/R引发的高增殖抑制率、MDA、ROS水平明显降低,而SOD水平明显升高,且呈一定剂量依赖性。说明右美托咪定可能促进H/R条件下H9C2细胞增殖,抑制细胞氧化应激,以缓解心肌损伤。
线粒体自噬是真核细胞通过自噬选择性地将受损线粒体降解的过程,此过程中,线粒体膜包裹细胞内需降解的多余或受损线粒体、蛋白质等成分形成自噬体,后者与溶酶体融合形成自噬溶酶体以降解自噬体中包裹的内容物实现代谢需要及线粒体更新,调控细胞存活与凋亡[16]。近年来,研究表明,线粒体自噬异常与缺血性心脏病关系密切[17]。卢长青等[18]体外研究显示,五味子乙素可能通过抑制心肌H9C2细胞线粒体自噬抑制细胞凋亡,进而保护小鼠心肌缺血再灌注损伤。线粒体产生能量时会将电化学势能储存于线粒体内膜形成MMP,当线粒体受损时MMP降低是诱发线粒体自噬的重要因素[19]。LC-3、p62是自噬体形成的标志性蛋白,研究显示自噬激活时LC-3可酶解部分多肽形成LC3-Ⅰ,后者与自噬泡表面磷脂乙酰醇胺结合形成LC3-Ⅱ,其含量多少可评价自噬强弱,而p62是自噬底物并可被LC3-Ⅱ降解,也用于评定自噬活性[20]。本研究结果显示,与空白对照组比较,H/R组H9C2细胞MMP水平、p62蛋白表达均显著降低,自噬小体数量、LC3-Ⅱ/LC3-Ⅰ比值明显升高,说明H/R条件下H9C2细胞线粒体自噬活性较大。当加入不同剂量右美托咪定处理后,H9C2细胞线粒体自噬体生成减少,线粒体自噬活性减弱,呈剂量依赖性。说明右美托咪定可能通过减弱H/R条件下H9C2细胞线粒体过度自噬保护细胞。
PINK1/Parkin通路是介导线粒体自噬的主要通路,PINK1是细胞线粒体外膜蛋白,正常情况下,其在外膜维持较低水平,当线粒体损伤时发生去极化,使PINK1大量聚集于线粒体外膜,并募集胞浆Parkin蛋白,促使Parkin蛋白转移到线粒体上被磷酸化激活,促进线粒体自噬[21]。李想[22]研究显示,栝楼薤白半夏汤能抑制PINK1/Parkin通路介导的线粒体自噬激活,从而保护缺血再灌注大鼠心脏。本研究结果显示,与空白对照组比较,H/R组H9C2细胞PINK1、Parkin蛋白表达明显升高,说明H/R条件下H9C2细胞PINK1/Parkin通路被激活。当加入不同剂量右美托咪定处理后,H9C2细胞PINK1/Parkin通路活化受抑制,且受抑制程度呈剂量依赖性。说明右美托咪定可能通过抑制PINK1/Parkin通路介导的H9C2细胞线粒体过度自噬,抑制细胞氧化应激损伤从而保护细胞。
综上所述,右美托咪定可能通过抑制PINK1/Parkin通路介导的线粒体过度自噬,抑制H/R条件下细胞氧化应激损伤以保护细胞。由于细胞实验具有一定局限性,后期将进一步开展动物实验验证H/R条件下右美托咪定对PINK1/Parkin通路介导的H9C2细胞线粒体自噬的影响,为临床治疗提供更可靠的依据。

