小鼠软脑膜淋巴管内皮细胞的发育特点及其对行为功能的影响
谭立人,肖颂华,雷 鸣
(中山大学孙逸仙纪念医院神经科,广东广州 510120)
软脑膜(leptomeningeal)是脑被膜最内一层,由结缔组织的胶质纤维和弹力纤维构成,由软脑膜形成的皱襞突入脑室形成脉络丛,分泌脑脊液。在过去的认知中,中枢神经系统并没有淋巴系统参与[1]。淋巴管内皮细胞(lymphatic endothelial cells,LEC)是构成淋巴管壁的主要结构,参与维持体液平衡、调节淋巴细胞再循环和机体免疫反应等生理过程[2]。颅内淋巴系统,近年来以硬脑膜淋巴管的研究居多。Gou 团队发现颅内基底侧硬脑膜淋巴管(meningeal lymphatic vessel,MLV)独特的解剖位置和形态特征,可以促进脑脊液(cerebral spinal fluid,CSF)的摄取和引流,揭示了颅底基底侧的MLV 在该过程中的重要性[3]。Wen[4]还发现在阿尔茨海默病的转基因小鼠模型中,诱导硬脑膜淋巴管生成可以促进可溶性淀粉样蛋白从脑中清除。而Kipnis 团队的一系列研究则表明,脑膜淋巴管有助于脑脊液成分的引流,并使免疫细胞以依赖于CCR7 的方式进入引流淋巴结[5-7]。相对的,谢毓峰等[8]发现回输T淋巴细胞后裸鼠的脑膜淋巴管有明显的增殖。与硬脑膜相比,作为最靠近脑实质的结缔组织,近来关于软脑膜淋巴系统的研究开始增加。多位学者[9-11]在斑马鱼的软脑膜中发现了一种与外周淋巴管共享发育程序和基因表达的细胞,被称为脑/壁淋巴内皮细胞或荧光颗粒周皮细胞(brain lymphatic endothelial cells(BLECs),mural LECs(muLECs),fluorescent granule perithelial cells(FGPs))。Jeong[12]通过使用荧光标的β 淀粉样蛋白1-42(β-Amyloid(1-42),Aβ1-42)的斑马鱼模型研究BLEC 在Aβ 清除中的作用。通过胶质与钙结合EGF 区域1 基因敲低造成遗传耗竭、通过甘露糖受体阻断吞噬或BLEC 的激光消融导致单体Aβ1-42的清除缺陷。而有学者[13]确定了哺乳动物软脑膜存在结构和功能相似的细胞类型,并将其命名为软脑膜淋巴内皮细胞(LLEC)。LLEC 表达多种淋巴内皮细胞标记物,并独立于脑膜巨噬细胞谱系发展。小鼠LLEC 还可内化脑脊液中的大分子,包括Aβ,这是阿尔茨海默病进展的毒性驱动因素之一。LLECs 与淋巴管和巨噬细胞共享分子、形态和功能特征,代表了一种新的、进化的保守细胞类型,在脑膜的稳态和免疫组织中具有潜在作用。在大脑发育早期,突触修剪起着非常大的作用,有助于形成功能性神经通路和维持突触平衡[14]。突触修剪异常则会导致神经系统病理性变化,比如精神分裂症患者的突触修剪增加[15]。突触修剪的过程会引起神经元的凋亡[16]并产生大分子废物如Caspase 3、6 和7 等蛋白酶[17],这些凋亡产物将被小胶质细胞识别吞噬[18]。LLEC 具有与巨噬细胞和小胶质细胞相似的吞噬能力。因此本研究希望通过观察LLEC 的时空分布规律以及中和抗体和小分子抑制剂清除LLEC 后对行为学的影响,研究这种具有吞噬功能的LLEC在小鼠神经系统发育的作用。
1 材料与方法
1.1 实验动物
实验采用C57BL/6 小鼠,购于广东省实验动物中心[许可证号:SYXK(粤)2018-0209],APP/PS1转基因小鼠购自南京大学南京生物医药研究院[许可证号:SCK(苏)2015-0001]。动物的使用协议和动物处理程序获得了中山大学实验动物管理与使用委员会(IACUC)的批准。动物被分笼饲养并能够自由获取标准啮齿动物食物和水,室温保持在(25±1)℃,湿度保持在50%~60%,并处于12 h 白天-黑夜循环照明的环境。所有的动物被随机分配到不同的处理组。
1.2 中和抗体anti-Lyve-1
Lyve-1 是淋巴管内皮透明质酸受体1,是淋巴管内皮的相对特异性标志物[11]。Lyve-1 可以摄取和运输透明质酸并在淋巴管、肝和脾窦的内皮细胞中分解代谢[19]。中和抗体注射组(anti 组)侧脑室注射Goat anti-Lyve-1 中和抗体(AF2125;200 mg/L;goat;R&D)。
1.3 小分子抑制剂SAR131675
血管内皮生长因子(VEGF)是一种促血管生成活性的生长因子[20]。VEGF 与酪氨酸激酶细胞受体(VEGFR)结合[21]。其中,VEGFR-1 和VEGFR-2主要在血管内皮细胞上表达[22-23],而VEGFR-3 主要在淋巴管内皮细胞上表达[24-25]。SAR131675是一种有效的选择性VEGFR-3抑制剂[26]。SAR131675 可以剂量依赖性地抑制VEGFC 和VEGFD 诱导的原代人淋巴细胞增殖,并表现出抗淋巴管生成作用[27-29]。小分子抑制剂注射组(sar组)侧脑室注射SAR131675 PBS 溶液(S2842;1µmol/L;Selleck)。
1.4 脑立体定位注射
用石蜡油排空玻璃电极与微量注射器内空气,将微量注射器针头从后端插入玻璃电极至针尖,并用胶水固定,吸取PBS、中和抗体或小分子抑制剂,固定于注射架。小鼠按0.2 mL/10 g 体质量腹腔注射阿佛丁(Avertin;含12.5 g/L 三溴乙醇,2.5%叔戊醇)麻醉。备皮后固定于立体定位仪(RWD 68025)上,切开皮肤,消毒切口。将前后囟调至X 轴,Z 轴坐标相同。将前囟设为坐标原点,注射坐标为前囟后0.58 mm,中线旁开1.00 mm,颅骨下2.00 mm[30]。颅骨钻(RWD,78001)钻出直径1.00 mm 的孔,针尖挑开硬脑膜,清理骨屑与脑脊液。缓慢进针,5 min内注射2 µL 对应注射溶液。停留5 min 待注射液扩散,缓慢出针防止溢出。骨蜡封孔,缝合切口后消毒。术后给予含抗生素饮水(含头孢呋辛酯0.5 g/L,磺胺甲恶唑2 g/L,奥美拉唑10 mg/L,蔗糖10 g/L)。
1.5 免疫荧光实验
小鼠麻醉后,心内灌注生理盐水20 mL与40 g/L多聚甲醛20 mL。取出鼠脑,多聚甲醛后固定,15%、20%、30%蔗糖溶液(0.1 mol/L PB 溶液)梯度脱水。按40 µm 厚度冰冻切片(LEICA CM1900),保存于4 ℃冻存液(乙二醇与0.01 mol/L PBS 溶液等体积混合)。PBS 溶液清洗后进行贴片法染色。封闭液(10% Donkey serum,0.3% TritonX-100,in 0.01 mol/L PBS)37 ℃湿盒封闭30 min 后加入对应的一抗,分别为anti-Lyve-1(AF2125;5 µg/mL;goat;R&D),anti-CD68(MCA1957;1:400;rat;Bio-Rad),anti-Aβ1-42(A5213;1:400;mouse;Sigma-Aldrich),37 ℃孵育2 h,转4 ℃孵育10 h。清洗后加入对应的二抗,分别为Donkey anti-goat Alexa Fluor 488(A-11055;1:2 000;Invitrogen),Donkey anti-rat Alexa Fluor 594(A-21209;1:2 000;Invitrogen),Donkey anti-mouse Alexa Fluor 647(A-31571;1:2 000;Invitrogen),Hochest(H33258;1:2 000;Invitrogen),37 ℃湿盒避光孵育2 h,清洗后室温避光风干。抗荧光衰减封片剂(S200,Solarbio)缓慢封片。晾干后避光保存于-20 ℃。于全自动正置荧光显微镜(DM6B,Leica,Germany)和激光扫描共聚焦显微镜(LSM 780,Zeiss,Germany)下进行观察拍照。半定量分析使用Image J 软件计算软脑膜区域Lyve-1+细胞比例。
1.6 行为学检测
行为学实验在9:00~18:00 进行,照明强度在650 lux 左右。每轮实验后用75% 的酒精擦拭装置。使用SuperMaze 软件(上海欣软信息技术有限公司)记录小鼠的活动。
1.6.1 旷场实验(open-field test,OFT)将小鼠放入50 cm×50 cm×50 cm 的不透明白色敞箱内,旷场区域划分为25格,中央9格定义为中央区。记录10 min内小鼠的活动,包括:水平运动总路程,中央区进入频次,中央区时间,中央区路程。
1.6.2 三箱社交实验(social interaction test,SIT)装置由3个19 cm×45 cm 矩形箱子组成,分隔板为透明树脂玻璃,中间有通道相通,在两侧箱子各放1 个规格一致的金属笼子,用来容纳小鼠。金属笼周围3 cm~5 cm 定义为接触范围,第一阶段:①测试小鼠(subject mice)于行为测试室适应0.5 h;②隔开三个箱子,小鼠于中间箱子适应5 min;③陌生小鼠1(stranger 1)随机放进其中一个笼子里,另一笼子空置;④去掉隔板,观察10 min 内与stranger 1 相互接触的时间和次数。第二阶段:第一阶段空笼中放入陌生小鼠2(stranger 2),然后记录10 min 内与stranger 1 和stranger 2 之间相互接触的时间和次数。时间因数(index of time)为stranger2接近时间与stranger1,2 接近时间之和的比值。路程因数(index of distance)为stranger2 接近路程与stranger1,2 接近路程之和的比值。频次因数(index of frequency)为stranger2 接近频次与stranger1,2 接近频次之和的比值。时间因数(index of time)为novel 接近时间与novel,steady 接近时间之和的比值。路程因数(index of distance)为novel 接近路程与novel,steady 接近路程之和的比值。
1.6.3 新物体识别实验(novel object recognition test,NOR)旷场放置三物体,其中不变物体(steady)a,相似物体(familiar)b 完全一样,新物体(novel)c与a、b完全不同。①小鼠于饲养笼中适应5~7 d;②测试3 d 前,每天抚摸小鼠1 min;③测试前24 h,小鼠置于测试房间适应测试环境;④第一阶段,小鼠面向旷场壁放入场地内适应场地5 min;⑤第二阶段,将a、b 两物体置于旷场两个对角区域,小鼠背朝物体面向旷场壁放入场地,记录5 min内与这两个物体接触的频次,时间,路程;⑥将小鼠放回原来饲养的鼠盒内休息1 h;⑦第三阶段,将场地内的物体a或b换作物体c,重复⑤步骤。
1.7 统计学分析
通过graphpad prism 6.0 软件进行统计学分析,实验结果以均数±标准误(means±SEM)表示。Shapiro-Wilk 检验数据是否符合正态分布,P>0.05 被认为符合正态分布。二组计量资料的均数比较,若资料满足正态分布并且方差齐性,组间比较采用t检验,反之用秩和检验;不符合正态分布的数据采用非参数检验。多组数据组采用单因素方差分析(one-way ANOVA),有统计学意义时采用Tukey 法进行两两比较。P<0.05被认为差异有统计学意义。
2 结果
2.1 软脑膜淋巴内皮细胞在不同区域的分布
免疫荧光染色检测2 周龄野生型小鼠背侧,颞侧,腹侧及侧脑室(图1 A)内软脑膜Lyve-1+和CD68+细胞占比,ANOVA检验结果显示差异无统计学意义(F=0.870 0,P=0.466 8,df=3;图1B-F),说明LLEC在不同区域分布的差异无统计学意义。
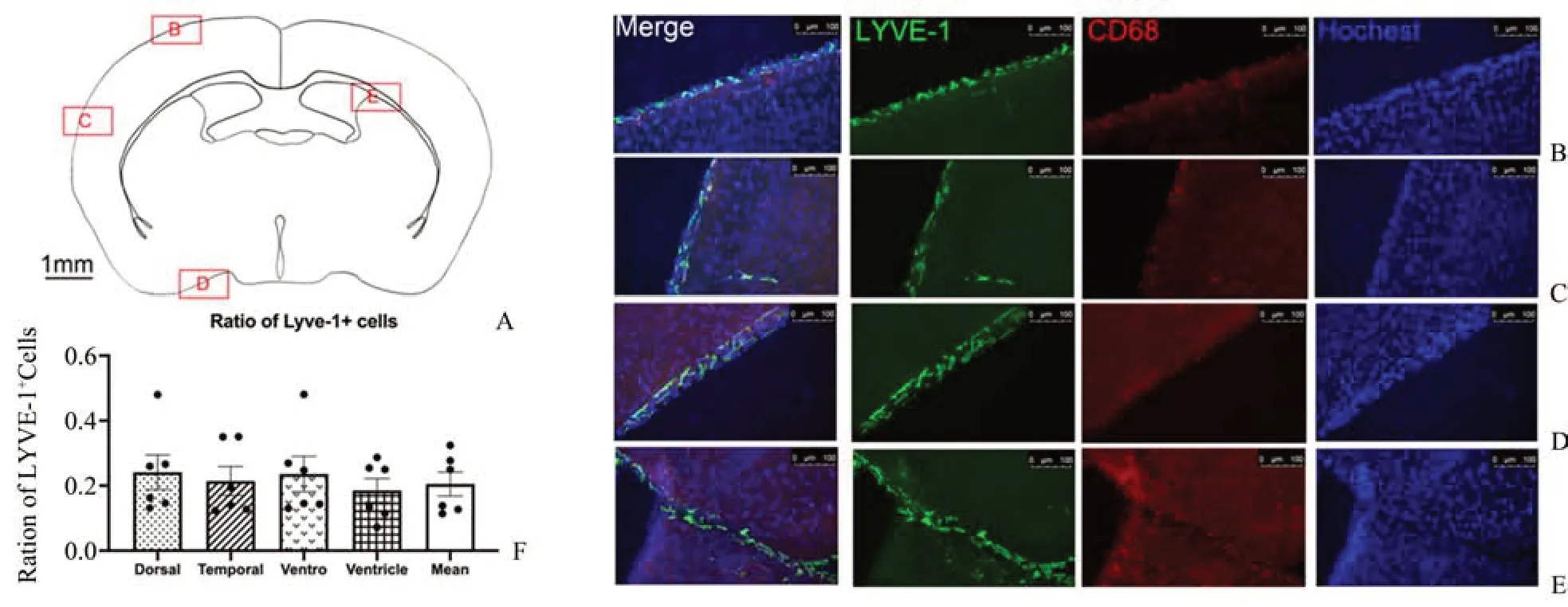
图1 免疫荧光法检测不同区域软脑膜内Lyve-1+和CD68+细胞数量Fig.1 Quantity of Lyve-1+and CD68+cells in the leptomeningeal in different area by immunofluorescence
2.2 软脑膜淋巴内皮细胞在不同年龄小鼠的分布
免疫荧光法检测不同年龄小鼠软脑膜内Lyve-1+细胞占比,单因素ANOVA 检验结果显示差异具有统计学意义(F=17.30,P<0.000 1,df=5)。事后两两比较发现(图2G),1周龄野生型小鼠软脑膜内Lyve-1+细胞占比大于4 周(q=5.818,P=0.007 3),10 周(q=9.596,P<0.000 1),15 周(q=10.03,P<0.000 1)和15 月龄小鼠(q=10.32,P<0.000 1),2 周龄野生型小鼠软脑膜内Lyve-1+细胞占比大于10 周(q=5.775,P=0.007 7),15 周(q=6.212,P=0.004 0),15月龄小鼠(q=6.497,P=0.002 6),4周龄野生型小鼠软脑膜内Lyve-1+细胞占比大于10月龄小鼠(q=4.500,P=0.049 6),说明LLEC 在不同年龄小鼠分布的差异具有统计学差异。免疫荧光法检测不同年龄小鼠软脑膜Lyve-1+和CD68+细胞占Lyve-1+细胞比例(图2H),单因素ANOVA 检验结果显示差异无统计学意义(F=0.268 6,P=0.924 4,df=5)。

图2 免疫荧光法检测不同年龄软脑膜内Lyve-1+和CD68+细胞数量Fig.2 Quantity of Lyve-1+and CD68+cells in the leptomeningeal in mice of different ages by immunofluorescence
2.3 软脑膜淋巴内皮细胞比例在野生型与APP/PS1转基因小鼠的差异
免疫荧光法检测15 周龄野生型与APP/PS1 小鼠软脑膜内Lyve-1+细胞占比(图3B-C),结果显示差异具有统计学意义,15 周龄野生型小鼠软脑膜Lyve-1+细胞占比高于同年龄APP/PS1 小鼠(t=6.381,P=0.007 8;图3D)。白色箭头所指处为Lyve-1与Aβ共定位的细胞。

图3 免疫荧光法检测小鼠软脑膜内Lyve-1+和CD68+细胞数量Fig.3 Quantity of Lyve-1+and CD68+cells in the leptomeningeal by immunofluorescence
2.4 注射小鼠软脑膜淋巴内皮细胞比例变化
免疫荧光法检测对照组,anti 组,sar 组小鼠软脑膜内Lyve-1+细胞占比(图4 B-D),ANOVA 检测结果显示组间差异具有统计学意义(F=19,P<0.000 1,df=2;图4 A),事后比较显示,anti 组小鼠软脑膜Lyve-1+细胞占比低于PBS 注射组,差异具有统计学意义(MPBS=0.451 3,Manti-Lyve-1=0.269 2,q=8.726,P<0.000 1;图4 A),sar组小鼠软脑膜Lyve-1+细胞占比低于PBS 注射组,差异具有统计学意义(MSAR131675=0.323,q=5.588,P=0.000 6;图4 A)。

图4 免疫荧光法检测小鼠软脑膜内Lyve-1+细胞数量Fig.4 Quantity of Lyve-1+cells in the leptomeningeal in mice by immunofluorescence
2.5 注射小鼠在旷场实验行为学变化
为检测造模完成后小鼠自发性探索运动活性,对照组,anti 组,sar 组小鼠进行旷场实验(图5 BD)。ANOVA 检测显示总运动距离的组间差异具有统计学意义(F=3.535,P=0.045 8,df=2;图5 E)。两两比较结果显示,sar 组小鼠总运动距离小于对照组,差异具有统计学意义(MPBS=79 603,MSAR131675=35 411,q=3.736,P=0.037 4;图5 E)。结果显示平均运动速度的组间差异具有统计学意义(F=8.032,P=0.002 3,df=2;图5 F)。事后比较结果显示,sar 组小鼠平均运动速度小于对照组,差异具有统计学意义(MPBS=145.8,MSAR131675=59.45,q=5.651,P=0.001 6;图5 F)。结果显示中央区域运动距离比例的组间差异具有统计学意义(F=8.115,P=0.002 2,df=2;图5 H)。事后比较结果显示,anti 组小鼠中央区域运动距离比例大于对照组,差异具有统计学意义(MPBS=0.203 2,Manti-Lyve-1=0.250 6,q=4.311,P=0.015 2;图5 H)。sar 组小鼠中央区域运动距离比例大于对照组,差异具有统计学意义(MSAR131675=0.265,q=5.246,P=0.003 2;图5 H)。结果显示进入中央区域频次的组间差异无统计学意义(F=1.436,P=0.258 5,df=2;图5 G)。中央区域运动时间比例的组间差异无统计学意义(F=1.968,P=0.162 6,df=2;图5 I)。

图5 对照组,中和抗体注射组与小分子抑制剂注射组小鼠旷场实验的行为学变化Fig.5 Behavioral changes of PBS,anti-Lyve-1 and SAR131675-injected mice in the OFT
2.6 注射小鼠在三箱社交实验行为学变化
为检测造模完成后小鼠研究社交行为的变化,对照组,anti 组与sar 组小鼠进行三箱社交实验(图6 A-F)。
在接近频次方面(图6 G-I),方差分析显示,第一阶段组间差异具有统计学意义(F=4.454,P=0.023 2,df=2;图6 G),事后两两比较结果显示,sar组对stranger1的接近频次小于对照组,差异具有统计学意义(MSAR131675=14.86,MPBS=20.10,q=2.778,P=0.023 5)。第一阶段组内差异具有统计学意义(F=25.2,P<0.000 1,df=23;图6 G),事后两两比较结果显示,对照组对stranger1 的接近频次大于对Empty 的接近频次,(Mstranger1=20.10,MEmpty=12.40,q=4.033,P=0.001 6)。anti 组对stranger1 的接近频次大于对Empty 的接近频次,差异具有统计学意义(Mstranger1=18.67,MEmpty=12.22,q=3.202,P=0.011 8)。
第二阶段组间差异具有统计学意义(F=5.336,P=0.012 5,df=2;图6 H),事后比较结果显示,sar 组对stranger1 的接近频次小于对照组,(MSAR131675=8.143,MPBS=14.60,q=3.657,P=0.034 0)。第二阶段组内差异无统计学意义(F=0.066 1,P=0.799 4,df=23;图6 H)。频次因数方差分析结果显示,组间差异无统计学意义(F=0.4,P=0.654 7,df=2;图6 I)。
在接近时间方面(图6 J-L),方差分析显示,第一阶段组间差异无统计学意义(F=2.414,P=0.111 8,df=2;图6 J)。第一阶段组内差异具有统计学意义(F=19.24,P=0.000 2,df=23;图6 J),事后比较结果显示,anti 组对stranger1 的接近时间大于对Empty 的接近时间,差异具有统计学意义(Mstranger1=0.289 8,MEmpty=0.157 7,q=4.081,P=0.001 4)。第二阶段组间差异无统计学意义(F=1.434,P=0.258 9,df=2;图6 K)。第二阶段组内差异无统计学意义(F=1.465,P=0.238 5,df=23;图6 K)。时间因数方差分析结果显示,组间差异无统计学意义(F=0.4,P=0.633 6,df=2;图6 L)。
在接近路程方面(图6M-O),方差分析显示,第一阶段组间差异无统计学意义(F=0.156 3,P=0.856 2,df=2;图6M)。第一阶段组内差异具有统计学意义(F=16.34,P=0.000 5,df=23;图6 M),事后比较结果显示,对照组对stranger1的接近时间大于对Empty 的接近时间,差异具有统计学意义(Mstranger1=0.180 3,MEmpty=0.120 9,q=3.363,P=0.0080)。第二阶段组间差异无统计学意义(F=0.398 0,P=0.676 2,df=2;图6 N)。第二阶段组内差异无统计学意义(F=0.179 8,P=0.675 5,df=23;图6 N)。路程因数方差分析结果显示,组间差异无统计学意义(F=1.112,P=0.356 2,df=2;图6O)。

图6 对照组,中和抗体注射组与小分子抑制剂注射组小鼠社交实验的行为学变化Fig.6 Behavioral changes of PBS,anti-Lyve-1 and SAR131675-injected mice in SIT
2.7 注射小鼠在新物体识别实验行为学变化
为检测注射完成后小鼠学习记忆的变化,对照组,anti 组与sar 组小鼠进行新物体识别实验实验(图7A-F)。在总路程方面(图7G),方差分析显示,组间差异具有统计学意义(F=9.239,P=0.001 9,df=2;图7G),事后比较结果显示,sar 组第二阶段运动总路程小于对照组(MSAR131675=11 208,MPBS=34 541,q=3.931,P=0.001 2)。sar 组第二阶段运动总路程小于anti 组(Manti-Lyve-1=17 020,q=2.755,P=0.027 8)。sar 组第三阶段运动总路程小于对照组,(MSAR131675=4 610,MPBS=22 765,q=3.059,P=0.012 9)。sar 组第三阶段运动总路程小于anti组(Manti-Lyve-1=20 957,q=2.646,P=0.036 3)。组内差异具有统计学意义(F=11.10,P=0.004 0,df=23;图7 G),事后两两比较结果显示,对照组对第三阶段的运动路程小于第二阶段(MSession3=22 765,MSession2=34 541,q=2.722,P=0.042 8)。
在接近频次方面(图7 H-J),方差分析显示,第二阶段组间差异无统计学意义(F=0.570 8,P=0.575 5,df=2;图7 H),组内差异无统计学意义(F=1.51,P=0.575 5,df=23;图7H)。第三阶段组间差异无统计学意义(F=0.611 8,P=0.553 9,df=2;图7I),组内差异无统计学意义(F=3.121,P=0.095 2,df=23;图7 I)。频次因数方差分析结果显示,组间差异无统计学意义(F=1.300,P=0.3114,df=2;图7 J)。
在接近时间方面(图7K-M),方差分析显示,第二阶段组间差异具有统计学意义(F=6.148,P=0.009 8,df=2;图7K)。事后比较结果发现,sar 组对steady 的接近时间小于对照组(MSAR131675=0.061 84,MPBS=0.235 8,q=5.624,P=0.001 0)。sar组对familiar 的接近时间小于对照组(MSAR131675=0.113 0,MPBS=0.221 3,q=3.504,P=0.047 0)。sar组对steady 的接近时间小于anti 组(Manti-Lyve-1=0.202 9,q=4.382,P=0.010 6)。第二阶段组内差异无统计学意义(F=0.526 1,P=0.478 1,df=23;图7 K)。第三阶段组间差异具有统计学意义(F=8.554,P=0.002 7,df=2;图7L)。事后比较结果发现,sar 组对steady 的接近时间小于对照组(MSAR131675=0.024 17,MPBS=0.171 2,q=5.285,P=0.001 9)。sar组对novel 的接近时间小于对照组(MSAR131675=0.056 6,MPBS=0.174 6,q=4.243,P=0.013 6)。sar组对steady 的接近时间小于anti 组(Manti-Lyve-1=0.189 9,q=5.721,P=0.000 8)。sar 组对novel 的接近时间小于anti 组(Manti-Lyve-1=0.168 5,q=3.865,P=0.026 1)。第三阶段组内差异无统计学意义(F=0.217 2,P=0.64 71,df=23;图7L)。时间因数方差分析结果显示,组间差异无统计学意义(F=0.320 1,P=0.732 6,df=2;图7 M)。
在接近路程方面(图7N-P),方差分析显示,第二阶段组间差异具有统计学意义(F=20.15,P<0.000 1,df=2;图7N)。事后比较结果发现,sar 组对steady 的接近路程大于对照组(MSAR131675=0.210 2,MPBS=0.0373 0,q=4.632,P=0.006 7)。sar组对familiar 的接近路程大于对照组(MSAR131675=0.338 6,MPBS=0.038 2,q=8.050,P<0.000 1)。sar组对steady 的接近路程大于anti 组(Manti-Lyve-1=0.072 8,q=3.536,P=0.044 7)。sar 组对familiar 的接近路程大于anti 组(Manti-Lyve-1=0.065 7,q=7.027,P<0.000 1)。组内差异无统计学意义(F=2.013,P=0.174 0,df=23;图3~7 N)。第三阶段组间差具有无统计学意义(F=5.455,P=0.014 8,df=2;图7O),两两比较结果发现差异无统计学意义(steady:PPBSvs.anti-Lyve-1=0.957 2;PPBSvs.SAR131675=0.187 7;Pan-ti-Lyve-1vs.SAR131675=0.3327;novel:PPBSvs.anti-Lyve-1=0.965 6;PPBSvs.SAR131675=0.056 6;Panti-Lyve-1vs.SAR131675=0.116 2)。第三阶段组内差异无统计学意义(F=0.158 1,P=0.695 9,df=23;图7O)。路程因数方差分析结果显示,组间差异无统计学意义(F=0.022 9,P=0.977 3,df=2;图7P)。

图7 对照组,中和抗体注射组与小分子抑制剂注射组小鼠新物体识别实验的行为学变化Fig.7 Behavioral changes of PBS,anti-Lyve-1 and SAR131675-injected mice in NOR tests
3 讨论
3.1 主要发现
在本研究中,我们发现LLEC 在空间上不同区域无分布差异;在时间上随年龄增大减少。LLEC的时空分布与硬脑膜淋巴管的空间时间分布不同。研究发现,硬脑膜淋巴管在空间上是沿动静脉管状分布,基底侧硬脑膜淋巴管有淋巴瓣且细胞连接疏松,促进脑脊液摄取,而背侧硬不具有淋巴瓣且连接紧密,有利于淋巴液运输[3]。硬脑膜淋巴管自出生后自颅底孔洞多起点开始沿着动静脉与神经生长,直至3~4周汇合且稳定存在[31]。
结合LLEC在空间上的均匀分布和时间上随年龄增大减少以及之前基于斑马鱼与小鼠的研究结果[9-13]分析,LLEC 在早期生长发育和神经系统大分子物质清除方面发挥重要作用,而且这种分布可能遍布整个软脑膜[13]。本研究还发现了CD68 在LLEC 内表达,具体表现为不同年龄小鼠软脑膜CD68+细胞占Lyve-1+细胞比例高且稳定。这与之前关于LLEC 对于淀粉样蛋白的吞噬的结果相吻合[12-13]。CD68 是溶酶体相关的颗粒蛋白[32],说明LLEC 可能存在溶酶体颗粒系统支持吞噬活动。我们在野生型与APP/PS1 转基因小鼠的软脑膜中均能发现LLEC 与Aβ 共定位的现象,表明生理与病理状态中,LLEC 均能发挥对大分子物质的吞噬。此外,15 周龄野生型小鼠软脑膜Lyve-1+细胞占比高于同年龄APP/PS1 小鼠。这提示在15 周APP/PS1 小鼠LLEC 可能存在吞噬缺陷。这种缺陷状态与阿尔茨海默病病理改变的潜在联系值得深入探讨。目前与阿尔茨海默病相关的研究主要集中在斑马鱼和小鼠上,将淀粉样蛋白作为LLEC 吞噬功能的指示物。在斑马鱼上,Jeong 等[12]的研究通过使用荧光标记的Aβ1-42观察斑马鱼模型中BLEC 在Aβ 清除中的作用,发现ccbe1基因敲低造成遗传耗竭、Mrc1a 阻断吞噬或BLEC 的激光消融则会导致Aβ1-42的清除缺陷。在小鼠上,有学者[13]发现LLEC可以内化荧光标记Aβ 且内化作用比巨噬细胞强。这些证据表明,小鼠LLEC对脑脊液中大分子物质,尤其是Aβ 吞噬可能是一个重要的研究课题,有待进一步研究证实。
本研究进一步通过侧脑室注射中和抗体anti-Lyve-1 或小分子抑制剂SAR131675 清除或抑制LLEC,并通过行为学差异探究LLEC 缺失对于小鼠的影响。免疫荧光法结果表明注射中和抗体anti-Lyve-1 和小分子抑制剂SAR131675 成功抑制LLEC。旷场实验和三箱社交实验结果说明小分子抑制剂注射小鼠存在社交行为的降低。新物体识别实验中,中和抗体注射小鼠在接触频次,时间与路程上与对照组相比没有变化,说明中和抗体注射小鼠在新物体识别实验中没有表现出短期记忆能力的变化。从接近时间和接近距离的结果可解释为:小鼠在进行速度较快的物体识别行为,以及在非识别区域停留较长。接近时间为新物体识别的主要观察指标,因此本实验说明小分子抑制剂注射小鼠在新物体识别实验中表现出短期记忆能力的下降。这些行为学变化提示sar组小鼠可能产生自闭样症状[33]。现已知自闭样谱系疾病与小胶质细胞吞噬相关的突触修剪相关[34],同样具有吞噬功能的LLEC是否能影响突触修剪也是值得探索的一个问题。而同样LLEC的中和抗体却没有引起小鼠明显的行为学的变化,猜测可能原因为行为学变化是由LLEC数量水平和功能水平两方面同时影响的。
综合上述关于淋巴内皮细胞时空分布的结果,与CD68溶酶体颗粒蛋白的相关性以及病理中的缺陷状态,可以做进一步推断,LLEC 的正常发育与吞噬功能在小鼠早期行为功能中起着重要作用,这种作用很可能与其对大分子物质发达的吞噬作用相关。
3.2 研究不足
本研究进一步通过对比对照组、anti组和sar组小鼠行为学实验中的差异来探究LLEC缺失对于小鼠行为功能的影响。结果显示行为学差异较小且不全面,仅表现在少数功能实验的少数参数上,如探索能力与社交行为减少等。这说明本实验行为学部分仍需改进,更多行为学上的差异需要进一步增加样本量与行为学实验类型来加强验证。
3.3 结论
本研究结果阐明小鼠LLEC的空间时间分布规律及其对小鼠行为功能的影响。扩展了对LLEC的认知,丰富了中枢神经系统内淋巴管系统的内容,为日后研究中枢神经系统淋巴管引流代谢提供了新的思路,也为研究代谢性,退行性和免疫性脑病增加研究节点。
致谢:感谢中山大学中山医学院姚志彬教授课题组对本研究实验工作的指导。
——淋巴管系统

