E2F转录因子2对多发性骨髓瘤细胞粘附的影响
麦芷莹,陈淑娜,张幸鼎,赵文婧,郑永江
(1.中山大学医学院,广东深圳 518107;2.中山大学附属第三医院血液内科,广东广州 510630)
多发性骨髓瘤(multiple myeloma,MM)是一种恶性浆细胞克隆引起的血液疾病,多发于老年人[1]。2020 年最新的全球癌症数据显示,多发性骨髓瘤新增病例176 404 人,死亡病例117 077 人[2]。我国2020 年最新公布的多发性骨髓瘤权威诊治指南《中国多发性骨髓瘤诊治指南(2020 年修订)》中指出,多发性骨髓瘤已经超过急性白血病,成为血液系统恶性肿瘤中第二高发的疾病[3]。随着社会人口老龄化的发展,多发性骨髓瘤的发病率可能仍会进一步增加。目前,在临床上多发性骨髓瘤的治疗主要以化疗为主。MM 患者的5 年生存率约为50%,尤其在高危细胞遗传学患者和体弱的老年患者中生存率可能更低[4]。尽管近几年出现了许多新药和新的治疗手段如CAR-T 治疗等,但仍有相当一部分患者对当前疗法没有反应或反应持续时间很短,目前仍无法完全治愈该疾病[5]。E2F 家族转录因子是细胞周期调控网络中的重要环节之一,调控细胞的增殖、分化和凋亡,并参与多种生理和病理过程。目前已经发现E2F 家族有8 个成员,即E2F1-E2F8。作为E2F 家族中的转录激活因子,E2F1、E2F2和E2F3a都含有一个细胞周期蛋白结合域,可以与视网膜母细胞瘤易感基因(retinoblastoma gene,pRB)结合,参与调控细胞周期的S 期。另一方面,E2F3b和E2F4-E2F8是E2F 家族中的转录抑制因子,发挥着抑制细胞周期循环中转录调控的作用[6]。有文献报道,E2F2含有一个细胞周期蛋白结合域,可与pRB 结合,pRB-E2F 信号通路在肿瘤中发挥了多种作用,包括调节血管内皮生长因子(vascular endothelial growth factor,VEGF)介导的血管生成通路,调节上皮间质转化(epithelial mesenchymal transition,EMT)通路,还可以调节肿瘤细胞的侵袭与转移[7]。但是目前尚未有相关研究报道E2F2与骨髓瘤之间的关系,具体的调控机制也仍不清楚。正常情况下,健康组织中的稳态强烈依赖于细胞与细胞间的粘附和细胞与细胞外基质间的粘附。许多研究表明,癌症的两大重要标志分别是细胞间粘附功能的丧失和锚定不依赖性生长,而这两大标志均与细胞粘附分子(cell adhesion molecule,CAM)相关[8]。细胞粘附分子,根据其不同的结构特点可分为四大类:钙粘蛋白(cadherins)、整联蛋白(integrins)、选择蛋白(selectins)和免疫球蛋白(immunoglobulins)[9]。已有文献表明,MM 细胞与骨髓微环境之间有着密切的相互作用,而骨髓微环境中包含了纤连蛋白、层粘连蛋白、胶原蛋白和多种细胞外基质成分,因此细胞粘附在MM 进展中起着重要作用[10]。针对细胞粘附分子的治疗成为多发性骨髓瘤新的靶向治疗方向,而E2F2是否能调节骨髓瘤细胞粘附还未有报道,这也是本文探讨的重点。
在本文中我们旨在探讨E2F2对骨髓瘤细胞粘附的影响及其临床意义,为骨髓瘤的临床治疗提供科学理论基础。
1 材料与方法
1.1 细胞系和主要试剂
骨髓瘤细胞系MM.1S 和HEK293T 细胞系(购自ATCC 细胞库);RPMI 1640培养基和胎牛血清购自美国Gibaco 公司,Phosphate-Buffered Saline(PBS,1x)购自美国康宁公司,UltraPure Distilled Water 购自美国Invitrogen 公司,细胞粘附试剂盒购自广州华韵公司,总RNA 提取试剂盒、通用型qPCR 专用预混液、逆转录试剂盒购自南京诺唯赞公司,PCR 引物购自生工生物工程股份有限公司(广州),Lipofectamine 3000、BshT1、EcoRⅠ限制性内切酶购自赛默飞世尔中国公司,DH5α、Stbl3 感受态购自北京全式金公司,BCA试剂盒和一抗稀释液购自上海碧云天公司,蛋白酶抑制剂购自Roche 公司,电化学发光(electrochemiluminescence,ECL)试剂盒购自苏州新赛美公司。E2F2 兔多克隆抗体(ab235837)购自美国Abcam 公司,HSP90 鼠单克隆抗体(3F11C1)购自Proteintech 公司(武汉),山羊抗兔二抗(7074S)、马抗鼠二抗(7076S)均购自美国CST公司,人淋巴细胞分离液(Ficoll)购自上海优宁维公司,分选LD 柱购自广州鲁诚公司,MACSprep多发性骨髓瘤CD138磁珠购自广州初晨公司。
1.2 分离多发性骨髓瘤患者骨髓标本的CD138+/CD138-细胞
所有骨髓瘤患者骨髓样本均得到中山大学附属第三医院伦理委员会批准,并且获得了患者的知情书面同意。收集临床初治多发性骨髓瘤患者的骨髓标本,1 734×g4 ℃离心10 min,这一阶段为分离血浆和血细胞。使用等体积的1×PBS 缓冲液稀释血细胞,将细胞悬液缓慢注入到含有人淋巴细胞分离液(Ficoll)的离心管内,以624×g离心30 min,吸取中间的乳白色云雾状单核细胞层。加入适量的5 g/L牛血清白蛋白(bovine serum albumin,BSA)溶液漂洗,以624×g离心10 min,弃上清。加入500µL 5 g/L BSA 溶液重悬细胞,加入20µL CD138微磁珠,混匀,室温避光孵育15 min。加入1 mL 5 g/L BSA 溶液润洗分选柱,将孵育后的细胞悬液转移到预处理后的分选柱上,收集未标记的细胞,即CD138-细胞。卸下分选柱,置于收集管上,加入1 mL 5 g/L BSA 溶液,收集磁珠标记细胞,即CD138+细胞。
1.3 细胞转染
收集MM.1S 细胞,193×g离心5 min,用opti-MEM 培养基洗涤2 次,以1×106个/管的细胞数量分装备用。配制25µL 的电转体系,8µL siRNA 和17µL opti-MEM 混匀后重悬细胞,缓慢加进电转杯中,电转程序为120 V,20 ms。电转结束后,将电转杯内的细胞悬液吸出,接种于六孔细胞培养板中,培养24~48 h 后进行后续实验。siRNA 序列详见表1。
1.4 RNA-seq数据处理和基因富集分析
采用R 语言的edgeR 包对RNA-seq 数据进行差异表达分析,差异基因的阈值设为log2(fold change)>1,P<0.05。利用R 语言的phyper 函数对共同差异基因进行GO(Gene Ontology,GO)功能分析和KEGG(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析,阈值设为P<0.05,计算P value,然后对Pvalue 进行FDR 校正得到Qvalue,Qvalue ≤0.05 的功能视为显著富集。将共同差异基因导入string(https://string-db.org)在线分析网站进行蛋白质互作网络分析(Protein-Protein Interaction,PPI),将所得结果导入Cytoscape 软件进一步分析,并筛选出Degree排名前10的关键基因。
1.5 E2F2慢病毒构建
用BshT1 和EcoR Ⅰ两种限制性内切酶对PLKO.1 载体进行双酶切,37 ℃水浴4 h,将酶切好的PLKO.1 载体与磷酸化后的正反向引物通过T4 DNA ligase 连接酶进行连接,16 ℃过夜。将连接产物转化至Stbl3 大肠杆菌感受态细胞中,涂布于含氨苄青霉素抗性的LB 琼脂糖平板上,37 ℃孵育过夜后挑取单克隆菌落,经DNA 测序确定与Genebank 中E2F2基因的敲低序列E2F2-shRNA1 和E2F2-shRNA2 完全匹配,将序列比对正确的菌液进行扩增培养并提取质粒。将所提取的质粒与慢病毒包装质粒PMD2G/PSPAX2 用Lipofectamine 3000 共转染至HEK293T 工具细胞中,培养48 h 后收集慢病毒上清,用0.45µm 过滤器对所收集的上清液进行过滤处理,得到的即为所需慢病毒上清,保存于-80 ℃,用于后续实验。
以5×105个/孔的细胞数量接种MM.1S 细胞,分别用对照组慢病毒NC-shRNA,实验组慢病毒E2F2-shRNA1、E2F2-shRNA2 感染MM.1S 10 h 后,换成新鲜的含有10 g/L 胎牛血清的RPMI 1640 培养基培养24 h,使用2µg/mL 的嘌呤霉素培养可筛选出稳定转染的细胞株,筛选48~72 h 后,换成新鲜的含有10 g/L 胎牛血清的RPMI 1640 培养基继续培养。经过Western Blot 和qRT-PCR 检测后,稳定敲低的MM.1S 细胞继续用含有2 µg/mL 嘌呤霉素的1640 培养基培养,从而进行后续实验。所用引物序列详见表1。
1.6 Western Blot检测
使用2 µg/mL 的嘌呤霉素筛选对照组慢病毒NC-shRNA、实验组慢病毒E2F2-shRNA1、E2F2-shRNA2 感染后的MM.1S 细胞48~72 h 后,收集细胞进行E2F2 蛋白表达检测。用预冷的PBS 缓冲液洗涤3 遍,加入含有蛋白酶抑制剂的RIPA 裂解液振荡裂解,置于冰上裂解30 min以上,4 ℃,13 201×g离心15 min,收集蛋白上清液,并采用BCA 试剂盒测定其蛋白含量。100 ℃金属水浴锅中煮沸10 min 进行蛋白变性。对定量后的蛋白样本进行SDS-PAGE 凝胶电泳,使用50 g/L 脱脂牛奶室温封闭1 h,Rabbit anti-human E2F2(1:1 000 稀释)、Mouse anti-human HSP90(1:5 000 稀释)一抗4 ℃孵育过夜。次日,用含5 g/L 吐温的PBS 溶液(PBST)洗膜3 次,每次10 min,室温孵育山羊抗兔二抗(7074S)、马抗鼠二抗(7076S)(50 g/L 脱脂奶粉稀释,稀释比例为1:2 000)1 h,用5 g/L PBST 同样条件洗膜3 次,每次10 min,加入ECL 发光液,在凝胶成像系统中观察显色结果。用Image J软件对条带进行灰度分析,以内参基因HSP90 为参照,测定各组条带的相对表达量。
1.7 RNA提取及qRT-PCR检测
使用2 µg/mL 的嘌呤霉素筛选对照组慢病毒NC-shRNA、实验组慢病毒E2F2-shRNA1、E2F2-shRNA2 感染后的MM.1S 细胞48~72 h 后,收集细胞进行E2F2的mRNA 含量表达检测。收集细胞后,经预冷的PBS 洗涤3 次,使用总RNA 提取试剂盒提取RNA 样本,并对提取得的RNA 样本进行总量测定(Thermo Fisher 公司NanoDrop)。按照逆转录试剂盒的标准实验步骤反转录RNA 样本从而获取cDNA 样本。使用E2F2、FN1、PECAM1、ICOSLG以及内参β-actin的特异性引物并采用SYBR Green法对目的基因进行相对定量,将样本置于StepOne-Plus PCR 反应仪内,反应条件为:初始变性95 ℃,30 s;然后进行循环反应95 ℃,5 s,60 ℃,30 s,40个循环;溶解曲线反应条件95 ℃,15 s,60 ℃,60 s,95 ℃,15 s。采 用2-ΔΔCt法计算E2F2、FN1、PECAM1、ICOSLG的相对表达量。qPCR 引物设计详见表1。

表1 本研究中使用的siRNA和引物序列Table 1 siRNA and primer sequence used in this study
1.8 细胞粘附实验
本文使用细胞粘附检测试剂盒(Bestbio,BB-48120)分析细胞粘附率。96孔板每孔加入100µL包被液,置于4 ℃冰箱过夜。移除包被液后,待96孔板完全干燥后加入100µL 洗涤液洗涤1~3 次。按5×104个/100µL/孔接种细胞,设置3个重复孔。同时设立对照组,即不进行任何处理的MM.1S细胞。将细胞放进37 ℃培养箱孵育2 h,取出培养板,吸弃培养基,并用相应的培养基洗涤2~3次,每孔加入100µL新鲜培养基。每孔加入10µL细胞染色液,37 ℃孵育0.5~1 h,使用酶标仪检测450 nm处的吸光度值。
1.9 细胞迁移实验
本研究中的Transwell 实验使用的是带有滤膜(孔径为8µm)的小室。按5×105个/400µL 无血清培养基/孔接种细胞到上室中,将600µL 完全培养基加入下室。孵育48 h 后,收集迁移后的细胞,在100µL 无菌PBS 溶液中重悬,每孔加入10µL 细胞染色液,37 ℃孵育后,使用酶标仪检测450 nm 处的吸光度值。滤膜底面的浸润细胞用40 g/L 多聚甲醛在室温下固定15 min,并用1 g/L结晶紫染色。
1.10 统计学方法
运用GraphPad Prism 8 对数据进行统计学分析,进行方差分析(ANOVA)来比较组间差异。经单因素方差分析,比较3 组间差异是否有统计学意义,当P<0.05 时,认为差异具有统计学意义。误差表示来自3次重复实验的平均值±标准差。
2 结果
2.1 E2F2的表达情况与多发性骨髓瘤预后的关系
为了探究E2F2在多发性骨髓瘤(multiple myeloma,MM)中的表达情况以及对MM 患者临床预后的影响,我们首先收集19例MM患者的骨髓进行CD138 磁珠分选,通过qPCR 检测骨髓瘤患者样本的CD138+/CD138-细胞中E2F2的表达量,以CD138-细胞作为对照,结果显示CD138+细胞中E2F2的表达量明显升高,t=2.104,P=0.042 4,差异具有统计学意义(图1A)。为了进一步探究E2F2与MM 患者预后的关系,我们利用GEO 数据库(www.ncbi.nlm.nih.gov/geo)中的GSE2658 数据集进行Kaplan-Meier 生存曲线分析,E2F2高表达组的总生存期低于E2F2低表达组(图1B),P<0.000 1。以上结果表明E2F2的高表达预示了MM 患者的预后不良,E2F2在MM中可能起着促癌的作用。
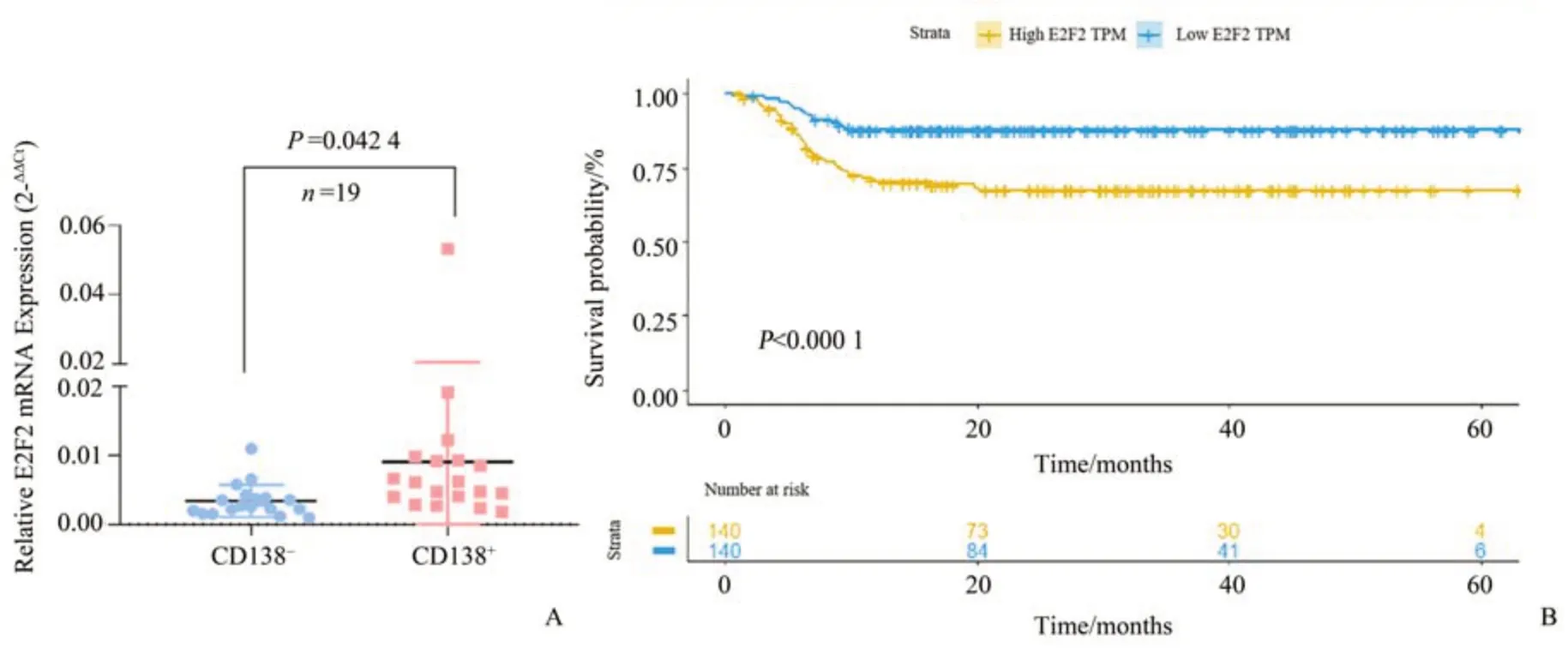
图1 E2F2与多发性骨髓瘤预后的相关性Fig.1 The correlation of E2F2 expression with prognosis in multiple myeloma patients
2.2 差异表达基因筛选
为了进一步探究E2F2在MM 中的作用,我们选取两株敲低E2F2的MM.1S 细胞进行RNA-seq测序。以对照组NC-siRNA 组作为参照,根据基因表达量差异倍数大于2 的标准进行差异分析并利用R 语言的Venn Diagram 包进行基因合集处理绘制韦恩图,同时利用Volcano Plot 包绘制火山图(图2A、B),结果显示两株敲低E2F2的MM.1S 细胞中存在815 个共同差异表达基因,其中包括508 个上调表达的基因(红色)和307 个下调表达的基因(绿色)(图2C)。

图2 差异表达基因火山图和韦恩图Fig.2 Volcano and Venn diagrams of differentially expressed genes
2.3 差异表达基因的功能富集与通路分析
利用R 语言中的phyper 函数对筛选出来的共同差异表达基因进行GO 功能富集分析(图3A-C)和KEGG 通路富集分析(图3D)。GO 富集分析包括:生物过程(biological process,BP)、细胞成分(cellular component,CC)和分子功能(molecular function,MF)分析。结果显示,上述差异表达基因主要参与细胞粘附和细胞迁移等生物过程,与细胞表面受体、质膜和细胞外基质等成分相关,同时调控PI3K-Akt、细胞粘附、粘着斑和细胞因子等介导的信号通路。其中,KEGG 富集到的细胞粘附通路包含14个差异基因(表2)。
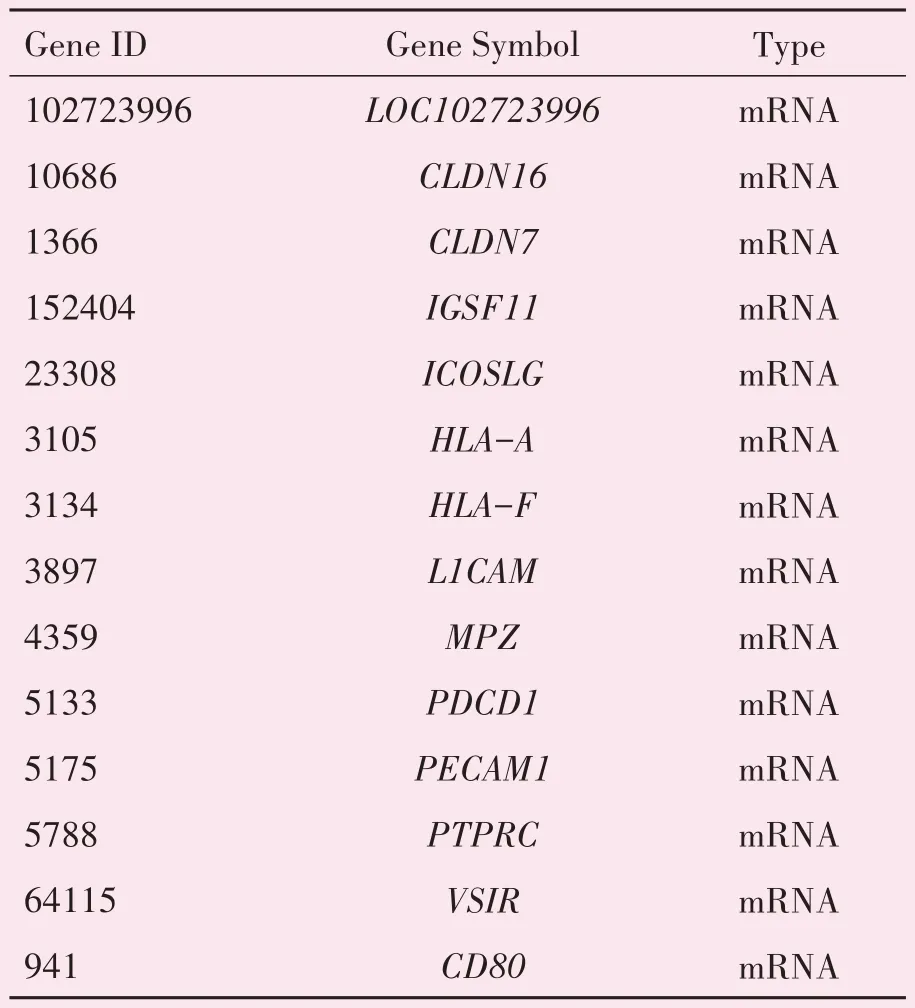
表2 KEGG通路富集结果中与细胞粘附功能相关的基因Table 2 Genes related to cell adhesion function in KEGG pathway enrichment results
2.4 蛋白质互作网络分析
利用string 在线分析网站和Cytoscape 软件对差异表达基因进行蛋白质互作网络分析(图4A)。根据Degree 排名筛选出10 个关键基因:FN1、IL6、EGF、PTPRC、FGF2、PECAM1、KIT、FYN、FOS、CAV1(图4B 和表3)。如图4C 所示,将KEGG 通路富集的细胞粘附功能相关的14 个基因进行蛋白质互作网络分析。CLDN7和CLDN16与其他基因无相关性,PDCD1与多个基因具有蛋白互作关系,PECAM1与CD80和PTPRC具有蛋白互作关系。

表3 蛋白互作网络分析关键基因Table 3 Protein interaction network analysis of key genes

图4 蛋白互作网络图Fig.4 Protein interaction network diagram
2.5 慢病毒介导的E2F2 在MM.1S 细胞系中的敲低效率检测
为了从细胞水平探究E2F2在多发性骨髓瘤发生发展中的作用,我们通过慢病毒构建E2F2稳定敲低的骨髓瘤MM.1S 细胞系,并通过蛋白印迹法(Western Blot)和实时定量荧光法(qRT-PCR)检测E2F2的敲低效率。首先,我们通过Western Blot 检测细胞中E2F2的蛋白表达水平以及对其表达量进行灰度分析(图5A)。经单因素方差分析,3组间差异有统计学意义(F=92.16,P<0.000 1),实验结果显示,以NC-shRNA 组作为参照,将E2F2在正常MM.1S 细胞中的相对蛋白表达量标准化为1,E2F2-shRNA1 组和E2F2-shRNA2 组的E2F2 蛋白表达量分别为0.434±0.053,0.420±0.028,P值分别为0.000 4和P<0.000 1,实验组与对照组间差异明显,差异具有统计学意义。
其次,我们通过qRT-PCR 检测细胞中E2F2的mRNA 表达量(图5B),经单因素方差分析,3 组间差异有统计学意义(F=1 502,P<0.000 1),以NCshRNA 组作为参照,将E2F2在正常MM.1S 细胞中的相对mRNA 表达量标准化为1,实验结果显示,E2F2-shRNA1 组 和E2F2-shRNA2 组E2F2的mRNA 表达量分别为0.368±0.013,0.442±0.009,P值均<0.000 1,实验组与对照组间差异明显,差异具有统计学意义。实验结果表明,MM.1S 敲低E2F2的稳转细胞系构建成功,可以用于后续的功能验证实验。
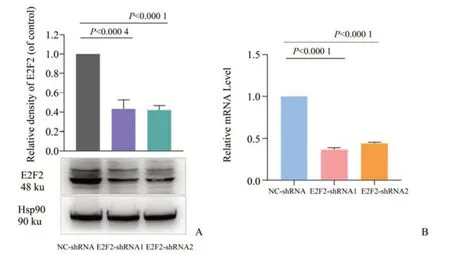
图5 慢病毒介导的E2F2在MM.1S细胞系中的敲低效率检测Fig.5 Detection of lentivirus-mediated knockdown efficiency of E2F2 in MM.1S cell lines
2.6 E2F2对骨髓瘤细胞细胞粘附的影响
为了研究E2F2对骨髓瘤MM.1S细胞粘附功能的影响,我们使用细胞粘附试剂盒检测MM.1S的细胞粘附水平,经单因素方差分析,3 组间差异有统计学意义(F=577.1,P<0.000 1),结果显示,抑制E2F2后,MM.1S细胞的粘附能力显著增强(图6A),P<0.000 1,差异具有统计学意义。随后,利用qRT-PCR 检测RNA-seq 测序筛选出来的与细胞粘附相关基因的表达量,主要包括纤连蛋白1(Fibronectin 1,FN1)、血小板与内皮细胞粘附分子1(platelet and endothelial cell adhesion molecule 1,PECAM1)和诱导型T 细胞共刺激配体(inducible T cell costimulator ligand,ICOSLG)基因。经单因素方差分析,3 组间差异有统计学意义(F值分别是=12.7、41.39、93.23,P<0.00 1),以NC-shRNA 组作为参照,将以上3 个基因在正常MM.1S 细胞中的相对mRNA 表达量标准化为1,实验结果显示,E2F2-shRNA1 组 和E2F2-shRNA2 组 的FN1、PECAM1、ICOSLG的mRNA 表达量均显著上调(图6B),P<0.05,差异具有统计学意义,具体数值见表4。

表4 FN1、PECAM1、ICOSLG的mRNA表达量Table 4 mRNA expression levels of FN1,PECAM1,ICOSLG
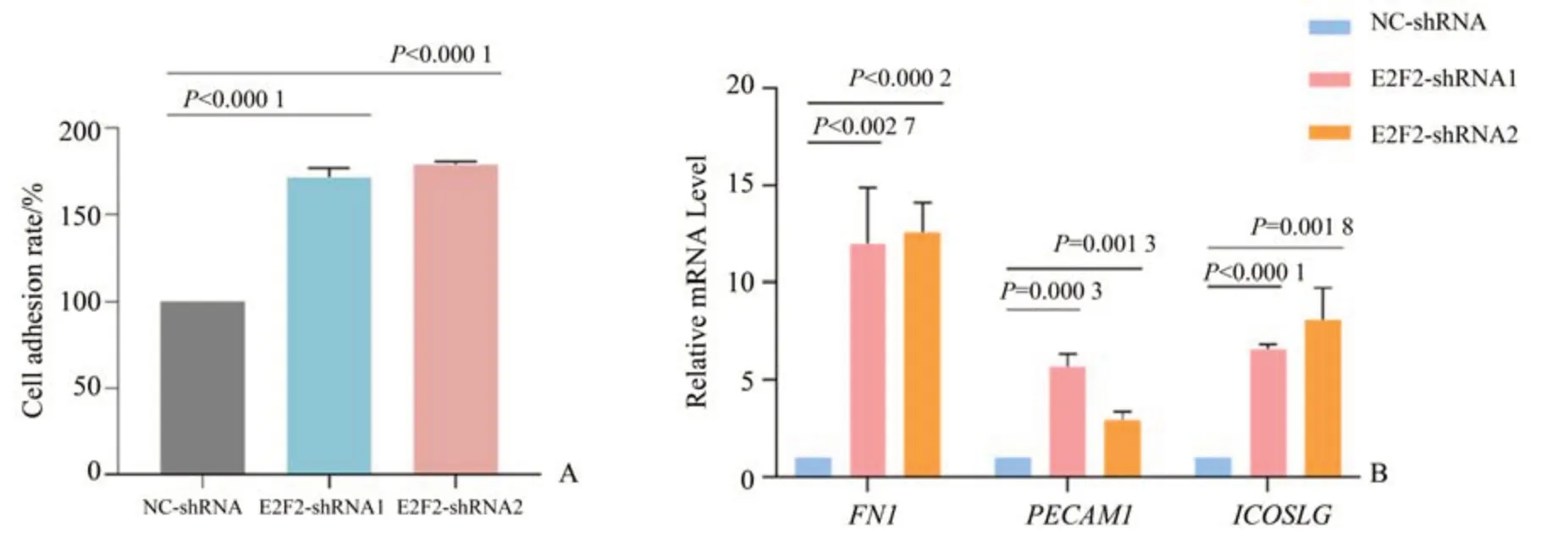
图6 E2F2在MM.1S细胞中调控细胞粘附水平Fig.6 E2F2 regulates cell adhesion in MM.1S cells
综上所述,E2F2可能通过调控FN1、PECAM1和ICOSLG等细胞粘附分子的表达来参与调控骨髓瘤细胞系MM.1S 的细胞粘附功能,抑制E2F2可以增强细胞粘附能力。
2.7 E2F2对骨髓瘤细胞细胞迁移的影响
为了研究E2F2对骨髓瘤MM.1S细胞迁移的影响,我们使用带有滤膜(孔径为8 µm)的小室检测MM.1S的细胞迁移水平,经单因素方差分析,3组间差异有统计学意义(F=250.7,P=0.000 5),实验结果显示,抑制E2F2 后,MM.1S 细胞的迁移能力显著减弱(图7A、B),P值分别为0.003 5 和0.001 3,差异具有统计学意义。使用酶标仪检测450 nm 处的吸光度值,经单因素方差分析,3 组间差异有统计学意义(F=140.8,P<0.000 1),实验结果显示,敲低E2F2 后,发生迁移的MM.1S 细胞减少(图7C),P值分别为0.009 0 和P<0.000 1,差异具有统计学意义。
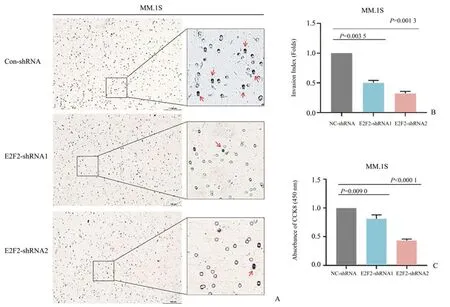
图7 E2F2在MM.1S细胞中调控细胞迁移水平Fig.7 E2F2 regulates cell migration levels in MM.1S cells
3 讨论
E2F2是一种与细胞周期相关的转录激活因子,其在细胞周期、细胞增殖与凋亡等多种生理和病理过程中都发挥着重要的作用,同时E2F2的表达失调会引起促炎细胞因子的异常产生,从而导致疾病的发生[11]。越来越多的文献报道,E2Fs 的异常表达或激活都可能导致恶性肿瘤的发生,其中E2F2的mRNA 水平在卵巢癌、肝癌、神经胶质瘤和胃癌等肿瘤中都显著上调表达,该结果表明E2F2与肿瘤的生存和死亡息息相关[12-15]。已有文献报道,CD138(syndecan-1)是典型的浆细胞标志物,它在骨髓瘤细胞表面高度表达[16]。因此在本研究中,我们收集初治多发性骨髓瘤患者的骨髓样本进行CD138 磁珠分选,分别收集CD138+和CD138-细胞,通过qRT-PCR 检测骨髓瘤患者样本的CD138+/CD138-细胞中E2F2的表达,同时利用GEO 数据库分析E2F2与骨髓瘤患者预后的关系。结果显示,E2F2在骨髓瘤中高表达且其表达升高提示患者预后不良(图1)。我们推测E2F2在骨髓瘤中发挥促癌的作用。因此,探究E2F2在多发性骨髓瘤中的功能、分子机制和临床意义对于骨髓瘤诊断治疗有着重要意义。
为了进一步探究E2F2在多发性骨髓瘤中的作用,我们将抑制E2F2表达的MM.1S 细胞系进行RNA-Seq 测序,初步筛选出815 个共同差异基因,其中508个基因表达上调,307个基因表达下调(图2)。差异基因主要富集于造血细胞谱系、PI3KAKT、粘着斑、细胞外基质受体相互作用、细胞粘附等信号通路,并且与细胞粘附、细胞附着、细胞迁移、细胞表面受体等生物过程密切相关,与质膜和细胞外基质等细胞成分相关,还与细胞外基质结构成分、信号受体结合、钙离子结合等分子功能有关(图3)。同时,对筛选出的差异基因进行蛋白质互作网络分析,结果显示FN1、IL6、EGF、PTPRC、FGF2、PECAM1、KIT、FYN、FOS、CAV1这10 个关键基因可能在MM 发生发展的过程中起着关键作用(图4 和表3)。FN1是一种在血浆中以可溶性二聚体形式存在的糖蛋白,主要参与细胞粘附和迁移过程,还参与包括胚胎发生、血液凝固、伤口愈合、转移、宿主防御等各种生化过程[17]。白介素6(interleukin 6,IL6)是一种用于维持体内稳态的细胞因子,IL6失调可能会对免疫功能产生病理性影响[18-19]。表皮生长因子(epidermal growth factor,EGF)可通过PI3K-Akt 通路促进肿瘤的血管生成[20]。蛋白酪氨酸磷酸酶受体C 型(protein tyrosine phosphatase receptor type C,PTPRC)与T 细胞检测抗原有关[21]。成纤维细胞生长因子2(fibroblast growth factor 2,FGF2)与组织稳态、炎症、肿瘤进程相关[22]。PECAM1可能参与白细胞迁移、血管生成和整合素激活等生理过程,它有助于屏障破坏后血管完整性的维持和恢复[23]。KIT原癌基因(KIT proto-oncogene,KIT)编码受体酪氨酸激酶,有文献报道抑制c-KIT 的治疗手段已被用于晚期黑色素瘤的临床试验中[24]。FYN原癌基因(FYN proto-oncogene,FYN)编码与细胞生长有关的膜相关酪氨酸激酶,可以通过激活β-catenin 通路从而促进骨关节炎的发生发展[25]。Fos原癌基因(Fos proto-oncogene,FOS)可以调节细胞增殖、分化和转化等功能,与神经元活动相关[26]。小窝蛋白1(caveolin 1,CAV1)积累在细胞质中,通过形成小窝质膜促进胞吞作用[27]。结合差异基因的GO 分析、KEGG 分析和蛋白质互作网络分析,我们推测细胞粘附与MM 的发生发展有着密切的联系。研究表明,细胞粘附是肿瘤发生发展过程中决定侵袭和转移的关键因素之一[28]。而较少研究报道E2F2与细胞粘附的相关性在肿瘤中的作用,在骨髓瘤中的研究更少。因此,我们进一步探讨E2F2调控MM 细胞粘附的分子机制。
为了在细胞层面验证E2F2对骨髓瘤细胞粘附的影响,我们选取两条靶向E2F2的shRNA 并通过慢病毒感染的方法构建E2F2稳定敲低的MM.1S细胞系,通 过Western Blot 和qRT-PCR 检测E2F2的抑制效果,结果显示构建的细胞系中E2F2的蛋白水平和mRNA 水平均显著下调,表明敲低E2F2的MM.1S 稳转细胞系构建成功(图5)。首先,我们使用细胞粘附试剂盒检测稳定敲低E2F2的MM.1S细胞系的黏附率,实验结果显示,随着E2F2的降低,细胞粘附程度升高(图6A)。其次,我们通过qRTPCR 检测FN1、PECAM1和ICOSLG等与细胞粘附相关的基因的mRNA 表达量变化。实验结果表明,在MM.1S 细胞系中稳定敲低E2F2后,FN1、PECAM1和ICOSLG的mRNA 表达水平均随之升高(图6B)。此外,实验结果表明,在MM.1S 细胞系中稳定敲低E2F2后,细胞迁移的能力减弱(图7)。有文献报道,在FN 家族中,FN1作为交互蛋白基因产物可以介导细胞粘附功能[29],PECAM1作为一种粘附应激反应蛋白在细胞和内皮细胞连接处高表达[30]。综上结果表明,E2F2的表达和骨髓瘤的细胞粘附能力密切相关,抑制E2F2可以增强MM.1S的细胞粘附能力。此外,E2F2可能通过抑制FN1、PECAM1和ICOSLG等细胞粘附相关基因的转录表达来降低MM.1S 的细胞粘附能力。有文献报道,E2F2属于转录激活因子[6],因此我们猜测E2F2对FN1、PECAM1和ICOSLG等细胞粘附相关基因的抑制调控是间接作用,在该信号通路中可能存在E2F2的下游靶基因直接调控这三个细胞粘附基因的转录表达,但具体的分子机制尚不清晰,需要进一步地深入研究。
综上所述,本研究首先在临床样本中证明了E2F2在MM 中作为促癌因子的作用,然后我们利用生物信息学分析对骨髓瘤MM.1S 细胞中敲低E2F2后的RNA-seq数据进行分析,发现细胞粘附、迁移和血管生成等相关功能对多发性骨髓瘤的发生发展有着密切的关系,同时筛选出与细胞粘附相关的关键基因FN1和PECAM1,这二者在MM 发生发展与预后评估中可能发挥重要作用。同时,我们发现E2F2可能通过降低骨髓瘤的细胞粘附,从而促进肿瘤转移和侵袭,影响骨髓瘤的发生发展。我们的研究结果表明抑制E2F2的治疗策略可能是骨髓瘤治疗的新途径。但是,本研究仅阐述了E2F2抑制细胞粘附和促进肿瘤迁移的调控作用,并未深入探究E2F2调控细胞粘附的分子作用机制。因此对E2F2和细胞粘附通路的进一步研究,将为多发性骨髓瘤的临床治疗提供新的思路和药物靶点。

