介孔硅纳米粒子孔径的调变及其在药物传递系统中的应用进展
张文君,刘 涛,陈 威,吕江维,王鹏光
(哈尔滨商业大学药学院,黑龙江 哈尔滨 150076)
目前,大部分药物存在体内稳定性差、半衰期短、生物利用度低等缺陷,使用合适的药物载体能改变药物在体内的分布情况、控制药物的释放程度和速率,使药物具有靶向性。介孔硅纳米粒子(mesoporous silica nanoparticles,MSNs)具有排列有序的孔道结构、较大的孔体积(0.6~1.0 cm3·g-1)、较大的比表面积(700~1 000 m2·g-1)、均一可调的孔径(50~200 nm)和易于修饰的表面性质等优点。2001年,Vallet-Regí等[1]首次将MCM-41介孔分子筛作为抗炎药物布洛芬的载体。因具有较高的载药量及药物缓控释性能等优势,MSNs成为药物传递系统的理想载体[2]。
MSNs孔径为2~6 nm,小分子药物很容易进入孔道内部,但如果负载的药物或生物分子尺寸过大时,将主要吸附在MSNs外表面,而不是内部的孔道中,导致负载效率和稳定性低,细胞摄取效果差[3]。研究[4]发现,孔径是评价MSNs作为药物载体性能的重要指标之一。一方面,孔径的改变会引起MSNs的比表面积和孔体积发生相应改变,使载体-药物、药物-药物之间的相互作用发生变化,从而影响药物的负载量;另一方面,孔径会影响药物的释放速率。大孔介孔硅纳米粒子(large pore mesoporous silica nanoparticles,LPMSNs)对大分子药物、蛋白质或核酸的传递和负载能力表现出明显的优势[5-6]。在此,作者介绍MSNs的制备方法和调孔方法,并对近年来LPMSNs在药物传递系统中的应用进行综述,旨在为MSNs在生物医学领域的临床研究提供借鉴。
1 MSNs的制备方法
MSNs的制备主要基于使用表面活性剂形成的胶束作为模板,与无机硅源之间通过多种物理化学反应,将无机硅源聚合成有序的晶相结构,然后通过煅烧等方法去除表面活性剂,形成有序多孔的MSNs。研究人员针对各自的研究体系,提出了不同的机理模型,其中具有代表性的主要有液晶模板机理和协同作用机理。液晶模板机理认为,表面活性剂作为模板剂,先以单个圆柱型微胞形式存在,加入硅源后,自组装形成六方孔结构;而协同作用机理认为,表面活性剂生成的液晶是在加入硅源前驱体之后形成的,硅源前驱体与表面活性剂依靠协同模板作用形成液晶相,然后进一步缩聚形成介孔结构。
目前,MSNs的制备方法主要包括水热合成法、溶胶-凝胶法、微波合成法及沉淀法等。
1.1 水热合成法
水热合成法是将模板剂、硅源、酸或碱按一定比例混合,在一定温度下经水热反应和晶化反应得到晶体,洗涤至中性,加热烘干,最后高温煅烧脱除模板剂。该方法具有水热稳定性好、晶化程度高、操作简单等优点。田喜强等[7]在不同煅烧温度下制备了球形、表面光滑、大小均匀的MCM-41介孔分子筛。宋婕[8]以P123、F127为模板剂,正硅酸乙酯(TEOS)为硅源,采用水热合成法制备了SBA-16介孔分子筛。梁旭华等[9]以十六烷基三甲基溴化铵(CTAB)为模板剂、TEOS为硅源,采用水热合成法制备了MSNs,并将其作为缓控释药物载体。
1.2 溶胶-凝胶法
溶胶-凝胶法是以活性单体通过聚合作用形成具有空间结构的凝胶,经干燥和热处理等过程制备纳米材料。该方法制备步骤相对简单,对条件及设备的要求均较低。周黄歆等[10]以CTAB为模板剂、TEOS为硅源,在碱性介质中通过溶胶-凝胶法制备MSNs。
1.3 微波合成法
微波合成法是在晶化时,将混合液置于微波炉内,通过微波辐射结晶生成MSNs。该方法制备时间短,操作方便,制备的MSNs尺寸更均匀、结构更规整、热稳定性更好。赵杉林等[11]以溴代十六烷基吡啶(CPBr)为模板剂、硅溶胶为硅源,采用微波合成法制备了MCM-41介孔分子筛。
2 MSNs的调孔方法
MSNs的孔道结构、孔径和孔体积是影响其载药性能的主要因素。MSNs孔径的增大,有利于药物在孔道内的负载和扩散。目前,MSNs的调孔方法主要有改变表面活性剂种类、添加辅助剂和改变反应条件3种途径,其作用机理主要是改变胶束大小。
2.1 改变表面活性剂种类
MSNs的孔径大小主要决定于表面活性剂疏水基团的大小。研究表明,改变表面活性剂碳链的长度可以改变孔道结构和孔径大小,在一定范围内,随着碳链增长,反应溶液中的胶束尺寸也会增大,达到扩大孔径的目的。但是,较长的碳链容易盘绕,对孔径的调节范围存在一定限制。对于嵌段共聚物型表面活性剂而言,MSNs的孔径大小主要决定于疏水嵌段相对分子质量的大小,疏水嵌段相对分子质量越大,得到的介孔孔径就越大。
Guo等[12]将模板剂CTAB溶于诱导溶剂三乙醇胺(TEA)中形成胶束,然后分别加入一系列辅助模板与CTAB共组装,再加入TEOS形成枝状LPMSNs。发现,亲水性较高的两亲分子有助于形成具有较大孔径的枝状LPMSNs,当辅助模板与CTAB的质量比大于11∶1时,将无法形成有序性好的枝状LPMSNs。Park等[13]分别以M2005、T3000、T5000、ML300、MNPA1000为表面活性剂,硅酸钠为硅源,制备LPMSNs,孔径最大8.2 nm,比表面积632~1 030 m2·g-1,孔容0.5~2.0 cm3·g-1。
韩玉等[14]采用超长碳链的表面活性剂溴代十八烷基三甲基溴化铵为模板剂,制备了具有较大粒径(550~650 nm)和孔径(40 nm)分布的单分散树枝状二氧化硅纳米球。曹磊等[15]以不同链长的长链烷基三甲基溴化铵(CnTAB,n=12、14、16、18)和两性生物表面活性剂椰油基甘氨酸钠为混合模板剂,TEOS为硅源,制备了具有较大孔径(5~10 nm)及比表面积(>700 m2·g-1)的三维介孔二氧化硅。发现,随着阳离子表面活性剂烷基链长的增长,煅烧产物的孔壁更加致密,比表面积、孔体积和孔径增大。
2.2 添加辅助剂
在制备过程中添加扩孔剂是增大MSNs孔径非常有效的方法。扩孔剂可以溶解在表面活性剂胶束内核的疏水区域内,导致胶束膨胀,从而增大MSNs的孔径。
Hao等[16]以CTAB为模板剂、TEOS为硅源、1,3,5-三甲苯(TMB)为扩孔剂,采用微流体技术制备了大孔径的空心球形二氧化硅(hollow spherical silica,HSS),具有从几纳米到100 nm的海绵状孔径。使用两段螺旋形微流控反应器制备大孔径HSS,其中一个入口流包含CTAB和稀释氨,另一个入口流包含TMB和TEOS。Saikia等[17]以TEOS、羧乙基硅三醇钠盐为硅源,TMB为扩孔剂,成功制备了具有羧酸功能化的LPMSNs。结果表明,木瓜蛋白酶分子在pH值为8.2时吸附量明显增加,达到1 138 mg·g-1。Kruk[18]以1,3,5-三异丙苯和环己烷为扩孔剂、P123为表面活性剂、TEOS为硅源,制备了可以调整孔径形成周期性孔阵列或单独的纳米颗粒。Wu等[19]以P123为模板剂、TEOS为硅源、Sr(NO3)2为扩孔剂,制备了具有有序介孔的生物活性SrO-SiO2玻璃,孔径5.4 nm,比表面积209 m2·g-1。Yamada等[20]以TMB为扩孔剂,制备了水溶胶MSNs,发现TMB的加入能够有效增大MSNs的孔径和粒径,且不会引起结构和粒子形态的变化。
2.3 改变反应条件
制备过程中晶化温度、晶化时间、介质的酸碱度以及后处理等因素也会影响MSNs的孔径。晶化温度越高,分子热运动越剧烈,有机碳链发生体积膨胀,碳链有伸直的趋势,自由能降低,使得表面活性剂胶束的直径有所增加,从而增大介孔分子筛的孔径。将制备的分子筛(煅烧或未煅烧)在一定温度下置于其母液或其它溶液中,再次晶化一定时间,介孔结构发生重排,孔径增大。
Choi等[21]研究发现,MSNs在生理条件下[37 ℃,磷酸盐缓冲溶液(PBS)]会迅速降解,是由于-O-Si-O-键可以在水介质中被OH-破坏,导致孔径增大[22]。将未扩孔的MSNs在37 ℃、浓度为1 mg·mL-1的中性PBS中悬浮24 h,离心,最终得到孔径约为10 nm的扩孔MSNs(图1)。
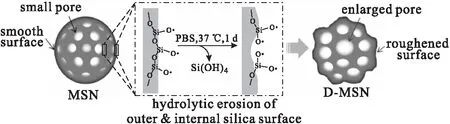
图1 生理条件下MSNs的扩孔原理[21]
张光旭等[23]考察了晶化温度对MCM-41介孔分子筛孔径的影响,发现晶化温度对孔径影响很大,最佳晶化温度为120 ℃,孔径可达4.5 nm。张强等[24]通过改变晶化温度来调整V-MCM-14分子筛的介孔结构、形貌,在110 ℃晶化温度下形成了高度有序的六方相介孔结构的V-MCM-14分子筛。郑修成等[25]以P123为表面活性剂、TEOS为硅源,在不同晶化温度下制备了硅基介孔分子筛。发现在同一晶化温度下,随着晶化时间的延长,分子筛的平均孔径先增大后减小,晶化时间为72 h时孔径最大为4.54 nm。王中平等[26]以阳离子表面活性剂CTAB为模板、TEOS为硅源,制备了介孔二氧化硅,发现升高pH值可使产物孔径分布更好,pH值为13时孔径最大。
3 LPMSNs在药物传递系统中的应用
常见的MSNs材料由于其孔径过小,孔道无法容纳过大的分子,对大分子药物、蛋白质、基因递送等存在一些限制,因此对MSNs的孔径进行调控十分重要[27]。孔径经过调控的MSNs在药物传递系统中的应用十分广泛,如提高难溶性药物的溶解度和溶出速率、控释药物、基因治疗等。
3.1 提高难溶性药物的溶解度和溶出速率
药物自身难以形成多孔结构,但与多孔材料结合则可以拥有纳米级的粒径和巨大的比表面积,从而改善药物的溶解度,加快药物的溶出速率。孔径是影响MSNs载药释药性能的重要因素,可决定载药量[28]。相对于普通MSNs,LPMSNs更有利于药物的负载与释放。
Heikkilä等[29]在不同MSNs(TUD-1、SBA-15和MCM-41)上负载布洛芬,发现孔径和孔体积是影响载药量的2个限制因素,当负载超过孔的总体积时,会在MSNs表面形成结晶药物,从而减缓药物从孔中释放的速率;如果孔径小于或等于药物分子直径的15倍,MSNs表面不会形成结晶药物。随着孔径的减小,载药量也随之减少。由于孔中药物分子相互作用越来越紧密,释放速率也会减缓。Izquierdo-Barba等[30]比较了布洛芬与红霉素从相同孔径MSNs的释放速率,结果发现,红霉素的释放速率比布洛芬的慢,随着孔径的减小,这种现象更加明显,因为红霉素的体积比布洛芬的要大。因此,为了便于药物的负载和释放,孔径至少是药物分子直径的3倍。Jia等[31]使用NaBH4溶液蚀刻法调节MSNs的孔径,可以提高紫杉醇的药物溶解度。Zhang等[32]采用有机模板法在油/水相中制备球形MSNs,通过增大孔径,提高了难溶性药物替米沙坦的溶解度,达到缓释效果。
3.2 控释药物
MSNs表面存在大量可修饰或改性的硅烷醇基团,如果在扩大自身孔径的基础上,通过修饰改性使其具备控释药物功能的同时也能增加载药量,药物控释常用的方法分为刺激响应型和靶向型。
3.2.1 刺激响应型
通过使用“门控开关”来控制MSNs的孔道开口。刺激响应是通过给予MSNs表面的控制器特定刺激时做出反应。这些刺激分为内部刺激(如pH值、氧化还原电位、酶等)及外部刺激(如磁场、超声波、光等),如图2所示。
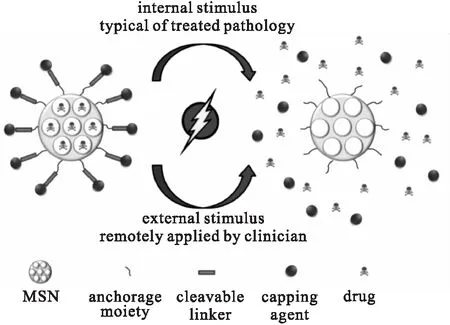
图2 MSNs刺激响应药物传递的示意图[33]
Banche-Niclot等[34]以TMB为扩孔剂制备了LPMSNs,并在其外表面涂覆pH响应聚合物聚乙二醇(PEG),以过氧化物酶(HRP)为负载模型蛋白,发现HRP在酸性环境下释放更快,这是由于,PEG在低pH值下质子化催化聚合物发生水解反应。
Guo等[35]以乙酸乙酯为扩孔剂制备了LPMSNs,将pH敏感的硅烷偶联剂(DMMA-APTES)接枝到LPMSNs表面,以细胞色素C为模型蛋白,并且将氨基端PEG修饰的AuNPs(AuNP-PEG5k-NH2)通过静电吸引吸附在LPMSNs表面作为门控开关,以避免细胞色素C泄漏,从而触发癌细胞凋亡[36]。
3.2.2 靶向型
靶向MSNs是通过使用叶酸(FA)、多肽、蛋白/抗体、透明质酸等不同配体对MSNs载体表面进行修饰,使修饰后的载体与肿瘤细胞上的特异性受体结合,达到靶向治疗的目的[37]。
一般来说,由于病变组织特有的血管结构,载药MSNs会通过高渗透长滞留效应(EPR)在肿瘤区迅速积聚。但肿瘤团块复杂、异质性强,由众多细胞(癌细胞、支持细胞、免疫细胞等)组成[38]。具有区分癌细胞和健康细胞能力的给药系统是有效根除恶性细胞的必要条件,经过表面修饰的MSNs能够选择性地与癌细胞中过表达的特定膜受体相互作用。
Chi等[39]制备了一种具有核壳结构的新型磁性LPMSNs(M-LPMSNs),并将三氧化二砷前药物(NiAsOx)负载到具有pH和磁性刺激响应的M-LPMSNs的孔隙中(图3a),用甲氧基聚乙二醇(mPEG)或细胞靶向配体FA进一步进行表面修饰,得到了靶向药物载体M-LPMSNs-NiAsOx-mPEG(FA)(图3b)。发现其在酸性环境中可以实现三氧化二砷的可控释放,有效诱导SMMC-7721肝癌细胞凋亡。
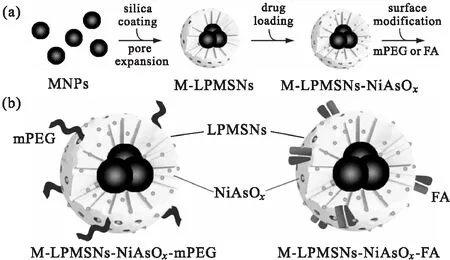
图3 M-LPMSNs-NiAsOx纳米颗粒的结构(a)及被mPEG或FA包覆的M-LPMSNs-NiAsOx(b)[39]
Rahmani等[40]用溶胶-凝胶法制备了粒径100 nm的LPMSNs,对pepstatin A(组织蛋白酶D的有效抑制剂)进行负载,结果表明,由于MSNs孔径的增大,对pepstatin A的负载量明显增加,对乳腺癌细胞的杀伤力也有很大提升。
3.3 基因治疗
基因转染是将具有生物功能的核酸(DNA、反义寡核苷酸及RNAi)转移到细胞内并使核酸在细胞内维持其生物功能的过程。基因转染技术在基因组功能研究和基因治疗方面已广泛应用[41]。鉴于用于基因治疗的物质在生理环境中存在稳定性差和生物利用度低等问题,开发能够保护和释放这些寡核苷酸的药物载体尤为重要。而LPMSNs材料因其优异的性能可作为药物载体的良好选择。
表1列出了不同类型的MSNs材料的制备方法、扩孔效果及在药物传递系统中的应用。
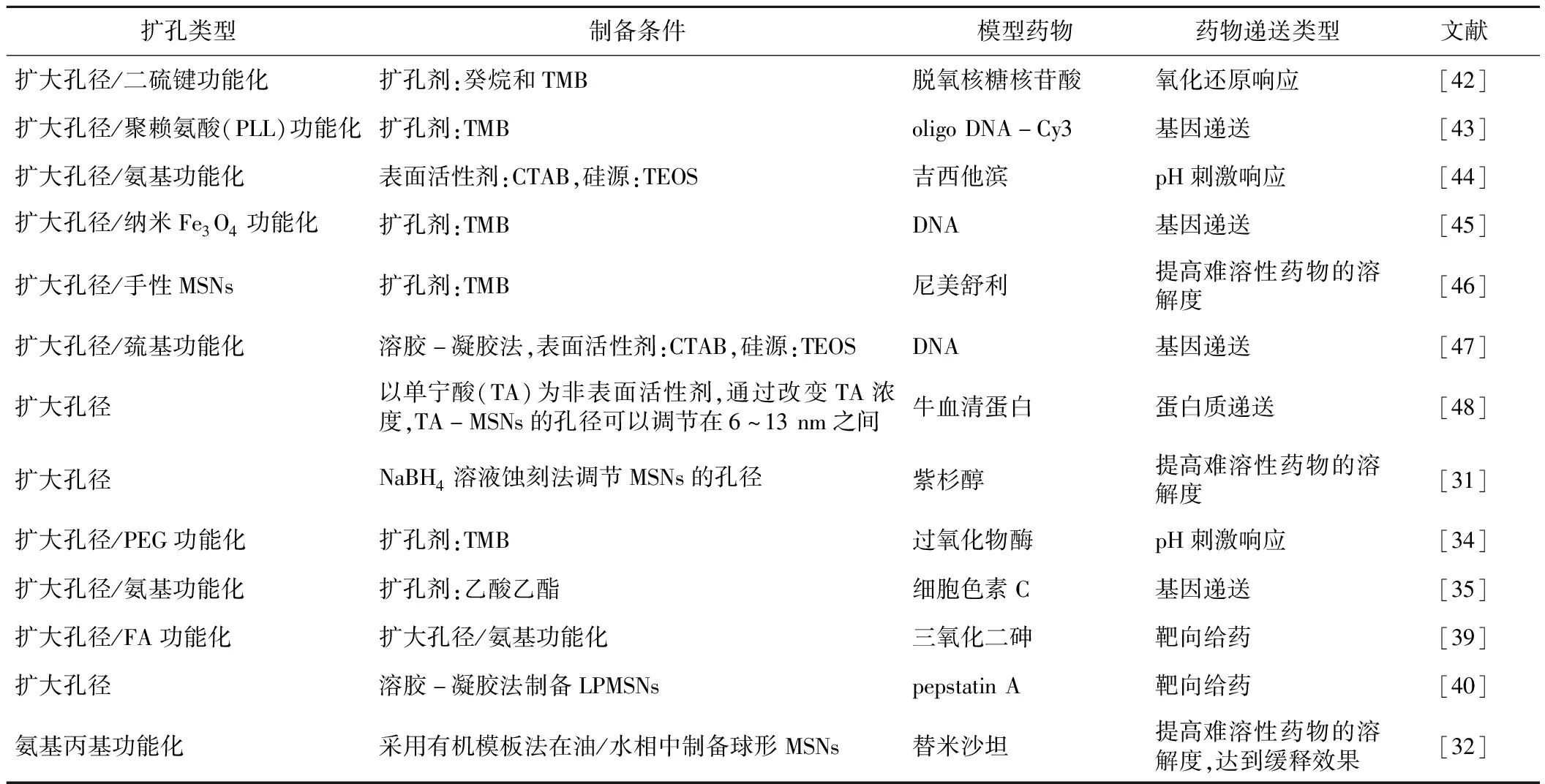
表1 不同类型的MSNs材料的制备方法、扩孔效果及在药物传递系统中的应用
4 结语
由于常见的MSNs材料孔径过小,孔道无法容纳过大的分子,对大分子药物、蛋白质、基因递送等存在一些限制,可通过改变表面活性剂种类、添加辅助剂和改变反应条件等方法对其进行调孔,LPMSNs更有利于药物的负载与释放。MSNs表面存在大量可修饰或改性的硅烷醇基团,可以连接对温度、磁场、电场、光、pH值、氧化还原剂、酶和分子靶向受体等敏感的功能化配体,如果在扩大孔径的基础上,对其表面进行修饰,可在提高载药量的同时达到刺激响应型、靶向型释放以及基因治疗等效果。此外,LPMSNs的制备需要复杂的化学反应,限制了工业化生产的规模,需要进一步进行探索,包括结构优化、评估给药系统的生物安全性等。随着研究的不断深入和细化,MSNs材料真正用于药物传递系统和临床指日可待。

