敲低PRMT5对卵巢癌细胞多西紫杉醇化疗敏感性的影响及其机制
金男,杨洪艳,裴会,姜姗姗,李烁
中国医科大学附属盛京医院第五产科,沈阳 110004
卵巢癌是女性生殖系统常见的恶性肿瘤,其发病率仅次于宫颈癌和子宫内膜癌,居第三位,而其病死率却一直高居女性生殖系统恶性肿瘤首位[1-2]。化疗是治疗卵巢癌的重要手段,而多西紫杉醇(DTX)是其一线化疗用药,但约20%患者在治疗6个月内出现化疗耐药。因此,化疗耐药成为卵巢癌复发和化疗失败的主要原因[3-4]。蛋白精氨酸甲基转移酶5(PRMT5)属于PRMT家族一员,通过自身表观遗传学活性及与多种肿瘤相关蛋白的相互作用,参与调节基因转录、RNA 加工、信号转导等生物学过程。有研究报道,PRMT5 对细胞周期蛋白依赖性激酶4/6(CDK4/6)抑制剂非常敏感,降低PRMT5水平能够显著增加黑色素瘤对CDK4/6 抑制剂的敏感性[4]。IGARASHI 等[5]研究发现,PRMT5 与 JAK1、JAK3的结合能力较强,并可通过调节STAT6活化促进STAT6 介导的基因转录,从而促进细胞增殖。DTX 可通过抑制微管形成而抑制细胞周期进展,而PRMT5 对DTX 的细胞周期阻滞作用是否有影响目前尚不清楚。2020 年 8 月—2021 年 6 月,本研究观察了敲低PRMT5 对卵巢癌细胞DTX 化疗敏感性的影响及其机制。现报告如下。
1 材料与方法
1.1 材料 人正常卵巢上皮细胞株IOSE80(以下称IOSE80 细胞),购于美国ATCC;人卵巢癌细胞株SKOV3、ES-2、A2780(以下分别称 SKOV3、ES-2、A2780细胞),购于中国科学院典型培养物保藏委员会细胞库。阴性对照质粒、PRMT5 siRNA-1 质粒和PRMT5 siRNA-2质粒均由上海吉玛制药技术有限公司合成。Multiskan FC酶标仪,购自赛默飞世尔科技(中国)有限公司;FACSCanto-Ⅱ流式细胞仪,购自美国 BD 公司;Amersham Imager 600 凝胶成像系统,购自 美 国 GE 公 司 。PrimeScript ™ RT Reagent Kit、SYBR®Premix Ex Taq Ⅱ,购自宝日医生物技术(北京)有限公司;Annexin V-FITC 细胞凋亡检测试剂盒,购自上海碧云天生物技术有限公司;anti-RPMT5、anti-JAK1、anti-JAK3、anti-STAT6、anti-p-JAK1、anti-p-JAK3、anti-p-STAT6、anti-β-actin 及辣根过氧化物酶标记的山羊抗兔或鼠IgG二抗,购自美国CST公司;Ki67 一抗、Alexa Fluor 555 二抗和 Hoechst 染料,购自美国Invitrogen公司。
1.2 细胞传代培养 将 IOSE80、SKOV3、ES-2、A2780 细胞接种于含 10% FBS 的 DMEM 培养基,置于37 ℃、5% CO2、饱和湿度的细胞培养箱培养。当细胞生长融合80%左右时,0.25%胰蛋白酶消化后按1∶4 传代。取传4 代、对数生长期、生长状态良好的细胞进行后续实验。
1.3 卵巢癌细胞筛选 ①PRMT5 mRNA 表达检测 。 取 IOSE80、SKOV3、ES-2、A2780 细 胞 ,采 用TRIzol法提取细胞总RNA,经紫外可见分光光度计鉴定,提取的总RNA浓度和纯度合格。按PrimeScript™RT Reagent Kit 说明,将总 RNA 反转录为 cDNA。反转录条件:37 ℃ 15 min,85 ℃ 5 s。以 cDNA 为模板,按照 SYBR®Premix Ex Taq Ⅱ说明进行 PCR 扩增。引物序列:PRMT5上游引物5'-CGCAGCCTCAGAGCGACGAC-3',下 游 引 物 5'-GCGCCGTAAATGAAGGGTC-3';U6 上游引物 5'-AGCAGAACGTGCGACATATCATCAC-3',下 游 引 物 5'-TGCGTCTGGCCGTTAACGTC-3'。PCR反应体系共20 µL:cDNA模板 0.8 µL,上下游引物各 1 µL,2 × SYBR Green PCR Mix 10 µL,ddH2O 7.2 µL;反应条件:95 ℃5 min,95 ℃ 30 s、60℃ 30 s、72 ℃ 30 s 共 42 个循环。以 U6 为内参,采用 2-ΔΔCT法计算 PRMT5 mRNA 相对表达量。实验重复3 次,取平均值。②PRMT5 蛋白表达检测。取 IOSE80、SKOV3、ES-2、A2780 细胞,RIPA 裂解液冰上充分裂解,4 ℃下 12 000 r/min 离心15 min、离心半径15 cm,留取上清,经BCA法蛋白定量合格。加入适量Loading Buffer,100 ℃水浴5 min,使蛋白充分变性。取变性蛋白30µg,经SDS-PAGE分离(80 V 30 min,120 V 100 min)。采用湿转法将蛋白电泳产物转印至PVDF 膜上,然后5%BSA 室温封闭1 h,分别加入anti-PRMT5、β-actin 抗体,4 ℃孵育过夜。次日,加入辣根过氧化物酶标记的山羊抗兔或鼠IgG二抗,室温孵育1 h。ECL化学发光,暗室内曝光、显影。Amersham Imager 600 凝胶成像系统拍照,Image J 软件分析各蛋白电泳条带灰度值。以β-actin 为内参,以目的蛋白电泳条带灰度值与内参蛋白电泳条带灰度值的比值作为目的蛋白相对表达量。实验重复3 次,取平均值。选择PRMT5 mRNA和蛋白相对表达量最高的卵巢癌细胞进行后续实验。
1.4 细胞分组与转染 取传4 代、对数生长期、生长状态良好的卵巢癌细胞,按4×106个/孔密度接种于6 孔板,然后置于37 ℃、5%CO2、饱和湿度的细胞培养箱培养。随机将细胞分为空白对照组、阴性对照组、siRNA-1 组、siRNA-2 组,每组设 3 个复孔。培养24 h,阴性对照组加入Lipofectamine2000 + 阴性对照质粒转染,siRNA-1 组加入Lipofectamine2000+PRMT5 siRNA-1 质 粒 转 染 ,siRNA-2 组 加 入 Lipofectamine2000 + PRMT5 siRNA-2 质粒转染,空白对照组不予转染。转染6 h,更换含10%FBS的DMEM培养基继续培养48 h,收集细胞,按1.3 中的方法检测各组PRMT5 mRNA和蛋白相对表达量。
1.5 细胞增殖抑制率检测 采用MTT 法。取各组上述转染后细胞,按8 × 103个/孔密度接种于96 孔板,置于37 ℃、5% CO2、饱和湿度的细胞培养箱培养。培养24 h,每组分别加入适量DTX,使其终浓度分别为1、5、10、15、20、25 µmol/L,同时设置空白孔(仅有培养基)和对照孔(仅有细胞,未经DTX 处理),然后置于37 ℃、5% CO2、饱和湿度的细胞培养箱继续培养。培养48 h,每孔加入5 mg/L MTT 溶液20 µL,避光孵育4 h。吸弃上清液,加入DMSO 150 µL,置于摇床上低速振荡5 min,使结晶物充分裂解。Multiskan FC 酶标仪于570 nm 波长处检测各孔的光密度(OD)值,计算细胞增殖抑制率。细胞增殖抑制率=(实验孔OD570值-空白孔OD570值)/(对照孔OD570值-空白孔OD570值)× 100%,利用Graphad Prism软件绘制细胞增殖抑制曲线。选择siRNA-1组和siRNA-2组中细胞增殖抑制率接近50%的DTX浓度进行后续实验。
1.6 细胞凋亡检测 取各组上述转染后细胞,按4×106个/孔密度接种至培养皿中,置于37 ℃、5%CO2、饱和湿度的细胞培养箱培养。培养24 h,加入适量DTX,使其终浓度达到上述要求。继续培养48 h,胰蛋白酶消化后收集细胞,避光转移至EP 管中,然后加入Annexin V-FITC 结合液195µL 重悬细胞,再加入Annexin V-FITC 5µL 和PI 10µL,轻轻吹打混匀。室温避光孵育20 min,上FACSCanto-Ⅱ流式细胞仪检测各组细胞凋亡率。实验重复3次,取平均值。
1.7 细胞增殖检测 取各组上述转染后细胞,按1×106个/孔密度接种至6 孔板(孔内放有玻片),置于37 ℃、5% CO2、饱和湿度的细胞培养箱培养。培养24 h,每孔加入适量DTX,使其终浓度达到上述要求。继续培养48 h,取出玻片,4%多聚甲醛固定10 min,再放入含0.5%Tween20的PBS孵育30 min。室温下5%脱脂奶粉封闭1 h,滴加Ki67 一抗孵育1 h,Alexa Fluoro 555 二抗染色,Hoechst 复染,显微镜下观察细胞增殖情况。Ki67 阳性染色呈红色,代表增殖细胞;Hoechst 阳性染色呈蓝色,代表凋亡细胞。以Ki67 阳性细胞比例代表增殖细胞所占的比例。Ki67 阳性细胞比例=Ki67 阳性细胞数/总细胞数×100%。实验重复3次,取平均值。
1.8 JAKs/STATs信号通路相关蛋白表达检测 取各组上述转染后细胞,按1×106个/孔密度接种至6孔板,置于37 ℃、5%CO2、饱和湿度的细胞培养箱培养。培养48 h,收集细胞,参照1.3 中的方法检测JAK1、JAK3、STAT6 及 p-JAK1、p-JAK3、p-STAT6 蛋白表达。
1.9 统计学方法 采用SPSS21.0 统计软件。符合正态分布的计量资料以表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 卵巢癌细胞筛选结果 SKOV3、ES-2、A2780细胞PRMT5 mRNA 和蛋白相对表达量均高于IOSE80 细胞(P均<0.05),SKOV3、ES-2、A2780 细胞PRMT5 mRNA 和蛋白相对表达量两两比较差异均无统计学意义(P均>0.05),见表1。以SKOV3 细胞PRMT5 mRNA 和蛋白相对表达量最高,故选择SKOV3细胞进行后续实验。
表1 卵巢癌细胞和正常卵巢上皮细胞PRMT5 mRNA和蛋白相对表达量比较()

表1 卵巢癌细胞和正常卵巢上皮细胞PRMT5 mRNA和蛋白相对表达量比较()
注:与IOSE80细胞比较,*P<0.05。
细胞类型IOSE80细胞SKOV3细胞ES-2细胞A2780细胞PRMT5蛋白0.13±0.05 0.88±0.04*0.87±0.03*0.85±0.04*PRMT5 mRNA 1.00±0.18 3.32±0.29*3.25±0.11*3.28±0.15*
2.2 各组PRMT5 mRNA和蛋白表达比较 siRNA-1组与siRNA-2 组PRMT5 mRNA 和蛋白相对表达量均低于空白对照组和阴性对照组(P均<0.05)。见表2。
表2 各组PRMT5 mRNA和蛋白相对表达量比较()

表2 各组PRMT5 mRNA和蛋白相对表达量比较()
注:与空白对照组比较,*P<0.05;与阴性对照组比较,#P<0.05。
组别空白对照组阴性对照组siRNA-1组siRNA-2组PRMT5蛋白0.88±0.07 0.87±0.05 0.13±0.04*#0.12±0.03*#PRMT5 mRNA 1.00±0.11 0.97±0.12 0.27±0.03*#0.25±0.04*#
2.3 各组细胞增殖抑制率比较 各组不同浓度DTX 干预后细胞增殖抑制率比较见表3。siRNA-1组与siRNA-2 组在10µmol/L DTX 干预时细胞增殖抑制率接近50%,故选择10 µmol/L DTX 进行后续实验。
表3 各组不同浓度DTX干预后细胞增殖抑制率比较(%,)
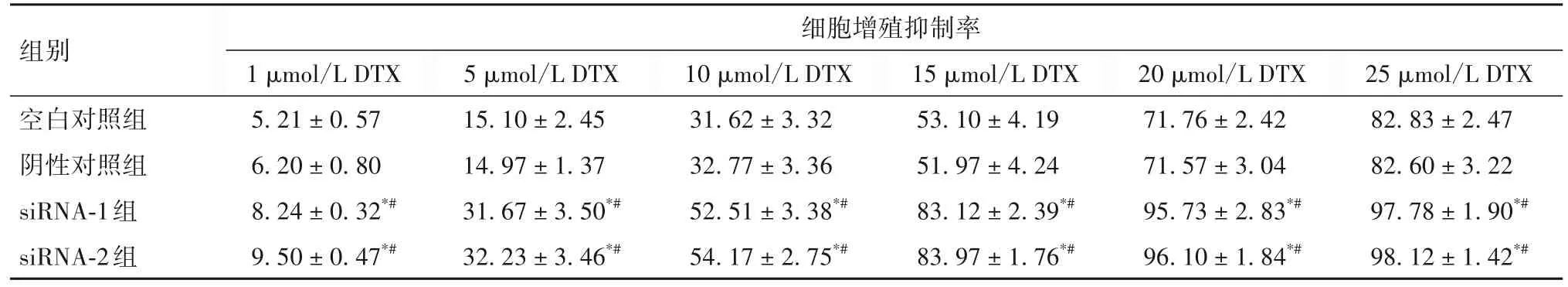
表3 各组不同浓度DTX干预后细胞增殖抑制率比较(%,)
注:与空白对照组比较,*P<0.05;与阴性对照组比较,#P<0.05。
组别细胞增殖抑制率1µmol/L DTX 5.21±0.57 6.20±0.80 8.24±0.32*#9.50±0.47*#20µmol/L DTX 71.76±2.42 71.57±3.04 95.73±2.83*#96.10±1.84*#25µmol/L DTX 82.83±2.47 82.60±3.22 97.78±1.90*#98.12±1.42*#5µmol/L DTX 15.10±2.45 14.97±1.37 31.67±3.50*#32.23±3.46*#10µmol/L DTX 31.62±3.32 32.77±3.36 52.51±3.38*#54.17±2.75*#15µmol/L DTX 53.10±4.19 51.97±4.24 83.12±2.39*#83.97±1.76*#空白对照组阴性对照组siRNA-1组siRNA-2组
2.4 各组细胞凋亡率比较 空白对照组、阴性对照组、siRNA-1 组和siRNA-2 组细胞凋亡率分别为(21.54 ± 3.62)% 、(23.47 ± 3.17)% 、(45.20 ±3.14)%、(47.14 ± 4.25)%。siRNA-1 组与 siRNA-2组细胞凋亡率均高于空白对照组和阴性对照组(P均<0.05),而 siRNA-1 组与 siRNA-2 组、空白对照组与阴性对照组细胞凋亡率比较差异均无统计学意义(P均>0.05)。
2.5 各组细胞增殖比较 10 µmol/L DTX 干预48 h,空白对照组、阴性对照组、siRNA-1组、siRNA-2组 Ki67 阳性细胞比例分别为(80.72 ± 6.5)%、(81.47 ± 5.3)% 、(47.21 ± 5.6)% 、(45.30 ±4.6)%。siRNA-1 组与 siRNA-2 组 Ki67 阳性细胞比例均低于空白对照组和阴性对照组(P均<0.05),而siRNA-1组与siRNA-2组、空白对照组与阴性对照组Ki67阳性细胞比例比较差异均无统计学意义(P均>0.05)。
2.6 各组JAK/STAT 信号通路相关蛋白表达比较 见表4。
表4 各组JAKs/STATs信号通路相关蛋白相对表达量比较()
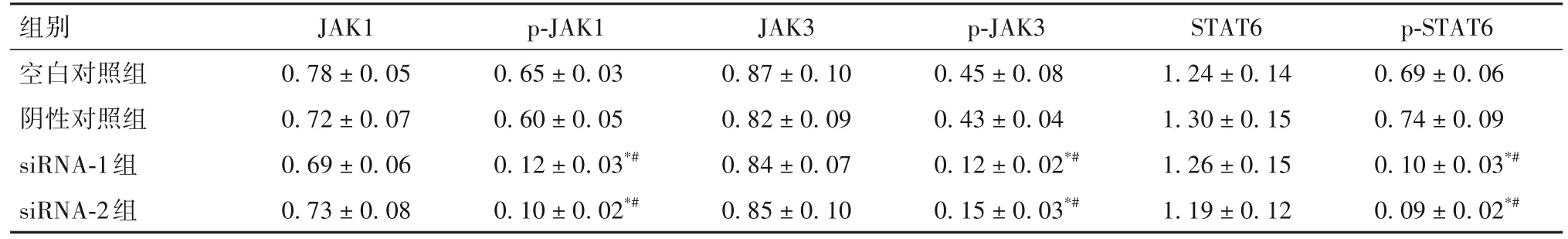
表4 各组JAKs/STATs信号通路相关蛋白相对表达量比较()
注:与空白对照组比较,*P<0.05;与阴性对照组比较,#P<0.05。
组别空白对照组阴性对照组siRNA-1组siRNA-2组p-STAT6 0.69±0.06 0.74±0.09 0.10±0.03*#0.09±0.02*#JAK1 0.78±0.05 0.72±0.07 0.69±0.06 0.73±0.08 p-JAK1 0.65±0.03 0.60±0.05 0.12±0.03*#0.10±0.02*#JAK3 0.87±0.10 0.82±0.09 0.84±0.07 0.85±0.10 p-JAK3 0.45±0.08 0.43±0.04 0.12±0.02*#0.15±0.03*#STAT6 1.24±0.14 1.30±0.15 1.26±0.15 1.19±0.12
3 讨论
卵巢癌是女性生殖系统常见的恶性肿瘤之一,由于其早期症状隐匿,约75%患者确诊时已处于中晚期,预后较差[6]。对于初诊卵巢癌患者,标准治疗方案为肿瘤细胞减灭术,术后辅以化疗[7]。随着外科手术技术不断进步及化疗药物不断更新,在过去的几十年里卵巢癌患者整体生存率已有所提高。有研究报道,化疗耐药不可避免,是肿瘤复发、转移以及病死率居高不下的重要原因[8-9]。DTX 是第二代紫杉烷类半合成抗肿瘤药,其抗肿瘤特性与紫杉醇相似,主要靶点为微管蛋白及微管系统。DTX 通过促进微管聚合并抑制微管降解,阻断G2/M期细胞分裂,从而抑制肿瘤细胞有丝分裂和增殖。由于DTX是一种半合成紫杉烷类药物,其溶解度和生物利用大于紫杉醇,故其抗肿瘤效果优于紫杉醇。临床药理研究证实,DTX 比紫杉醇具有更强的抗肿瘤活性,在铂类或紫杉醇耐药的卵巢癌中具有更好的治疗效果。目前,DTX 已获得美国FDA 批准用于治疗乳腺癌、非小细胞肺癌、前列腺癌、胃癌等恶性肿瘤。然而,DTX 化疗耐药仍然不可避免,故分析其耐药机制具有重要意义。
蛋白精氨酸甲基化是哺乳动物细胞中广泛存在的翻译后修饰过程,能够调节细胞的多种生物学过程[10-11]。PRMT5 是一种Ⅱ型精氨酸甲基转移酶,能够催化精氨酸对称二甲基化于多种靶标上,如组蛋白、转录因子、剪接因子、翻译因子和信号调节因子等[12]。PRMT5 在胚胎干细胞中高表达,对细胞增殖和自我更新至关重要。PRMT5 在有丝分裂后组织中表达较低,但在多种肿瘤组织中表达上调[13]。有研究报道,PRMT5 在胃癌中过表达,敲低PRMT5 后可抑制胃癌细胞生长和迁移[14]。YANG 等[15]研究发现,PRMT5 是鼻咽癌患者预后不良的生物标志物,并与患者放射抵抗密切相关。BAO 等[16]研究发现,PRMT5在卵巢癌组织中表达上调,并与患者预后不良有关,而敲低PRMT5后可显著抑制卵巢癌细胞增殖。肿瘤细胞生长依赖于PRMT5活性,其原因是PRMT5的遗传抑制或催化抑制会阻止肿瘤细胞增殖并促进其凋亡[17]。研究显示,获得性PRMT5抑制剂抗性的细胞对紫杉醇的敏感性发生变化,提示PRMT5表达可能与DTX 化疗耐药有一定关系。本研究结果发现,SKOV3、ES-2、A2780细胞PRMT5 mRNA和蛋白相对表达量均高于IOSE80 细胞,提示PRMT5 可能参与卵巢癌的恶性进展。本研究敲低卵巢癌细胞PRMT5表达,进一步观察了卵巢癌细胞对DTX 化疗敏感性的影响,结果发现,siRNA-1 组与siRNA-2 组细胞凋亡率均高于空白对照组和阴性对照组,Ki67阳性细胞比例均低于空白对照组和阴性对照组,而siRNA-1组与siRNA-2组、空白对照组与阴性对照组细胞凋亡率和Ki67 阳性细胞比例比较差异均无统计学意义。提示敲低PRMT5 可增加卵巢癌细胞对DTX 的化疗敏感性。王哲[18]研究报道,上调PRMT5表达可促进乳腺癌细胞对阿霉素的化疗耐药,而下调PRMT5 表达则可降低乳腺癌细胞对阿霉素的化疗耐药并促进其凋亡。因此,在化疗方案中加入PRMT5 抑制剂可能会提高乳腺癌患者的化疗敏感性。本研究结论与王哲[18]报道有相似之处。
本研究敲低PRMT5 可显著提高卵巢癌细胞对DTX 的化疗敏感性,但其具体作用机制尚不清楚。JAK/STAT 信号通路可参与促进肿瘤细胞增殖、侵袭和迁移等生物学过程。STAT3的反馈激活能够恢复细胞增殖能力,从而引起肿瘤细胞抵抗各种靶向药物或化疗药物。三阴性乳腺癌细胞对热休克蛋白90 抑制剂耐受后,JAK/STAT 信号通路转导增强,而JAK/STAT 信号通路抑制剂则可增强热休克蛋白90抑制剂的细胞毒性。以上研究表明,JAK/STAT 信号通路传导可能与肿瘤细胞的化疗耐药机制有关。本研究结果发现,siRNA-1 组与 siRNA-2 组 p-JAK1、p-JAK3、p-STAT6 蛋白相对表达量均低于空白对照组和阴性对照组,JAK1、JAK3、STAT6蛋白相对表达量与空白对照组和阴性对照组比较差异均无统计学意义,并且siRNA-1 组与siRNA-2 组、空白对照组与阴性对照组各蛋白相对表达量比较差异亦无统计学意义。提示敲低PRMT5 可能通过抑制JAK/STAT信号通路传导而增强卵巢癌细胞对DTX 的化疗敏感性。
综上所述,敲低PRMT5 可增强卵巢癌细胞对DTX 的化疗敏感性,其机制可能与抑制JAK/STAT信号通路传导有关。

