脓毒症患者外周血淋巴细胞中miR-30a-5p的表达
薛 露,降建新
(南通大学第五附属医院,江苏 泰州 215300;泰州市人民医院,江苏 泰州 215300)
脓毒症是由感染引起的全身炎症反应,多伴有器官灌注不足,最终导致器官功能障碍,威胁患者生命安全.10%~20%的脓毒症患者入院48 h内可发展为脓毒性休克,死亡率超过40%[1],因此,探索新的治疗靶点对改善患者预后具有重要意义.相关研究[2]显示:免疫功能紊乱贯穿脓毒症的整个病程,在病情发展中起到关键作用.免疫细胞凋亡是人体免疫功能紊乱的主要原因,脓毒症免疫调节治疗是目前研究的热点之一[3].随着近年来基因组学的快速发展,发现多种微小RNA(miRNA)在脓毒症中存在异常表达,其中部分miRNA能够介导脓毒症的免疫细胞调控,进而影响炎症因子的分泌[4].有研究[5]显示:miR-30a-5p基因敲除的小鼠体内CD4+T细胞功能有明显的增强,且能够刺激T细胞向Th1亚群分化,提示miR-30a-5p基因能够参与调控T淋巴细胞.但目前miR-30a-5p在脓毒症患者中表达及作用的研究仍十分少见.因此,本研究主要探讨脓毒症患者外周血淋巴细胞中miR-30a-5p表达及对淋巴细胞凋亡和血清炎症因子分泌的影响,旨为脓毒症患者的临床诊治提供新的思路.
1 对象与方法
1.1 研究对象
选取2019年3月—2020年5月南通大学第五附属医院收治的脓毒症患者96例,根据患者28 d的生存情况将患者分为存活组65例、死亡组31例.存活组男36例,女29例;年龄28~56岁,平均(47.05±8.51)岁.死亡组男18例,女13例;年龄30~58岁,平均(47.84±7.90)岁.性别、年龄在两组患者间比较差异无统计学意义(P>0.05),具有可比性.本研究经医院伦理委员会审核批准(LDK-2019014).
入选标准:符合欧洲危重医学会(ESICM)颁布的脓毒症诊断标准[6];年龄>18岁,能够正常沟通交流.
排除标准:合并恶性肿瘤、人乳头瘤病毒感染、骨髓移植的患者;近3个月有免疫抑制剂治疗史的患者.
1.2 主要试剂
RNA提取试剂盒、cDNA第一链合成试剂盒(天津卡梅德生物科技有限公司);鼠抗人Caspase-3单克隆抗体、鼠抗人PARP-1单克隆抗体、鼠抗人Bax单克隆抗体、鼠抗人Bcl-2单克隆抗体、鼠抗人GAPDH单克隆抗体、山羊抗鼠IgG(北京沃卡威生物有限公司);酶联免疫吸附法检测试剂盒(山东德诺生物科技有限公司).
1.3 方 法
1.3.1 标本采集与处理
抽取两组患者的外周静脉血10 mL,取其中7 mL用于分离淋巴细胞,加入淋巴细胞分离液,5 000 r/min离心20 min,收集白色淋巴细胞层,加入生理盐水混合均匀,5 000 r/min离心10 min,弃去上清,收集离心管底细胞(淋巴细胞).取另外的3 mL外周静脉血,3 000 r/min离心10 min,收集血清,-80 ℃保存待测.
1.3.2 RT-PCR法检测淋巴细胞中miR-30a-5p及Caspase-3、PARP-1、Bax、Bcl-2 mRNA水平
使用RNA提取试剂盒获得两组患者外周血淋巴细胞总RNA,应用分光光度法测定RNA浓度,取适量RNA,反转录得到互补DNA.PCR扩增引物由上海信帆生物科技有限公司设计合成.miR-30a-5p正向引物:5′-TTTCATTATTACAGGG CAGCGGT-3′,反向引物:5′-GGCACTCATTATTACGCGGCAA-3′;Caspase-3正向引物:5′-GCGTGCCGTTGTGTAGAG TTT-3′,反向引物:5′-ACTGCTAATTCGTCCCCAAT G-3′;PARP-1正向引物:5′-GCACGTAGTAGTTCCC TTGTGG-3′,反向引物:5′-CGTAAGACCTGTATTCT GTCCTG-3′;Bax正向引物:5′-CTTAACGGCTGAGG TGCTGTG-3′,反向引物:5′-GTCGAACAGTTTATGT CGACA-3′;Bcl-2正向引物:5′-ATACACGACGGC TTCGCTCGC-3′,反向引物:5′-ATACACGACGGCTT CGCTCAA-3′.内参U6正向引物:5′-GCAACTGAG GCTGGAAGTCGG-3′,反向引物:5′-CCAGGTAGGT ACTGTTGAAAC-3′.PCR反应设定条件:94 ℃预变性1 min,95 ℃变性50 s,57 ℃复性30 s,共40个循环,72 ℃延伸1 min.循环数法计算目的基因表达水平.
1.3.3 Western blot法检测Caspase-3、PARP-1、Bax、Bcl-2蛋白表达水平
分别提取两组患者外周血淋巴细胞总蛋白,蛋白定量后电泳分离目标蛋白,湿法转膜后封闭,滴加鼠抗人Caspase-3单克隆抗体(1∶500稀释)、鼠抗人PARP-1单克隆抗体(1∶500稀释)、鼠抗人Bax单克隆抗体(1∶200稀释)、鼠抗人Bcl-2单克隆抗体(1∶200稀释)、鼠抗人GAPDH单克隆抗体(1∶1 000稀释),4 ℃过夜;滴加辣根过氧化物酶标记的山羊抗鼠IgG(1∶1 000稀释),室温反应2 h,应用E-Gel Imager凝胶成像系统扫描并分析各条带灰度值.
1.3.4 酶联免疫法检测血清炎症因子水平
采用酶联免疫吸附试剂盒检测两组患者血清C反应蛋白、白细胞介素-6、白细胞介素-8、白细胞介素-10、白细胞介素-1β、肿瘤坏死因子-α表达水平,操作严格按试剂盒说明书进行.
1.4 统计学分析

2 结 果
2.1 两组患者外周血淋巴细胞中miR-30a-5p表达水平
死亡组患者外周血淋巴细胞中miR-30a-5p mRNA相对表达量为2.64±0.47,明显高于存活组的1.31±0.29,差异具有统计学意义(t=10.237,P=0.011).
2.2 两组患者外周血淋巴细胞中凋亡相关蛋白的mRNA和蛋白表达水平
死亡组患者外周血淋巴细胞中Caspase-3、PARP-1、Bax 的mRNA和蛋白表达水平均明显高于存活组,差异具有统计学意义(P<0.01);死亡组患者外周血淋巴细胞中Bcl-2的 mRNA和蛋白表达水平明显低于存活组,差异具有统计学意义(P<0.01).见表1、图1.
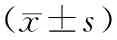
表1 两组患者外周血淋巴细胞中Caspase-3、PARP-1、Bax、Bcl-2的 mRNA和蛋白相对表达量Tab.1 Relative expressions of Caspase-3,PARP-1,Bax,Bcl-2 mRNA and protein in peripheral blood lymphocytes between the two groups
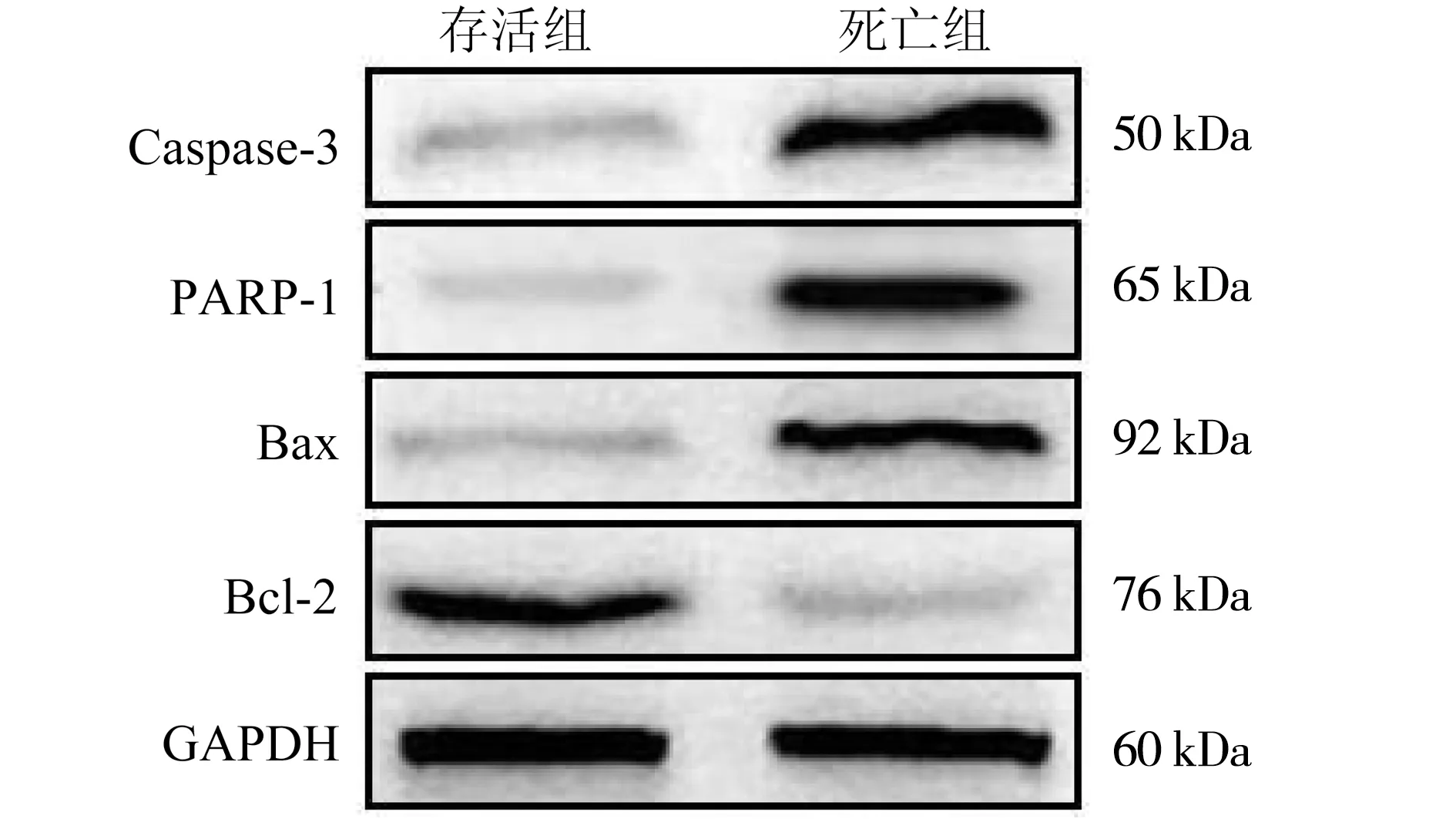
图1 Western blot法检测两组患者外周血淋巴细胞中凋亡相关蛋白表达情况Fig.1 Expression of apoptosis related proteins in peripheral blood lymphocytes of the two groups detected by Western blot
2.3 两组患者血清炎症因子表达水平
死亡组患者血清促炎因子C反应蛋白、白细胞介素-6、白细胞介素-8、白细胞介素-1β、肿瘤坏死因子-α浓度明显高于存活组,抑制炎症因子白细胞介素-10浓度明显低于存活组,差异均具有统计学意义(P<0.01).见表2.
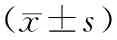
表2 两组患者血清炎症因子表达水平Tab.2 Expression levels of serum inflammatory factor between the two groups
2.4 miR-30a-5p与凋亡相关蛋白表达的相关性分析
Pearson相关性分析显示:外周血淋巴细胞中miR-30a-5p表达水平与Caspase-3、PARP-1、Bax蛋白表达水平呈正相关,与Bcl-2蛋白表达水平呈负相关.见表3.

表3 外周血淋巴细胞中miR-30a-5p与凋亡相关蛋白表达的相关性分析Tab.3 Correlation analysis between miR-30a-5p and apoptosis related protein expression in peripheral blood lymphocytes
2.5 miR-30a-5p与血清炎症因子表达的相关性分析
Pearson相关性分析显示:外周血淋巴细胞中miR-30a-5p表达水平与血清C反应蛋白、白细胞介素-6、白细胞介素-8、白细胞介素-1β、肿瘤坏死因子-α浓度呈正相关,与血清白细胞介素-10浓度呈负相关.见表4.

表4 外周血淋巴细胞中miR-30a-5p与血清炎症因子表达的相关性分析Tab.4 Correlation analysis between miR-30a-5p in peripheral blood lymphocytes and serum inflammatory factor expression
3 讨 论
脓毒症是临床常见的严重感染性疾病,会引发多脏器功能障碍,死亡率高,其发病机制复杂,包括细胞凋亡、炎症反应及线粒体功能障碍等[7].相关研究[8]显示:免疫细胞凋亡通过介导免疫系统功能紊乱参与脓毒症的发生与发展.当细胞凋亡异常时,人体内环境稳态被破坏,通过激活Caspase-3、Bax和抑制Bcl-2而启动细胞凋亡程序[9].脓毒症患者免疫细胞损伤和免疫功能障碍的发病机制是近年来的研究热点之一.研究[10]显示:脓毒症会加速T淋巴细胞凋亡,T淋巴细胞低反应性与其凋亡水平密切相关;脓毒症患者免疫抑制状态与淋巴细胞凋亡有关.近年来随着对miRNA研究的不断深入,发现免疫细胞受多种miRNA的调控,其中下调miR-30a-5p能够抑制急性肺损伤大鼠模型的肺泡上皮细胞凋亡[11];上调miR-30a-5p能够促进脂多糖诱导的细胞凋亡、炎症反应以及线粒体损伤[12].但关于miR-30a-5p在脓毒症患者中的表达及相关作用的研究仍十分少见.探讨miR-30a-5p表达对脓毒症发展的影响能够为发现新的治疗靶点、改善患者预后提供依据.
本研究结果显示:死亡组患者外周血淋巴细胞中miR-30a-5p mRNA相对表达量明显高于存活组,Caspase-3、PARP-1、Bax 的mRNA和蛋白表达水平均明显高于存活组,Bcl-2的 mRNA和蛋白表达水平明显低于存活组.近年来的研究[13]显示:外周血淋巴细胞中miR-30a-5p表达水平与Caspase-3、PARP-1、Bax蛋白表达水平呈正相关,与Bcl-2蛋白表达水平呈负相关.Caspase家族蛋白活化是细胞凋亡的主要生物学特征,其中Caspase-3能够破坏细胞的正常功能,激活凋亡信号传导通路,促进细胞凋亡.Caspase-3被活化后会增加PARP-1裂解片段的表达,相关研究[14]显示:脊髓损伤的大鼠模型中可见神经细胞凋亡,且合并PARP-1裂解片段高表达,与Caspase-3表达水平呈正相关.Bax与抑制凋亡蛋白Bcl-2能够结合成凋亡二聚体,大量分泌凋亡诱导因子,与Caspase家族蛋白发生级联反应,诱导细胞凋亡[15].结合本研究结果可推测,脓毒症患者外周血淋巴细胞中miR-30a-5p高表达可激活Caspase-3、PARP-1裂解片段和Bax,抑制Bcl-2,进而促进淋巴细胞凋亡,加速病情进展.
miR-30a-5p位于6号染色体1区,多个转录因子调控其表达.相关研究[15-16]显示:miR-30a-5p参与免疫炎症反应、血细胞生成等过程.C反应蛋白、白细胞介素-6、白细胞介素-8、白细胞介素-1β、肿瘤坏死因子-α等促炎因子能够促进免疫细胞生长、分化、归巢至感染部位,清除细胞中的病原体;同时还能够增强淋巴细胞对感染部位的浸润以及白细胞表达黏附因子,提升免疫细胞浸润水平[17].白细胞介素-10、白细胞介素-1Ra等抗炎因子能够抑制肿瘤坏死因子α、白细胞介素-8等细胞因子的促炎作用,控制炎症反应[18].本研究结果显示:死亡组患者血清C反应蛋白、白细胞介素-6、白细胞介素-8、白细胞介素-1β、肿瘤坏死因子-α浓度明显高于存活组,白细胞介素-10浓度明显低于存活组;外周血淋巴细胞中miR-30a-5p表达水平与血清C反应蛋白、白细胞介素-6、白细胞介素-8、白细胞介素-1β、肿瘤坏死因子-α浓度呈正相关,与血清白细胞介素-10浓度呈负相关.可推测miR-30a-5p通过靶向作用于某个信号通路,激活脓毒症患者体内炎症反应,使其病情加重,但具体信号通路仍需要进一步深入研究.
综上所述,脓毒症患者外周血淋巴细胞中miR-30a-5p高表达提示不良预后;其通过加速淋巴细胞凋亡以及上调促炎因子C反应蛋白、白细胞介素-6、白细胞介素-8、白细胞介素-1β、肿瘤坏死因子-α表达、抑制抗炎因子白细胞介素-10表达来影响免疫状态,加重患者病情.

