人Prx6的异源表达、酶学性质及结构分析
刘馨竹,林 睿,安丽萍,杜培革,郭 笑
(北华大学药学院,吉林 吉林 132013)
过氧化物氧还蛋白(Peroxiredoxins,Prxs)家族是一类不断扩展的巯基特异的抗氧化蛋白家族,该蛋白家族通过其过氧化物酶活性还原或降解氢过氧化物、过氧化亚硝酸盐和多种有机氢过氧化物,进而在拮抗机体产生的活性氧、维持机体的氧化还原平衡上发挥重要作用[1-3].有研究[4-5]表明:Prxs还有许多其他生物学功能,如参与细胞信号传导、细胞的增殖分化、血红素代谢及增强自然杀伤细胞的细胞毒活性等.在哺乳动物组织中至少有6个Prx成员(Prx 1~6),根据参与氧化还原反应的半胱氨酸(cysteine,Cys)数目不同将其分为两类,其中Prx 1~5为2-Cys Prx,主要以硫氧化蛋白为供电子体,而Prx6是唯一的1-Cys Prx以谷胱甘肽为供电子体[6].尽管各成员在细胞氧化还原保护中功能各不相同,但它们都具有细胞内H2O2还原活性,可以控制细胞内H2O2的水平[7].
研究[8-9]发现:Prx6具有谷胱甘肽过氧化物酶GPx活性和磷脂酶A2双功能活性,它能够清除过氧化氢、脂肪氢过氧化物及磷脂氢过氧化物等,在机体抗氧化的防御生理功能中具有重要作用.细胞水平研究[10-11]表明:过表达Prx6能明显减少脂质过氧化作用,降低细胞质膜损伤,而抑制Prx6表达则可观察到明显的脂质过氧化、脂膜损伤及细胞凋亡等现象.活体水平研究[12]表明:Prx6转基因小鼠对高氧损伤有显著的保护作用,Prx6基因敲除小鼠的抗氧化损伤能力明显降低.由此可见,越来越多的研究证明了Prx6具有重要的抗氧化损伤功能.国内外学者对Prx6抗氧化功能进行了一系列研究,而对其性质与结构的研究相对较少,本研究通过构建携带hPrx6基因的原核表达载体,使hPrx6基因在大肠杆菌中表达,并进一步对其酶学性质与结构进行分析,为后续其催化机制、生物学功能的研究提供理论依据.
1 仪器与材料
PCR仪(Thermo Fisher Scientific公司,美国);电泳仪(BioRad公司,美国);培养箱(上海博讯实业有限公司);超声破碎仪(上海比朗仪器制造有限公司);分光光度计(上海欣茂仪器有限公司).
质粒pColdⅠ、大肠杆菌BL21(DE3)、DH5α及人宫颈癌hela细胞株cDNA文库(北华大学药学院实验室保存);Premix Taq DNA聚合酶、dNTP、限制性内切酶、DNA Marker、蛋白质Marker、异丙基-β-D-硫代半乳糖甘(IPTG)、琼脂糖、质粒提取试剂盒、胶回收试剂盒(TaKaRa)(大连宝生物工程有限公司);胰蛋白胨、酵母粉(OXOID公司,英国);氯化钠、磷酸二氢钠、磷酸氢二钠、甘油等(鼎国生物有限公司).
2 方 法
2.1 hPrx6基因的调取
以人宫颈癌hela细胞株cDNA文库为PCR反应的模板,根据hPrx6基因序列设计引物hPrx6-F:5′-CCCAAGCTTATGCCCGGAGGTC-3′;hPrx6-R:5′-GCTCTAGATTAAGGCTGGGGTG-3′.
PCR反应条件:94 ℃变性2 min;94 ℃变性50 s,52~57 ℃退火45 s,72 ℃延伸1 min,运行35个循环;72 ℃保温8 min;4 ℃保持.
PCR反应体系见表1.

表1 PCR反应体系Tab.1 PCR reaction system
2.2 表达载体的构建
将获得的PCR产物hPrx6及质粒pColdI进行Hind III/Xba I双酶切,利用胶回收试剂盒回收酶切片段,将酶处理后的hPrx6基因片段和质粒按照5∶1(物质的量比)的比例进行16 ℃连接过夜.连接产物转化大肠杆菌DH5α感受态细胞,在含有氨苄西林抗性的LB固体培养基上筛选阳性转化子.再分别通过双酶切及PCR鉴定,最后将阳性克隆提取的质粒送上海生物工程有限公司测序.
2.3 表达菌种的筛选
将pColdI-hPrx6转化在BL21(DE3)感受态细胞中,在含氨苄西林抗性的LB固体培养基上筛选阳性转化子.挑取阳性菌种克隆于含有5 mL新鲜LB的培养基中,37 ℃震荡培养,当OD600为0.6~0.8时,加IPTG进行诱导表达,4 h后收集菌体,应用SDS-PAGE鉴定蛋白表达情况.
2.4 重组蛋白的分离纯化
收集菌体,用20 mmol/L磷酸盐缓冲液制备菌悬液,超声破碎后离心,离心后的上清通过0.45 μm滤膜过滤,滤液经Ni-NTA柱亲和层析纯化,先用20 mmol/L磷酸盐缓冲液平衡柱体,然后再分别用含有20、50、100、200 mmol/L咪唑缓冲液进行梯度洗脱,最后应用12% SDS-PAGE电泳检测目的蛋白.
2.5 纯化产物Western检测
取纯化后产物20 μL,上样于12%的分离胶SDS-PAGE电泳后,电转移至硝酸纤维素膜上,然后进行Western印记分析.一抗为鼠抗组氨酸抗体,二抗为HRP-羊抗鼠IgG,抗原抗体结合后与DAB底物溶液反应显色.
2.6 酶活力测定
应用Wilson酶偶联方法测定hPrx6的GPx活力,反应体系为1 mL,其中包含50 mmol PBS、2 mmol NaN3、1 mmol EDTA、0.05 mmol NADPH、0.3 mmol GSH、0.25 U谷胱甘肽还原酶和50 nmol的蛋白样品.反应混合物37 ℃预热5 min,然后加入终浓度为0.5 mmol的H2O2启动反应.在 340 nm 处测定NADPH吸光度值的变化情况,酶活力为37 ℃下该蛋白氧化1 μmol/min NADPH所需酶的量为一个活力单位,其酶活力单位用U/μmol表示.
2.7 酶学性质分析
最适温度:将等量纯化后的hPrx6于4、10、20、30、37、50、60、70、80 ℃条件下测定酶活力,所测最高酶活力设为100%,计算不同温度下的相对酶活力,探讨温度对酶活力的影响.
最适pH:将等量纯化后的hPrx6置于pH为3.6~10的缓冲液中,于37 ℃反应测定酶活力,以所测最高酶活力为100%,计算不同pH下的相对酶活力,探讨pH对酶活力的影响.
稳定性研究:为观察hPrx6的稳定性,将纯化后的hPrx6于4 ℃分别放置1、2、4、7、10 d,检测其活力变化.
2.8 结构分析
利用在线软件Expasy(http:∥web.expasy.org/protparam)对氨基酸组成及理化性质进行分析,利用SOPMA (http:∥prabi.ibcp.fr/htm/site/web/home) 对蛋白质二级结构进行预测,利用PDB(http:∥www.rcsb.org/pdb/home/home.do)进行蛋白质三级结构预测.
3 结 果
3.1 重组质粒的构建
对PCR扩增产物进行琼脂糖凝胶电泳,其结果见图1 a.在500~750 bp之间有条带与已知hPrx6的基因片段大小(686 bp)结果相符,且无其他非特异性扩增.重组质粒酶切鉴定结果见图1 b.质粒双酶切后有两条带,位于下面的条带与目的基因片段大小相符.测序结果与目的基因序列一致,说明重组质粒pColdⅠ-hPrx6构建成功.

a:M.marker DL2000;1~2.hPrx6 PCR产物.b:M.marker DL2000;1.p Cold I-hPrx6经Hind III和Xba I双酶鉴定.图1 琼脂糖凝胶电泳分析Fig.1 Agarose gel electrophoresis analysis of hPrx6
3.2 p Cold I-hPrx6诱导表达及纯化
含p Cold I-hPrx6的大肠杆菌BL21(DE3)经LB培养诱导后,进一步对菌体表达情况进行SDS-PAGE电泳检测,结果见图2 a.菌体诱导前后在约27 kDa处有一条明显蛋白条带,利用Ni-NTA柱亲和层析纯化目的蛋白,纯化后蛋白在约27 kDa处有单一条带,由此证明我们得到了纯度较高的目的蛋白.Western Bolt鉴定表达蛋白见图2 b,DAB显色后可见一条清晰条带,进一步表明目的蛋白得到了有效表达及纯化.
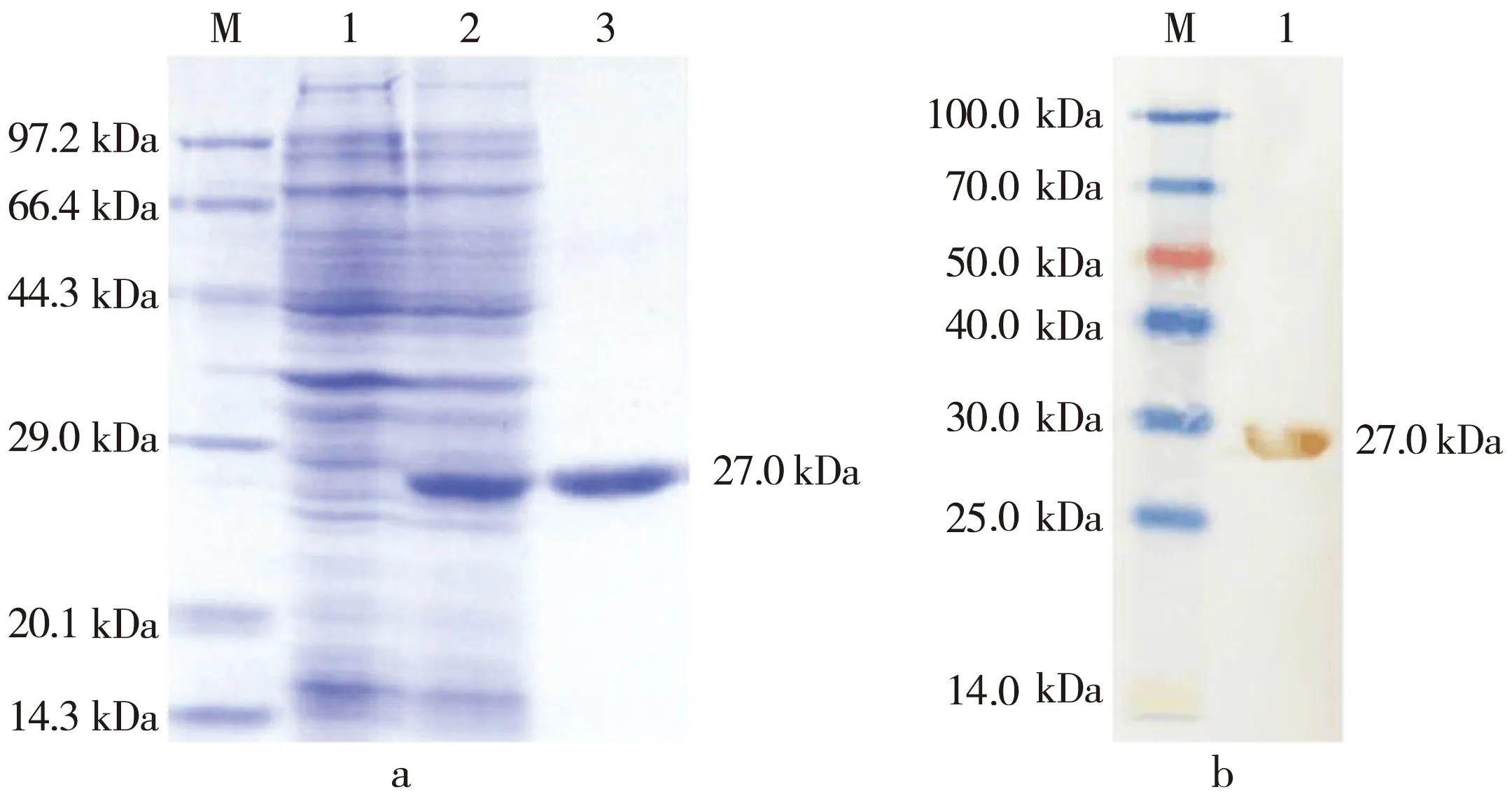
a:M.marker;1.转化p Cold I-hPrx6的BL21(DE3)未经IPTG诱导;2.转化p Cold I-hPrx6的BL21(DE3)经IPTG诱导;3.hPrx6纯化后蛋白.b:M.蛋白质marker;1.纯化后hPrx6蛋白.图2 SDS-PAGE和Western Bolt分析hPrx6蛋白表达及纯化Fig.2 Expression and purification of hPrx6 protein by using SDS-PAGE and Western Bolt analysis
3.3 酶学性质研究
利用Wilson酶偶联方法在不同温度和不同pH条件下测定hPrx6的酶活力,结果见图3 a.在10~50 ℃下,hPrx6的活力相对较高,温度在30 ℃时酶活力值最高.图3 b为hPrx6和pH变化曲线,其最适反应pH为7.由此可见,外界环境对蛋白质活力有较大的影响.
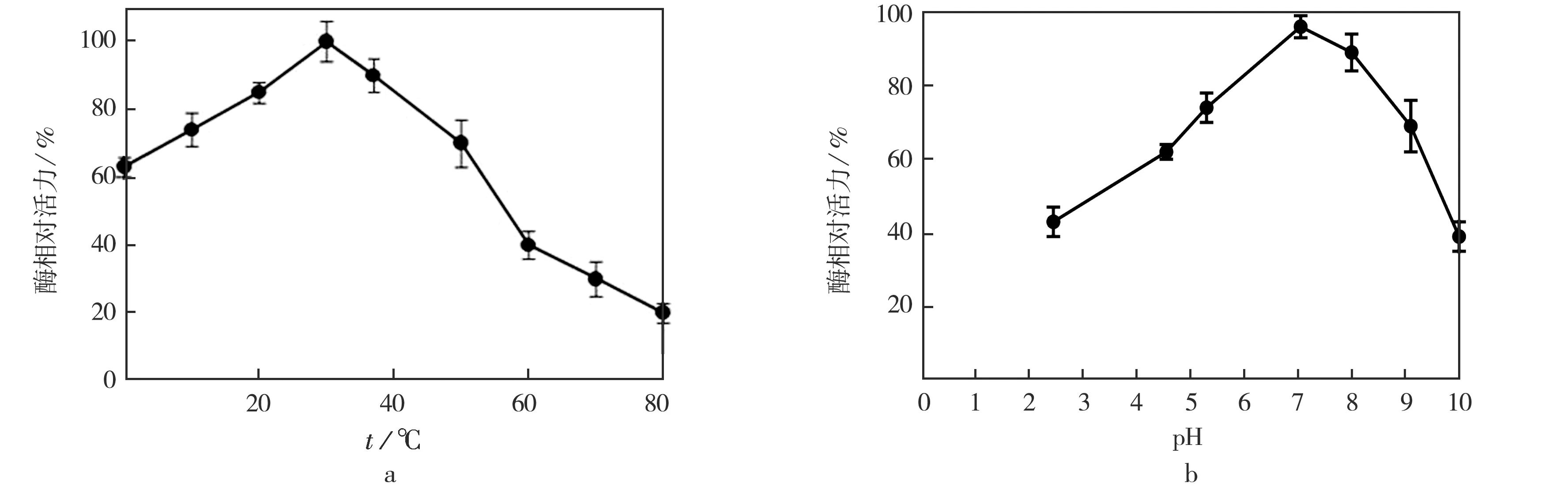
图3 温度和pH对活力的影响Fig.3 Effect of temperature and pH on activity
为了研究hPrx6的稳定性,将该蛋白存储于4 ℃下一段时间,观察其活力变化.由图4可见:随存储时间的增长,hPrx6的活力显著下降,10 d后活力基本丧失.

图4 存储时间对hPrx6活力的影响Fig.4 Effect of storage time on hPrx6 activity
3.4 结构分析
hPrx6酸性氨基酸总数(Asp+Glu=32)多于碱性氨基酸总数(Arg+Lys=30),其不稳定系数为43.26,归类为不稳定蛋白.利用SOPMA对hPrx6二级结构进行预测及分析,结果表明:该蛋白主链原子排列以无规则卷曲、α-螺旋和延伸链为主.其中无规则卷曲占43.75%、α-螺旋占25.89%、延伸链占21.43%、β-折叠占8.93%.人Prx6的蛋白质三级结构见图5.在三级结构中蛋白无规则卷曲分布较多,α螺旋在中间区域分布较集中,与上述二级结构预测结果大致相同.

图5 hPrx6的三级结构Fig.5 3D structure of hPrx6
4 讨 论
活性氧是生物体有氧代谢过程中产生的副产物,研究[13-15]发现:人类几乎所有疾病的产生和进展都与活性氧有关.因此,抗氧化酶的研发及应用具有重要意义.Prx蛋白家族拥有过氧化氢酶和谷胱甘肽过氧化物酶活性,对维持细胞内过氧化物水平具有重要作用,并且随着研究的深入,科学家们发现Prx家族成员在细胞生命活动中还承担着许多重要角色,如保护细胞免受氧化应激损伤、细胞信号转导以及参与细胞增殖、分化和凋亡等[16-17].
本研究首次在人宫颈癌cDNA文库中调取hPrx6基因,进而将其构建于p Cold I载体上进行异源表达,这为今后hPrx6的深入研究提供了参考.本研究还对hPrx6酶学性质进行了探讨,结果表明:hPrx6最适温度为30 ℃,最适pH为7,且受环境因素影响较大.对其稳定性研究的结果表明hPrx6的活力随着存储时间的增长呈下降趋势,对hPrx6氨基酸组成及理化性质分析表明其为不稳定蛋白.本研究还对hPrx6酶学性质进行了探讨,在后续研究中,我们将通过基因工程改造手段试图提高其催化活性及稳定性.此外,通过生物信息学对其二级、三级结构的分析,有助于了解蛋白质结构与活性功能间的关系,并为hPrx6的优化及改造提供信息,大大缩短了研发时间和成本,使研究更具有目的性及方向性,为进一步研究其生物学功能提供了理论依据.

