1例复发卵巢Sertoli-Leydig细胞瘤的临床诊疗分析
成星函,胡婷,徐世强,石宇,余健,刘洋,张国楠
610041成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 妇科肿瘤中心(成星函、胡婷、徐世强、石宇、余健、张国楠),肿瘤精准检测中心(刘洋)
1 病史摘要
患者,女,38岁,因“输卵管高级别浆液性腺癌外院不全术后化疗后复发术后8周期化疗后二次复发2周期化疗后1+月”于2021年8月首次入我院。患者2013年10月21日因“停经3月,检查发现盆腔肿物10天”在外院行“经腹右侧输卵管切除+左侧卵巢肿物剥除术+肠粘连松解术”,术后病理诊断示:1)(右输卵管)癌,倾向高级别浆液性腺癌;2)(左卵巢)低级别浆液性腺癌,部分区域高级别。患者因有强烈生育要求而拒绝补充手术,术后予紫杉醇+顺铂方案化疗9周期,2014年6月27日化疗结束,疗效评价为:完全缓解(complete response,CR)。2015年6月复查发现盆腔肿物,于2015年6月25日在外院行“经腹全子宫切除术+右侧卵巢切除术+左侧附件切除术+大网膜切除术+阑尾切除术+盆腔淋巴结清扫术+腹主动脉旁淋巴结取样术+小肠病损切除术+肠吻合术”,术后病检示:1)<左、右卵巢>、<大网膜>及<肠管>浆膜和肌壁均查见高级别浆液腺癌,结合病史及免疫组化结果,考虑为右输卵管癌累及至上述组织及器官;癌未累及所送<阑尾>、<子宫>、<左、右>盆侧壁手术切缘和<所切肠管>两端手术切缘;癌未转移至所送各组淋巴结,宫颈、宫内膜未见癌累及。IHC:ER++、PR+++、WT-1++、CK7+++、P53+、NapsinA散在+、CD15-、CK20-、Ki67阳性率约50%。术后予紫杉醇+顺铂方案化疗8周期,2016年1月19日化疗结束,疗效评价为:CR。后定期随诊,2021年5月复查彩超再次发现盆腔肿物,CA125 156.10U/mL,进一步行全身PET/CT示:盆腔右侧份团块状软组织密度占位(3.7 cm×3.6 cm×3.7cm),氟脱氧葡萄糖(fluorodeoxyglucose,FDG)代谢异常活跃,贴右侧盆壁走行,考虑肿瘤转移所致。于2021年6月10日、2021年7月2日在外院行2周期化疗:紫杉醇(白蛋白结合型)+卡铂。2021年7月22日查CA125 129.50U/mL,遂至我院进一步治疗。
既往史:无特殊。
婚育史:初潮14岁,3~7天/1月~6月,月经量较少,颜色正常,无明显痛经史。未婚,G0P0。患者于初次手术治疗及化疗后仍存在月经不规律,于2014年曾因“闭经”使用黄体酮治疗后月经来潮,否认促排卵等其他用药史。
家族史:无特殊。
入院查体:内科查体无特殊。专科检查:外阴阴性,阴道畅,黏膜光滑,断端愈合良好,未见明显新生物;三合诊:盆腔偏右侧可扪及一长径约4 cm质硬包块,固定,活动度差。直肠黏膜光滑,未扪及明显新生物。
入我院后诊治经过:完善相关检查,2021年8月9日查人附睾蛋白4 36.76 pmol/L(参考值0~140 pmol/L),血清CA125 94.87 U/mL(参考值0~40 U/mL),CA199及CEA正常。2021年8月11日全腹MRI平扫+增强:盆腔右侧软组织肿块(大小约4.2 cm×4.0 cm),与邻近乙状结肠及盆壁分界不清,考虑肿瘤。2021年8月11日我院病理会诊结果:(右侧输卵管、左侧卵巢)低分化癌,请完善消化道检查,并行免疫组化辅助分型。但患者拒绝行胃镜、肠镜检查。排除禁忌后,于2021年8月12日至2021年10月10日行二次复发后的第3、4、5周期化疗,方案:多柔比星脂质体+卡铂+贝伐珠单抗。2021年8月20日我院病理会诊订正报告(第二次报告):(右侧输卵管、左侧卵巢)肿瘤,鉴别诊断包括低分化癌,幼年性颗粒细胞瘤,午非氏管肿瘤。建议借患者历次所有切片会诊以进一步明确。肿瘤细胞免疫表型:-1:ER(灶区+),P53(野生型),PAX-8(-),CK7(-),CK20(-),P16(-),PR(-),Ki67(+,约30%),WT1(+),CEA多克隆(-),HNF-1β(-),Napsin A(-),Brg-1(SMARCA4)(+),CDX-2(-),GATA-3(-)。-8:P53(异质性表达>90%+),Ki67(+,约2%),WT1(+),GATA-3(-),TTF-1(-),CD10(个别+),CR(+),Inhibin-a(-),CD99(-),SF1(类固醇相关因子)(+),Ckpan(AE1/AE3)(+);特殊染色:-1:AB-PAS(-)。-8:AB-PAS(-)。2021年9月10日查 CA125 60.17 U/mL,2021年10月8 日查CA125 46.93 U/mL;2021年11月12日查CA125 65.15 U/mL。2021年11月12日全腹MRI平扫+增强:盆腔右侧软组织肿块(大小约4.1 cm×4.0 cm,图1),与邻近乙状结肠及盆壁分界不清。扫及约T10、11椎体信号及强化不均,较前新增,请结合骨扫描。2021年11月15日全身骨扫描:1)右侧约第4前肋、右踝关节、右足背、左胫骨平台代谢增高灶(20天前患者因外伤导致右足、右踝骨折、错位,行固定保守治疗中),良性可能,请结合临床;2)全身其余骨骼未见明显代谢异常征象。患者二次复发5周期化疗后疗效评价为:疾病稳定(stable disease,SD),经MDT讨论,患者为铂敏感复发,无进展间期(progression-free survival,PFS)5年余,ECOG评分 0分,初次肿瘤细胞减灭术术后无残留,此次复查影像学未见明显腹水,AGO评分阳性;综合评估,患者有再次肿瘤减灭术的手术指征,且达到满意减瘤水平的机率较大,经充分沟通并排除禁忌后,于2021年11月19日在全麻下行“经腹再次肿瘤细胞减灭术(盆腔病灶切除术+乙状结肠肠段切除及转移病灶切除术)+乙状结肠-直肠端端吻合+盆腔粘连松解术”。术中见:盆腔充血水肿,小肠与腹前壁及膀胱广泛致密粘连致腹腔盆腔封闭,分离肠管与腹前壁、膀胱粘连后见骶骨前方有一肿物,大小约5.0 cm×5.0 cm,质硬,固定,侵及部分乙状结肠,并与盆底及周围组织致密粘连,部分小肠之间致密粘连,盆腹腔腹膜、膈肌表面、肝脏表面及其它各肠管表面未见明显种植灶,在胃肠外科协助下达到无肉眼残留病灶。于2021年11月29日行术后第1周期化疗,方案:多柔比星脂质体+卡铂。2021年11月30日术后病理诊断报告:1)<盆腔肿瘤>恶性肿瘤,伴间质广泛黏液,结合病史,不除外低分化癌伴治疗后改变,鉴别诊断包括性索间质肿瘤(sex cord-mesenchymal tumor,SCST)及间叶源性肿瘤,待免疫组化协助诊断; 2)<远断端><近断端><乙状结肠肠段>未见肿瘤累及。2021年12月3日外院切片会诊补充报告(第三次报告):2013-10-21手术蜡块3个、2015年6月25日手术HE切片(B15-06742)36张:恶性肿瘤,SCST。结合历次形态学及免疫组化结果,符合中分化Sertoli-Leydig细胞瘤(Sertoli-Leydig cell tumor,SLCT)。肿瘤细胞免疫表型:-1:ER(灶区+),P53(野生型),PAX-8(-),CK7(-),CK20(-),P16(-),PR(-),Ki67(+,约30%),WT1(+),CEA多克隆(-),HNF-1β(-),Napsin A(-),Brg-1(SMARCA4)(+),CDX-2(-),GATA-3(-)。-8:P53(异质性表达>90%+),Ki67(+,约2%),WT1(+),GATA-3(-),TTF-1(-),CD10(个别+),CR(+),Inhibin-a(-),CD99(-),SF1(类固醇相关因子)(+),Ckpan(AE1/AE3)(+);特殊染色:-1:AB-PAS(-)。-8:AB-PAS(-)。2021-12-03二次肿瘤细胞减灭术术后标本:补充报告(第二次报告):<盆腔肿瘤>恶性肿瘤,SCST。结合历次形态学及免疫组化结果,符合中分化SLCT。肿瘤细胞免疫表型:Ckpan(AE1/AE3)(+),CK7(个别+),CK20(-),PAX-8(-),CR(+),Inhibin-a(个别+),SF1(类固醇相关因子)(-),S100(少量+),Brachyury(-),FOXL2(-),Brg-1(SMARCA4)(+),INI-1(+),WT1(+),Desmin(+),Ki67(+,约15%),CgA(-),Syn(±)(HE染色详见图2)。

图1 盆腔软组织肿块MRI特征
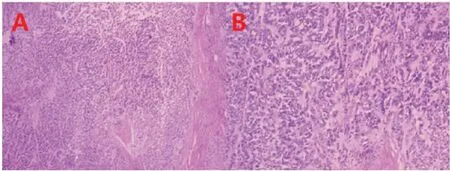
图2 再次肿瘤细胞减灭术切除盆腔肿瘤HE染色图片
2 讨 论
成星函(主治医师):患者系38岁女性,因“输卵管高级别浆液性腺癌二次复发2周期化疗后1+月”于2021年8月首次入我院。患者2013年初次手术时为不全手术,仅行“右输卵管切除+左卵巢肿物剥除术”,术后病理示输卵管高级别浆液性腺癌,因有强烈生育要求,拒绝行再次手术,术后补充9周期化疗。1年后出现复发,行肿瘤细胞减灭术+化疗。5年余后二次复发,病灶位于盆腔,院外行紫杉醇白蛋白+卡铂化疗2周期。因疗效不佳到我院进一步诊治。考虑患者为铂敏感复发治疗后,更换方案为多柔比星脂质体+卡铂+贝伐珠单抗,治疗3周期后复查全腹MRI,盆腔肿块无明显变化,疗效评价为SD。经MDT讨论后行再次肿瘤细胞减灭术,术后10天开始化疗,方案:多柔比星脂质体+卡铂。结合患者此次术后病理标本,与病理科详细沟通,追问患者既往病史,患者于初次手术前存在月经稀发、多毛(主要表现为双下肢小腿毛发浓密),再结合患者初次肿瘤细胞减灭术术后病理切片,结合IHC,诊断为:中分化SLCT。遂更正诊断为卵巢中分化SLCT二次复发化疗后术后1周期化疗后,目前讨论该患者的下一步诊疗思路以及该案例的经验教训。
徐世强(主任医师):卵巢SLCT是一种少见的SCST,由支持细胞和间质细胞组成,仅占所有原发性卵巢肿瘤的0.2%[1]。SLCT可发生于任何年龄段的女性,但40岁以下多见。SLCT多发生于单侧卵巢,仅1.5%为双侧发病[1]。临床上,SLCT的症状和体征主要与内分泌异常有关,SLCT是最常见的致男性化肿瘤,约有33%~38%的SLCT患者有雄激素过多症的表现,如多毛、声音低哑、痤疮、脱发、喉结增大、声调低沉、阴蒂肥大等一系列男性化体征[2]。也有部分SLCT患者表现为雌激素过高的体征,如性早熟、功能失调性子宫出血、绝经后阴道流血等,有文献报道,年轻女性更常见雄激素过多症的表现,而老年女性更常见雌激素过高的表现[3]。由于SLCT发病隐匿,且为罕见病例,故术前诊断困难,主要诊断依据是男性化表现和盆腔包块,病理诊断仍是金标准。目前对于该病的相关文献报道较少,多为临床个案报道。回顾该患者病史,病程较长,2013年初诊时,月经稀发及多毛症状未被重视,术后病理提示输卵管癌。患者初次至我院就诊时已于院外行2次手术治疗,术后均行辅助化疗,且院外2次术后病理结果均支持输卵管癌,入我院后病理科会诊存在疑难,需借历次所有切片会诊以鉴别诊断。因患者年轻、治疗意愿迫切,综合患者既往病史,仍考虑高级别浆液性癌可能性大,遂按相关指南治疗。期间多次建议患者借历次所有手术标本切片会诊进一步明确诊断,但仍未能及时完善。结合此次术后标本,病理科医生考虑会诊结果与既往病理诊断不符合可能性较大,追问患者于2013年初次手术前存在月经稀发、双侧小腿汗毛较多症状,再结合此次切除大体标本形态及前2次手术所有病理切片形态学和免疫组化结果,最终修正诊断为卵巢SLCT。对于SCST,目前指南推荐一线化疗方案为TC方案(紫杉醇+卡铂),该患者术后化疗方案应更换为TC方案,如效果不佳,根据指南推荐可选择二线化疗方案(多西他赛、紫杉醇、紫杉醇+异环磷酰胺),必要时可加用激素治疗(芳香化酶抑制剂等)及靶向药物(贝伐珠单抗)。
在该位患者的诊疗过程中,存在一些经验教训:1)传统的诊疗思维模式可能延误治疗。患者于我院初诊时,系输卵管高级别浆液性腺癌二次复发化疗后,影像学提示盆腔右侧软组织肿块,CA125升高,此次复发化疗后监测CA125有所下降、但肿瘤无明显缩小,尽管入院后外院病理切片存在疑问,按照疾病诊疗原则,很容易固定模式地考虑为患者对既往化疗方案耐药,而非首先去否定既往的病理诊断,但既然病理科医师已提出诊断疑难,我们应及时与病理科及患者沟通,必要时行多学科会诊,这一点应引起重视;2)对于既往病史中体征、月经史的忽略,也在一定程度上影响了该病的确诊。患者初次入院时,并未对2013年初次手术前的月经史及内分泌相关体征给予过多的关注,遂未能及时给病理科医生提供临床相关的病史资料以支持病理诊断的修正。所以作为妇科肿瘤医生,遇到疑难、少见、病理类型特殊的病例,应该及早、充分地与病理科及患者进行沟通,尽可能多地考虑疾病存在的可能性。另外,通过对该患者的病例讨论,也再次体现出首诊患者时获取充分病史资料的重要性。
余健(主任医师):该例患者病史较长,于再次肿瘤细胞减灭术术后修正诊断为卵巢中分化SLCT。对于初诊为卵巢SLCT的患者,手术为主要的治疗方法[4]。有保留生育功能意愿、病灶局限于单侧卵巢者,可行保留生育功能的全面分期手术;大网膜切除和腹膜多点活组织病理学检查可使约30%卵巢SLCT患者的分期更全面,并可能影响预后[5]。对于临床分期为FIGO I期低危患者(无肿瘤破裂、分化程度高),术后可仅观察;对于FIGO I期高危患者(肿瘤破裂、分化程度差)或FlGO I期中危患者(含有各种异质成分的),术后可观察或行以铂类为基础的化疗;对于FIGO Ⅱ~Ⅳ期患者,建议术后行以铂类为基础的化疗或者对局限性病灶进行放疗。Sigismondi等[6]研究结果显示,高期别的卵巢SLCT患者术后接受辅助化疗对预后有益,并且以铂类为基础的化疗是有效的。该患者2013年初次手术仅行患侧卵巢肿瘤切除术+患侧输卵管切除术,术后提示输卵管恶性肿瘤,因患者有强烈生育要求,拒绝行补充手术进行全面分期,术后补充化疗。初次治疗结束1年后出现首次复发,行肿瘤细胞减灭术+化疗。首次复发治疗结束后5+年发现二次复发,目前患者已行再次肿瘤细胞减灭术,术后修正诊断为卵巢中分化SLCT。该病理类型相比高级别浆液性腺癌预后较好,患者总生存期已8年余,因患者为二次复发,术后仍需补充化疗。
石宇(主任医师):SCST是一组由分化程度不等的性索样细胞、性腺间质成分及其各种黄素化细胞单一或混合构成的肿瘤。卵巢胚胎发育的复杂性决定了卵巢SCST的多向分化,因此分类也比较复杂。根据WHO 2020卵巢肿瘤组织病理学分类[7],将SLCT分为高分化、中分化、低分化和网状型4种类型,后3类可伴异源性成分,以中分化最多见。高分化和低分化(伴/不伴异源性成分)分别为良性和恶性肿瘤,中分化和网状型(伴/不伴异源性成分)为交界性或无法确定生物学行为的一类肿瘤。卵巢SLCT的预后与肿瘤分化程度和分期密切相关。文献报道,肿瘤体积超过15 cm、肿瘤细胞分化差、核分裂相多见、网状成分多者预后较差[4,8]。就分化程度而言,分化好的卵巢SLCT多为良性,5年生存率为100%;而中分化和分化不良者肿瘤恶变可能性分别为11%和59%,5年生存率约为80%[9]。就分期而言,早期患者的预后要明显优于晚期患者。Zhang等[10]对376例SCST患者进行研究,其中I期、II期患者5年生存率约为95%,Ⅲ期、Ⅳ期患者5年生存率约为59%。就复发风险而言,据报道,IA期患者的复发率为7%,IC期的复发率约为30%,晚期(II期至IV期)的预后较差,复发率为73.7%,复发病例的死亡率为78.6%[11]。除此之外,患者年龄、肿瘤有无残留、术后辅助治疗等因素也对患者的预后有一定影响[12]。就本例患者初次手术探查及术后病理结果,分期为II期,肿瘤呈中分化未伴异源成分(肿瘤中未见粘液性腺体,但间质有广泛粘液变性),初诊时患者29岁,虽历经两次复发,但目前已存活8+年。
卵巢SLCT好发于年轻女性,发现时多为I期,术前及时、正确认识及诊断该病有助于为患者选择最合适的治疗方案,提高患者的预后。重视患者的内分泌等相关体征和症状有助于早期识别该病发生的可能性。此外,有文献报道,MRI影像学提示以下形态学征象可协助诊断[13]:1)囊性为主肿块,实性成分呈沿囊壁或分隔生长的宽基底实质区;2)实性肿块,T2WI呈低或稍高信号,可伴囊变区且囊壁显著强化。结合该患者于我院的MRI影像学,呈T1WI等及稍低信号、T2WI稍高及高信号,边界尚清,增强见不均匀强化,其内见无强化液化坏死表现。病理学上,卵巢SLCT主要是依靠其组织形态学进行诊断,大体观察肿瘤多呈实性或囊实性,边界清楚,包膜完整,切面呈灰白或灰黄色,偶呈囊性,出血、坏死常见,诊断疑难时可借助免疫组化进行鉴别。在肿瘤中出现Leydig细胞簇是诊断SLCT的重要线索,同时可联合应用α-抑制素、上皮细胞膜抗原(EMA)、CK7、CD99等免疫标记鉴别诊断。α-抑制素在大部分SLCT中呈阳性表达,EMA、CK7多为阴性,CD99在卵巢SLCT中表达不稳定。低分化SLCT中,性索样结构及Leydig细胞通常很难找到,α-抑制素和calretinin是鉴别诊断中最有意义的免疫组化标记,但分化太差可呈阴性[12]。也有学者总结了免疫组化标记在常见SCST中的阳性表达强度及阳性率[14],其中对于卵巢SLCT,α-抑制素表达强度呈+++,阳性率45%~100%,calretinin表达强度呈++或+++,阳性率50%~100%,CD99表达强度呈+++,阳性率67%~100%,WTI(Wilms瘤抑制基因)表达强度呈++或+++,阳性率0%~100%,melan-A表达强度呈++或+++,阳性率71%~94%,CD56表达强度呈++或+++,阳性率93%,CD10表达强度呈+,阳性率80%(注:“++”表示中度阳性,阳性细胞数介于25%~75%之间,“+++”表示弥漫强阳性,阳性细胞数>75%)。值得注意的是,SCST中的性索样分化(即粒层细胞和支持细胞)成分可以表达上皮性标记,如广谱CK,但一般不表达EMA、CK7。因此在与各种卵巢上皮性癌(包括原发与转移)鉴别时,不宜选择广谱CK,而是将EMA、CK7与α-抑制素等联合应用。此外,SF-1(类固醇相关因子)也称肾上腺4结合蛋白,是一种核转录因子,可调控与类固醇生成、肾上腺和性腺发育等有关的基因。近期有文献报道SF-1在卵巢SCST中表达率可达100%,可在鉴别诊断中发挥一定作用。由此可见,临床联系病理对于SLCT的诊断尤其重要,MRI影像特征可协助诊断。
刘洋(主任医师、教授):该病例是极具讨论价值的疑难病例。卵巢SLCT的发病率较低,形态学谱系变化多样,一直是妇科肿瘤的难点。本例病例有3点值得思考。1)病例形态不典型,需要借阅以往手术的所有切片,寻找诊断的蛛丝马迹。本例大部分区域为低分化实性区域,少数区域显示网状结构,给诊断带来极大挑战。本例之所以能修正诊断,得益于获得到患者第二次手术的根治性标本,于35张切片中的1张寻找到了典型的Leydig细胞区域(图3),从而修正诊断为SLCT,并通过与临床沟通,获取到患者于第一次手术前可能由于激素改变导致的男性化体征这一重要佐证;2)既往诊断的干扰。本例既往在外院明确诊断为高级别浆液性癌。因此,临床认为肿瘤复发系耐药所致。故而,在会诊切片时,并未嘱患者会诊所有历次手术切片。病理科首次在仅有的一张病理会诊切片基础上,结合外院的免疫组化结果考虑低分化癌,并建议完善病史行免疫组化分型。在没有得到更多切片信息的情况下,依靠有限的免疫组化结果,提出鉴别诊断,并建议会诊历次切片。这表明病理科已经对既往诊断存疑。同时,第一时间联系临床主管医生,表明以患者当年30岁的年龄诊断高级别浆液性癌,且治疗中出现反常的临床进程特点,提示临床警惕SCST可能,建议临床会诊历次手术切片和追问激素相关体征。但是,经过长时间等待后,患者才给病理科送来历次会诊切片,并且临床反馈并未出现激素相关体征。这给第二次会诊带来了巨大挑战;3)诊断中需要多学科协作,准确细致的病史采集。在第三次会诊患者历次手术切片后,病理锁定最终诊断为SLCT后,嘱临床重点询问患者是否出现男性化体征(多毛,原发性闭经等症状),终于在重点突出的询问中采集到阳性体征,反向验证了病理修正诊断的正确。
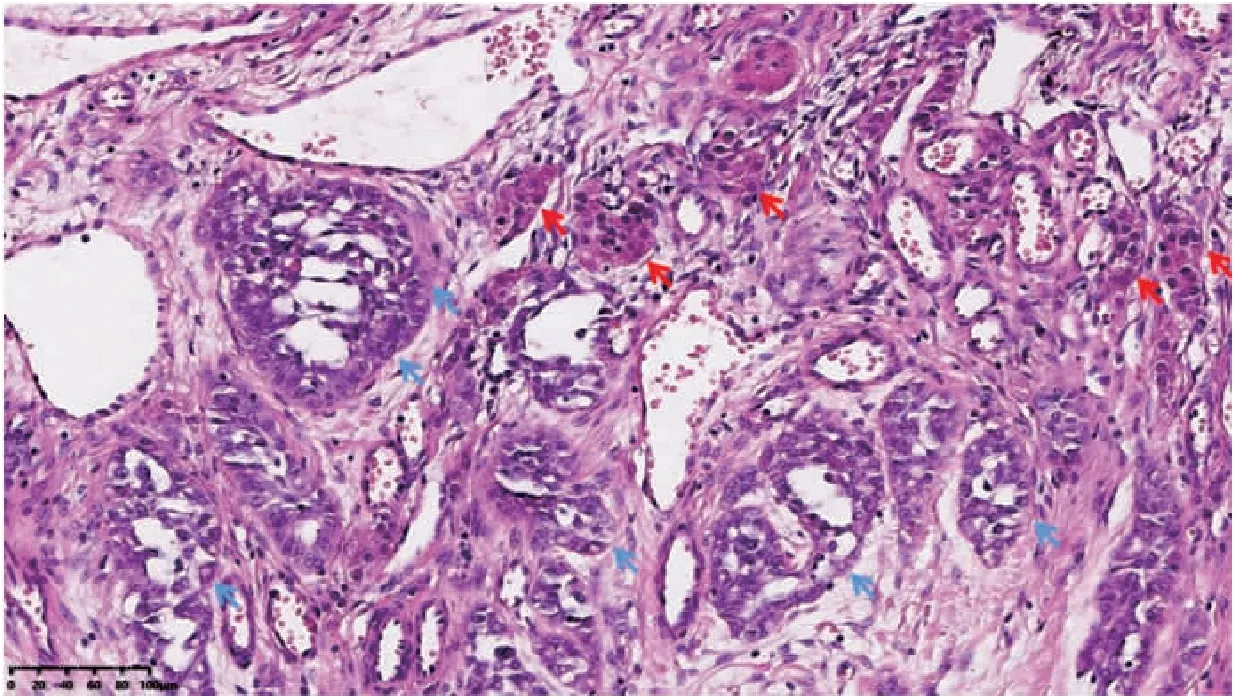
图3 既往手术标本病理切片中典型的Leydig细胞区域(HE染色, ×200)
张国楠(主任医师、教授):前面大家谈了很多关于本例患者诊疗上的经验教训以及卵巢SLCT的疾病特征、诊断及鉴别诊断方法、治疗和预后等。而在实际临床工作中,对于罕见病例SLCT的诊治需要多学科的协作。从该位患者诊疗经过可以看出,患者在2013年初诊时就存在内分泌相关体征及症状,术前完善血清睾酮水平检测、术后结合大体标本形态学可高度疑诊SCST可能,那么当出现病理诊断困难或疑问时,应及时临床病理沟通。此次二次肿瘤细胞减灭术术前我科组织行MDT,包括病理科、影像科、泌尿科、胃肠外科等,手术顺利达到R0,保证了患者的诊断与治疗质量,修正了既往诊断,从而明确了该患者后续的治疗计划。
对于卵巢SLCT的分子生物学及遗传学改变,近年也有学者进行了探索性研究,包括[13]胰岛素样生长因子2和其受体表达上调,Sonic hedgehog途径、氨基酸代谢途径、多种脂肪酸代谢途径及叶酸代谢途径均下调,可有性染色体失常、神经调节肽受体高表达等,但因该肿瘤罕见,样本量少,尚未达成共识。先前的研究表明,约60%的SLCT可能伴有DICER1的体细胞突变[15]。最近的研究发现,49%的中/低分化SLCT患者具有DICER1突变,并在19%的中分化SLCT患者中发现FOXL2突变[16]。同时鉴定SLCT存在(至少)3种分子亚型,即DICER1突变型,DICER1/FOXL2野生型和新型FOXL2突变型,每种亚型均具有独特的临床病理特征。DICER1突变型SLCT患者通常更年轻,并且更常出现雄激素症状、中/低分化程度、具有异源性元素或网状形式的肿瘤;FOXL2突变型SLCT患者常发生在绝经后,这些患者更容易出现异常出血且缺乏雄激素症状、中/低分化程度、但不具有异源性元素或网状形式、且Leydig细胞欠明显;DICER1/FOXL2野生型SLCT患者年龄介于前两者之间,不具有异源性元素或网状形式、常常分化良好。也有报道,卵巢SLCT中,一些相关基因的突变频率更高,如DICER1、PMS2、FOXL2和PALB2,突变率累计可达35.3%。PMS2是一种参与DNA错配修复的基因,与林奇综合征有关[17],FOXL2在卵巢发育和女性生育能力中起着至关重要的作用[18],其突变被认为是成人型颗粒细胞瘤发病机制的潜在驱动因素[19],PALB2与BRCA2是参与同源重组介导的DNA修复机制的重要组成部分,PALB2的杂合种系突变导致乳腺癌和胰腺癌的易感性增加[20- 21]。我们是否能从该患者的案例分析中得出类似的结论,尚需要进一步的研究。
患者下一步的治疗?该患者目前诊断卵巢中分化SLCT二次复发化疗后二次肿瘤细胞减灭术后1周期化疗后,患者目前病情稳定,复查各项肿瘤标志物均在正常值范围内,需继续补充2~3周期TC方案化疗。因患者为二次复发,既往多次使用TC方案化疗,若后续治疗效果不佳抑或复发,可以考虑更换BEP或EP方案化疗,二线化疗方案可选用多西他赛、紫杉醇+异环磷酰胺、长春花碱+达卡巴嗪+环磷酰胺等,该患者既往病理切片肿瘤细胞免疫表型提示ER(灶区+)、PR(-),如后续出现疾病进展或再次复发,亦可尝试使用激素治疗,必要时可加靶向药物治疗,如贝伐珠单抗。此外,也可尝试进行靶向放射治疗[12]。目前该患者于2021-12至2022-02已完成3周期TC方案化疗,结合患者治疗意愿及病史,同期加用贝伐珠单抗,复查肿瘤标志物均在正常值范围,2022-02-23复查MRI平扫+增强示未见异常,专科查体见阴道残端光滑,盆腔未扪及明显结节包块。遂于2022-03继续使用前次方案化疗1周期,2022-03-24复查彩超未见异常。
归纳总结,卵巢SLCT是一种少见的SCST,在临床工作中容易被忽略,此病多发于年轻女性,发现时多为早期,但术前诊断较困难,重视患者的内分泌相关体征和症状及影像学特征有助于早期识别此病,另结合术后肿瘤大体标本及形态学特征、必要时行相关免疫组化辅助可鉴别诊断。该病例提醒妇科肿瘤医生应该重视诊疗过程中的每一个环节及细节,稍有疏忽即可能造成漏诊、误诊;另外,MDT合作诊疗可以保证高质量的诊治建议和治疗计划,避免误诊误治,使患者收益最大化。术前及时、正确认识及诊断该病有助于为患者选择最合适的治疗方案,以提高患者的预后。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

