宫腔镜切除经聚焦超声消融降型后子宫肌瘤(FIGO II~III)的疗效及安全性临床研究*
吴敏,何玉春,何佳,陈泽,王雅溱,李晓辉,张代碧,李海燕,郭旭,冉峰,雷婷婷
629000四川 遂宁,遂宁市中医院暨遂宁市妇幼保健院 妇产科
子宫平滑肌瘤是最常见的女性生殖系统良性肿瘤之一,其发病率在不同种族存在差异,但普遍认为育龄期妇女的25%~40%罹患子宫肌瘤[1]。子宫肌瘤的临床表现有经量增多、经期延长、贫血、尿频、尿急,甚至影响女性的生育状况,造成不孕、流产和早产等。子宫肌瘤引起的症状与位置和大小有关,针对不同位置的子宫肌瘤,常采取不同的治疗方式。
根据国际妇产科联盟(Federation International of Gynecology and Obstetrics,FIGO)对子宫肌瘤的分型描述,0型为带蒂黏膜下肌瘤,Ⅰ型、Ⅱ型为无蒂黏膜下肌瘤,其中Ⅰ型子宫肌瘤体积向肌层扩展≤50%,Ⅱ 型子宫肌瘤体积向肌层扩展>50%,Ⅲ型肌瘤为紧贴子宫内膜的肌壁间肌瘤,瘤体外缘距子宫浆膜层≥5 mm[2]。宫腔镜下子宫肌瘤电切术(transcervical resection of myoma,TCRM)通过人体自然腔道,能切除部分0~Ⅱ型肌瘤,因其具有低创伤、出血较少、保护子宫肌壁解剖学结构、手术时间短、快速恢复、并且能够缩短术后等待妊娠时间等优点,近年来已成为黏膜下肌瘤的标准术式[3]。但对于肌瘤直径过大(>5 cm)、肌瘤分型较高(≥Ⅲ型)及肌瘤内血供丰富的病灶,直接经宫腔镜下切除手术困难大、时间长、出血多[4]。对于肌壁间肌瘤(Ⅲ型)或体积过大的黏膜下肌瘤(FIGO Ⅰ~Ⅱ型)的处理,宫腔镜存在禁忌症,常采用经腹或腹腔镜行肌瘤剔除术,没有生育要求者行子宫切除术。但经腹或腹腔镜下肌瘤剔除术会破坏浆肌层,延长术后等待妊娠时间,增加妊娠期子宫破裂等不良妊娠结局的发生率,且腹腔镜对于未凸向于浆膜层肌瘤治疗存在一定局限性。虽然全子宫切除术可彻底治愈子宫肌瘤,但手术创伤较大、术后改变女性正常解剖结构、影响女性内分泌功能、丧失生育力以及有导致盆腔粘连风险[5]。遂宁市中医院前期研究显示:经过聚焦超声消融手术(focused ultrasound ablation surgery,FUAS)预处理,可使部分Ⅱ~Ⅲ型(FIGO分型)肌瘤凝固坏死的同时实现快速降型,即Ⅱ型、Ⅲ型肌瘤降型为Ⅰ型、Ⅱ型肌瘤,使部分不具备TCRM适应证的Ⅱ型和Ⅲ型肌瘤患者获得TCRM的机会。可在去除病灶的同时保留子宫浆肌层完整性,缩短术后等待妊娠时间,同时可以获得病理诊断[6]。虽然有前期FUAS对子宫肌瘤降型的可行性及初步降型率的相关研究,但子宫肌瘤FUAS降型后行TCRM切除的治疗方式尚无相关安全性及疗效分析报道。
本文拟通过回顾性研究,将TCRM切除子宫黏膜下肌瘤(FIGO 0~Ⅱ)作为对照组,与经FUAS降型后接受TCRM切除子宫肌瘤(FIGO Ⅱ~Ⅲ型)的治疗情况进行比较,进一步探索FIGO Ⅱ~Ⅲ型子宫肌瘤降型后行TCRM手术的临床疗效及安全性。
1 资料与方法
1.1 一般资料
1.1.1 研究对象 将2020年1月至2022年1月在遂宁市中医院经FUAS降型后行TCRM手术的患者纳入试验组(FUAS+TCRM组),同期符合宫腔镜适应证常规行TCRM的0~Ⅱ型子宫黏膜下肌瘤患者纳入对照组(TCRM组),收集患者肝肾功能、绝育手术史、年龄、BMI、宫腔粘连、术前合并基础疾病情况等临床资料。全部患者在治疗前均签署知情同意书;术前均经宫腔镜+盆腔MRI联合评估肌瘤位置及大小。
1.1.2 纳入排除标准
1.1.2.1 TCRM组筛选标准 1)0型子宫黏膜下肌瘤;2)肌瘤直径≤5.0 cm的Ⅰ~Ⅱ型子宫黏膜下肌瘤;3)有子宫肌瘤伴随临床症状,如经期延长、月经量增多、贫血等;4)具备随访条件。排除标准:1)直径>5 cm的Ⅰ~Ⅱ型(FIGO分型)子宫肌瘤,Ⅲ~Ⅶ型(FIGO分型)的子宫肌瘤;2)有宫腔镜治疗禁忌证:如宫颈无法充分扩张、生殖道感染急性期等;3)严重内科疾病不能耐受手术;4)疑似或确诊恶性肿瘤。
1.1.2.2 FUAS+TCRM组筛选标准 1)肌瘤直径>5 cm的Ⅱ型肌瘤(FIGO分型);2)有症状的FIGO Ⅲ型肌瘤(FIGO分型);3)有子宫肌瘤伴随临床症状,如月经量增多、经期延长、贫血等;4)具备随访条件。排除标准:1)≤5 cm的Ⅰ~Ⅱ型黏膜下肌瘤,0型子宫黏膜下肌瘤,无症状的Ⅲ型肌瘤,Ⅳ~Ⅶ肌瘤(FIGO分型);2)有FUAS或宫腔镜治疗禁忌证:如无法建立安全声通道、宫颈无法充分扩张、生殖道感染急性期;3)严重内科疾病不能耐受手术的;4)子宫腺肌瘤;5)疑似或确诊恶性肿瘤。
1.1.3 手术方法 FUAS治疗:所有患者在治疗前晚口服聚乙二醇电解质散清洁洗肠,行皮肤准备,术前3天膀胱锻炼。治疗前常规备皮,治疗过程中通过灌入温生理盐水调节膀胱容积,以获得安全的声通路。FUAS治疗采用JC200型(中国重庆海扶医疗科技股份有限公司生产)聚焦超声肿瘤治疗系统。FUAS治疗由具有丰富临床经验的专业医生进行,治疗前行机载彩超定位靶区与邻近组织(膀胱、肠管)的关系,制定适当的治疗计划。治疗由病灶深部靠脚侧开始治疗,焦点距离病灶边界至少1 cm。术中根据患者反应以及病灶灰度的变化实时调整声功率及治疗节奏。
TCRM手术均在床旁超声监护下进行。采用Storz单极高频电发生器为能源,无糖尿病病史患者膨宫介质使用常温5%葡萄糖,有糖尿病病史使用甘露醇为膨宫介质。膨宫压力通常为80~100 mmHg,灌流液流速通常为260~400 mL/min,电切功率约80 W,电凝功率约60 W。术前晚于宫颈管内放置一次性使用宫颈扩张用模具预处理,术时患者取膀胱截石位,采用插管全身麻醉,取出宫颈管内宫颈扩张模具,常规消毒铺巾,依次扩张宫颈至11~12号扩宫棒,置入宫腔镜电切装置,行TCRM手术。
FUAS+TCRM组均于FUAS术后1~4日内行宫腔镜检查,若降型成功,则行TCRM。于肌瘤表面切割划开内膜及肌层,若肌瘤凸向宫腔不明显,使用静滴缩宫素或泵入垂体后叶素或通过电切镜进出宫腔,暂停操作,改变宫内压,促使子宫收缩进而挤压肌瘤凸向宫腔,然后逐步电切、卵圆钳夹取肌瘤组织。术后宫腔内安置球囊压迫止血(非常规)。术中持续心电监护监测生命体征,每半小时行动态血气分析检测电解质及指尖血糖,记录膨宫液出入量,出现电解质紊乱或水中毒等即刻停止手术。
TCRM组:常规行TCRM治疗,对于0型黏膜下肌瘤,宫腔镜下找到肌瘤根蒂部进行切割,钳夹取出瘤体即可,肌瘤体积较大无法直接夹取出时,在宫腔内将瘤体进行分次切割后再切断瘤蒂夹出。Ⅰ~Ⅱ型黏膜下肌瘤:电极在肌瘤侧方表面交替切割,在瘤体表面形成沟槽样结构,然后用卵圆抓钳钳夹并取出瘤体。切割过程中若无法完全切除,术中酌情泵入缩宫素或垂体后叶素促进子宫收缩,使得肌瘤组织突出于宫腔便于完全切除。
1.2 监测指标
1)一般情况:对患者年龄、BMI、术前宫腔粘连情况、基础疾病情况、肌瘤体积进行对比分析;2)TCRM手术时间:根据麻醉记录单上记录的手术开始、结束时间作为手术时间;3)TCRM术中出血量:通过术前术后血红蛋白变化情况及术中出血情况评估出血量;4)病灶大小:通过MRI检查测量三径值,左右径(L)、前后径(W)、上下径(D),肌瘤体积计算公式:0.5223×L×W×D(cm3);5)膨宫液:统计术中使用膨宫液量(L);6)并发症:TCRM术中每隔30 min行血气分析及指尖血糖检测,记录发生相应并发症时间及并发症类型,包括电解质紊乱、过度水化综合征(transurethral resection of the prostale,TURP)、子宫穿孔等。
1.3 临床疗效评价指标
1)肌瘤切除率:床旁超声联合宫腔镜术后即刻评估宫腔内肌瘤切除率;2)临床症状改善情况:采用子宫肌瘤健康相关生活质量问卷(UFS-QOL量表)及月经量PBAC量表进行评估。
1.4 统计学方法
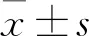
2 结 果
2.1 人群特征
共81例患者符合筛选条件,纳入分析,其中TCRM组患者53例,FUAS+TCRM组28例。所有患者肝肾功能正常,无绝育手术史。两组患者的年龄、BMI、宫腔粘连、基础疾病情况差异均无统计学意义(P>0.05);FUAS+TCRM组病灶体积[35.65(18.98~73.38)]cm3明显大于TCRM组[6.11(1.09~11.80)]cm3,差异有统计学意义(P<0.01)(表1)。
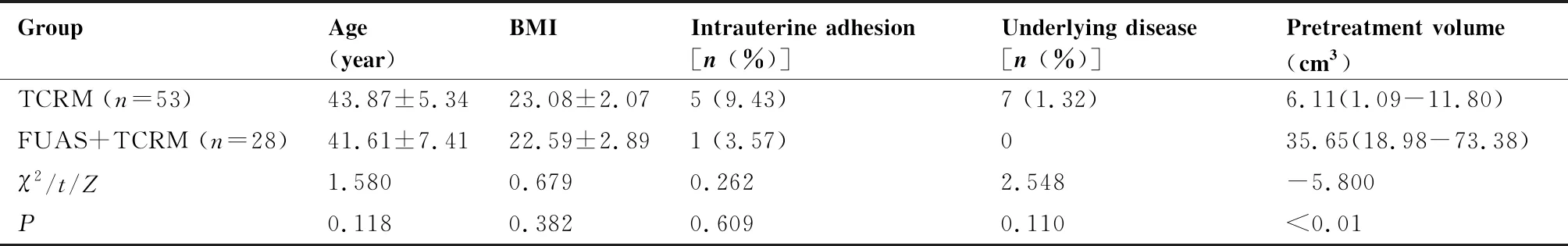
表1 两组患者的一般情况对比
2.2 手术情况
手术时间:FUAS+TCRM组所使用手术时间[56.50(42.25~74.50)]min明显长于TCRM组[35.00(28.00~48.00)]min,差异有统计学意义(P<0.01)。膨宫液量:FUAS+TCRM组所使用膨宫液量[13.50(4.25~20.00)]L多于TCRM组[7.25(4.75~10.00)]L,差异有统计学意义(P=0.011)。两组患者的术中出血量[40.00(10.00~55.00) mLvs30.00(20.00~50.00) mL]差异无统计学意义(P=0.656)(表2)。

表2 两种治疗方式的术中情况对比
TCRM组中有2例因发生水中毒即刻停止手术操作,肌瘤未完全切除。 FUAS+TCRM组中有2例未达到一次性完全切除,这两例病例肌瘤体积均超过150 cm3,其中1例因术中发生低钠血症,即刻终止手术,肌瘤残留约50%,1例因肌瘤体积过大(189.49 cm3)、手术时间过长、术中使用膨宫液超25 000 mL,终止手术,择期行第二次手术切除完全。两种治疗方式的切除率比较差异无统计学意义(96.22%vs96.42%,P=1.000)(表3)。
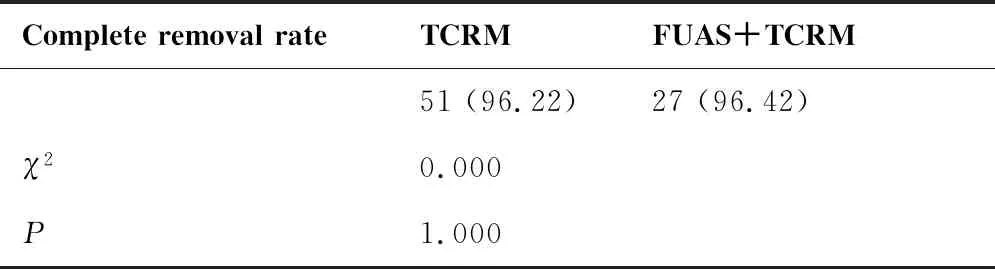
表3 两组治疗方式子宫肌瘤切除率比较N(%)
2.3 PBAC评分情况
同组患者比较其术前术后的PBAC评分,差异均具有统计学意义(P<0.01),说明经过两种治疗方式,两组患者月经量情况均得到显著改善;横向比较两组患者间术前PBAC评分,FUAS+TCRM组术前月经PBAC评分值高于TCRM组,差异有统计学意义(P=0.019),而两组患者间术后PBAC值差异无统计学意义(P=0.145),表明FUAS+TCRM组患者术前月经量多、贫血等症状更严重,而术后两组患者月经情况对比差异无统计学意义(表4)。

表4 两种治疗方式月经量改变情况PBAC评分
2.4 生活质量情况
同组患者的术前、术后UFS-QOL评分比较,差异均有统计学意义(P<0.01),表明两种方式均能改善患者UFS-QOL生活质量评分;横向比较,两组患者间术前UFS-QOL评分差异均无统计学意义(P>0.05),经过不同治疗方式后,两组患者间的术后UFS-QOL评分差异无统计学意义(P>0.05)(表5、6)。

表5 两种治疗方式子宫肌瘤健康相关生活质量问卷评分比较(UFS部分)

表6 两种治疗方式子宫肌瘤健康相关生活质量问卷评分比较(QOL部分)
2.5 并发症情况
两种治疗方式的并发症(包括:TURP、术中电解质紊乱、子宫穿孔、术后感染、术后宫腔粘连)发生率差异均无统计学意义(P=1.000)(表7)。
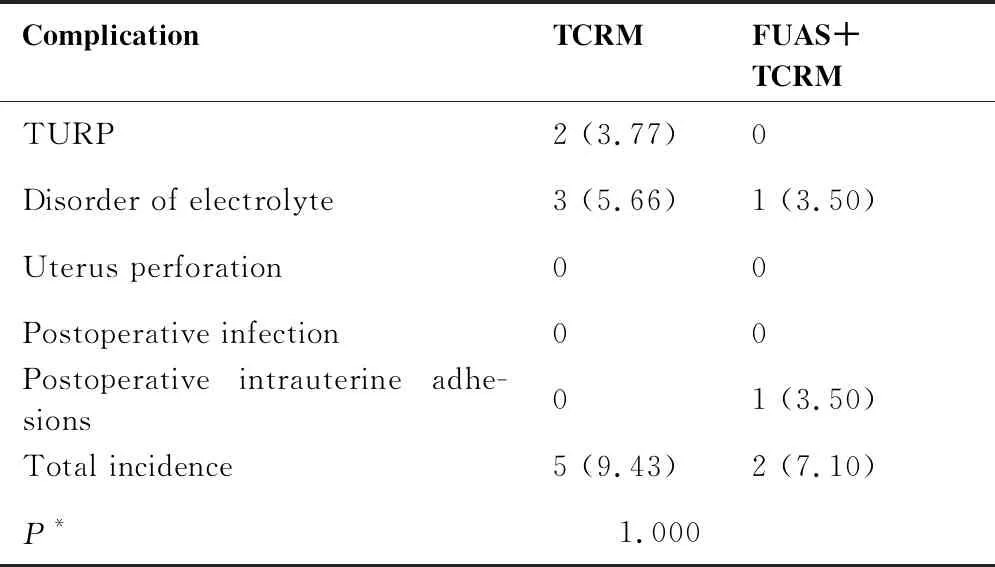
表7 两组治疗方式并发症统计N(%)
3 讨 论
3.1 TCRM治疗子宫黏膜下肌瘤的适应证及局限性
目前公认子宫黏膜下肌瘤的标准术式为TCRM,该手术方式能够有效缓解子宫肌瘤所致月经异常等临床症状,可恢复患者的生育功能、改善因黏膜下肌瘤所致的妊娠疾病[3]。临床研究表明,TCRM手术对于月经症状的缓解率约70%~99%[7-9],能有效改善患者经量增多、阴道流血、排液、感染等症状,其疗效患者满意。对于有生育要求的患者,在术后较短时间内即可妊娠[3],且不必承担妊娠期不良结局,如子宫破裂等风险。但子宫肌瘤经宫腔镜治疗适应证有其明显的局限性,对于肌瘤体积过大、直径>5 cm、血供丰富的黏膜下肌瘤,紧贴内膜的有症状的子宫肌瘤(FIGO Ⅲ型),宫腔镜手术难度大,并发症明显增加,存在较多手术禁忌证。前期文献报道,有学者回顾性分析了13例有症状的Ⅲ型子宫肌瘤单纯接受宫腔镜治疗的术后效果[10],有3例出现术后阴道大量出血,4例接受二次手术,3例发生宫腔粘连,研究证实手术难度较高,需要有经验的医师操作,在临床诊疗中不易推广。
3.2 巨大子宫黏膜下肌瘤术前预处理方式前期临床研究
临床研究表明,通过对较大的子宫黏膜下肌瘤进行术前预处理,使肌瘤缩小后再进行手术,可降低TCRM手术难度、减少术中出血量及并发症的发生[11],增加一次性切除率及减少宫腔粘连,对于保护患者生育功能、保护器官完整性具有重要的意义[12]。术前使用促性腺激素释放激素激动剂(gonadotropin releasing hormone agonist,GnRH-a)预处理后,可抑制肌瘤生长,有缩小肌瘤的效果。研究显示,GnRH-a预处理3~6个疗程肌瘤缩小20%~77%[13-14]。但GnRH-a预处理仅能缩小肌瘤体积,但不能减少血供,TCRM治疗过程中若破坏大血管仍有较高的TURP综合征发生风险,同时GnRH-a属于强效HPO轴抑制剂,患者容易出现低雌激素综合征,如潮热、盗汗、失眠等不良反应。因体内低雌激素环境,TCRM术后内膜菲薄,生长缓慢,发生宫腔粘连的几率升高[15]。部分对于GnRH-a不敏感的肌瘤可能瘤体缩小不明显,常常需要等待较长时间,影响患者生活质量[7、9-10]。此外,也有采用 OPPIuM技术,即宫腔镜下切除肌瘤部分包膜,等待2月后肌瘤凸向宫腔降型后争取TCRM机会,但该研究成功的肌瘤体积较小,直径为(2.9±0.8) cm,2例失败病例中,肌瘤直径均>4 cm[16],对于更大的肌瘤是否同样有效,目前尚未见相关临床研究报告。目前临床疗效确切、可操作性强、副反应小的预处理方法尚未明确。
3.3 FUAS治疗子宫肌瘤原理及降型作用的初步研究
FUAS治疗子宫肌瘤的临床疗效已得到广泛认可,其原理是利用超声波在人体的良好穿透性,将超声波能量聚焦于体内肌瘤靶点上,通过将超声波的机械效应转化为热效应,使焦点处肌瘤组织温度瞬间升至60~100℃而发生凝固性坏死,从而实现体外对体内病灶的精准治疗,并且不损伤周围正常组织。FUAS治疗后,坏死的肌瘤组织可被周围结构吸收,病灶缩小,从而达到缓解症状的目的[17-18]。前期本中心在FUAS治疗子宫肌瘤临床研究中发现[6],FIGO Ⅱ~Ⅲ型子宫肌瘤经FUAS治疗后不仅能达到无创消融的作用,还具有对肌瘤快速降型的效果。其原理为:FUAS治疗后使≥5 cm的Ⅱ型肌瘤以及部分Ⅲ型肌瘤(贴近内膜)降型为Ⅰ型、Ⅱ型,消融降型后肌瘤凸向宫腔,且肌瘤包膜大部分血供被消融,使得肌瘤经宫腔镜下切除成为可能。
3.4 经TCRM途径切除FUAS降型后的子宫肌瘤(FIGO Ⅱ~Ⅲ)的疗效及安全性探讨
本研究显示,经过FUAS的预处理,肌瘤消融后可达到快速降型的目的,使患者短时间内即可获得TCRM的机会。本研究结果显示:FUAS+TCRM组治疗前肌瘤体积[35.65(18.98~73.38)] cm3显著大于TCRM组[6.11(1.09~11.80)] cm3,手术时间[56.50(42.25~74.50)minvs35.00(28.00~48.00) min]及术中使用膨宫液量[13.50(4.25~20.00)Lvs7.25(4.75~10.00)L]也均明显高于常规TCRM手术,但两组患者的术中出血量、术中术后并发症发生率差异无统计学意义,显示FUAS通过消融肌瘤,使肌瘤发生凝固性坏死,阻断肌瘤血供,从而降低TCRM术中出血风险,保持术中术野清晰,一定程度上降低了宫腔镜手术难度,而没有增加宫腔镜手术并发症的发生率。研究同样证实,两组患者术后1~12月随访中,患者子宫肌瘤伴随症状(UFS-QOL量表、月经PBAC评分)均得到缓解,生活质量明显改善。此外,FUAS对于肌瘤的快速降型作用,缩短患者等待手术时间,减少了患者在肌瘤降型过程中发生排瘤等不适感,同时减少此过程中子宫内膜感染,伴发宫腔粘连的风险。因此本研究认为,FUAS+ TCRM作为一种新型的安全、有效的治疗方式,临床疗效确切,为此类非宫腔镜适应证的肌瘤患者(≥5 cm的Ⅱ型肌瘤以及贴近内膜的Ⅲ型肌瘤)提供了新的治疗决策。对于短期内有妊娠需求的女性来说,缩短了术后等待妊娠时间,本研究随访过程中发现已有1例患者成功妊娠并生产。
3.5 本研究不足之处
本研究仍有以下不足之处:1)本研究为回顾性研究,筛选纳入的患者的基线资料存在偏差,可能影响研究结果;2)本研究因纳入病例较少,无法进行多因素统计分析,统计方法存在一定局限性,拟在后续研究中收集大样本进行进一步统计分析;3)本研究术后随访时间尚短,仅对术中情况及术后(1~12月)并发症进行回顾性研究分析,对于术后远期内膜恢复情况,尤其是妊娠率及妊娠结局等,缺乏进一步的随访数据;4)本研究初步结果显示FUAS治疗使体积较大的Ⅱ型及贴近内膜的Ⅲ型肌瘤降型后,经TCRM切除的治疗方式安全、可行,后续拟进一步开展前瞻性研究,进行多中心、大样本量、随访时间较长的深入研究。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

