免疫治疗对老年非小细胞肺癌合并COPD病人气道高反应和肺功能的影响
霍树芬 尚文丽 田应选 孙莉 任小平 王君 康慧芳 温红侠
免疫检查点抑制靶向程序性细胞死亡受体1/程序性细胞死亡配体1(PD-1/PD-L1)轴可提高晚期非小细胞肺癌(NSCLC)病人的生存率[1-4]。然而,除了通过激活免疫系统达到所需的抗肿瘤作用外,阻断PD-1/PD-L1轴还会在多器官中产生炎性不良反应,称为免疫相关不良事件(irAE),例如甲状腺炎、垂体炎、结肠炎、自身免疫性糖尿病和肺炎等[5]。由于其在免疫系统中的作用,PD-1/PD-L1轴还参与各种炎症性肺疾病,包括COPD和支气管哮喘[6-8]。
COPD是慢性炎症性疾病,是NSCLC病人最常见的合并症[9]。在COPD病人中,PD-1在CD4+、CD8+和调节性T细胞中过表达,并且在巨噬细胞和树突状细胞中PD-L1表达受损[10], 提示PD-1/PD-L1轴在其发病机理中起重要作用,在COPD病人中进一步抑制受损的PD-1/PD-L1轴可能会增加气道炎症并促进疾病进展[11-12]。因此,阐明免疫检查点抑制对COPD病人肺部炎症和生理的影响具有重要意义。本研究旨在通过前瞻性研究探索抗PD-1/PD-L1治疗是否改变了伴或不伴有COPD的NSCLC病人的气道炎性反应和肺功能,探索其在合并COPD的NSCLC病人中的临床应用价值。
1 资料与方法
1.1 研究对象 收集2018年1月至2020年6月陕西省人民医院呼吸内科住院老年NSCLC病人30例。男23例,女7例;年龄60~80岁,平均(67.2±9.8)岁。收集完整临床资料,所有病人均有病理诊断。根据GOLD 2020指南[13],进行肺功能检查,将研究对象分为COPD组与非COPD组。
纳入标准:(1)均经病理检测证实为ⅢA~Ⅳ期NSCLC或复发性NSCLC病人;(2)年龄>60岁;(3)美国东部肿瘤协作组(ECOG)评分为0~2分;(4)良好的造血、肝肾功能;(5)均完整接受4个周期的免疫治疗。排除标准:(1)合并自身免疫性疾病;(2)合并间质性肺疾病;(3)使用全身性免疫抑制剂;(4)伴随胸腔放疗及先前使用检查点靶向药物治疗。
1.2 整体方案 病人按免疫治疗的诊疗方案,每2周免疫治疗1次,连续治疗4周期。收集病人治疗前后的呼出气一氧化氮(FeNO)值、血常规、肺功能指标。
1.3 药物反应和毒性评估 参考最初用于定义肿瘤范围的计算机断层扫描结果评估肿瘤反应,根据实体瘤版本1.1中的反应评估标准进行评估。分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD),以(PR + SD)例数/总例数×100%计算有效率。
1.4 FeNO和肺功能测定 FeNO和肺功能的测定在同一天进行,FeNO检测后进行肺活量测定,以避免强迫呼吸的任何影响。测试前,禁食和咖啡2 h,禁酒12 h,且保证至少有12 h无短效β2激动剂使用。使用NIOX-VERO分析仪(瑞典索尔纳,Aerocrine)对FeNO进行测量。肺功能测定指标主要为FEV1和FVC。
1.5 改良呼吸困难指数(mMRC)和COPD评估 使用mMRC问卷(5分制)和COPD评估测试(CAT)评估日常生活中的呼吸困难。CAT包括8个项目(咳嗽,咳痰,胸闷,上山/爬楼梯呼吸困难,在家活动受限,出门在外的信心,睡眠和精力),每个项目0~5分,得分从0(最佳健康状态)到40(最差健康状态)不等。
1.6 PD-L1表达 使用PD-1 IHC 22C3 pharmDx分析试剂盒(Dako,北美)对30例病人诊断NSCLC时的肿瘤活检标本的福尔马林固定肿瘤样品中的PD-L1表达进行评估。根据样本中包含的部分,样本分为0(<1%),1+(≥1%和<5%),2+(≥5%和<50%)及3+(≥50%),至少评估100个肿瘤细胞。
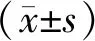
2 结果
2.1 临床特征 30例NSCLC病人均接受免疫治疗4个疗程,其中19例伴有COPD,11例未伴有COPD。2组病人基本资料比较,差异均无统计学意义(P>0.05)。见表1。

表1 2组基本资料比较(n,%)
2.2 治疗效果 COPD组PR 2例,SD 8例,PD 9例,有效率为52.63%;非COPD组PR 6例,SD 4例,PD 1例,有效率为90.91%,2组间比较,差异有统计学意义(P<0.05)。
2.3 2组治疗前后相关指标分析 治疗前,2组FeNO水平差异无统计学意义(P>0.05);治疗后,COPD组FeNO水平较治疗前显著升高,且明显高于非COPD组,差异均有统计学意义(P<0.01)。在肺功能指标方面, COPD组治疗后FEV1、FVC水平较治疗前明显升高(P<0.05)。2组治疗前后CRP、IgE水平及mMRC问卷评分或CAT评分差异均无统计学意义(P>0.05)。见表2。
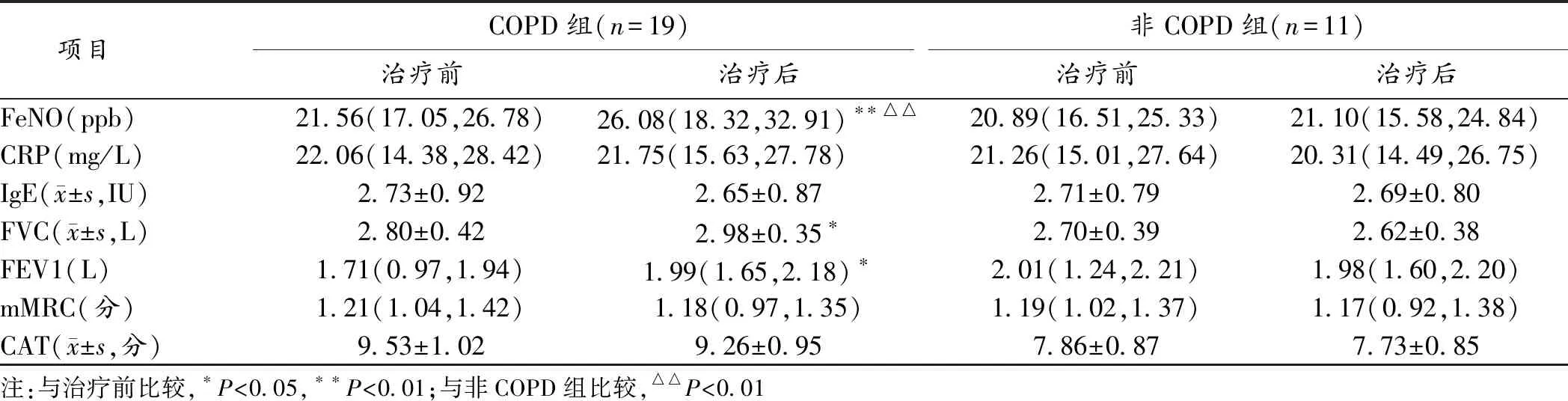
表2 2组治疗前后相关指标比较[M(P25,P75)]
2.4 安全性评价 主要不良反应有腹泻、疲劳、甲状腺功能减退等,2组不良反应发生情况比较,差异无统计学意义(P>0.05)。见表3。
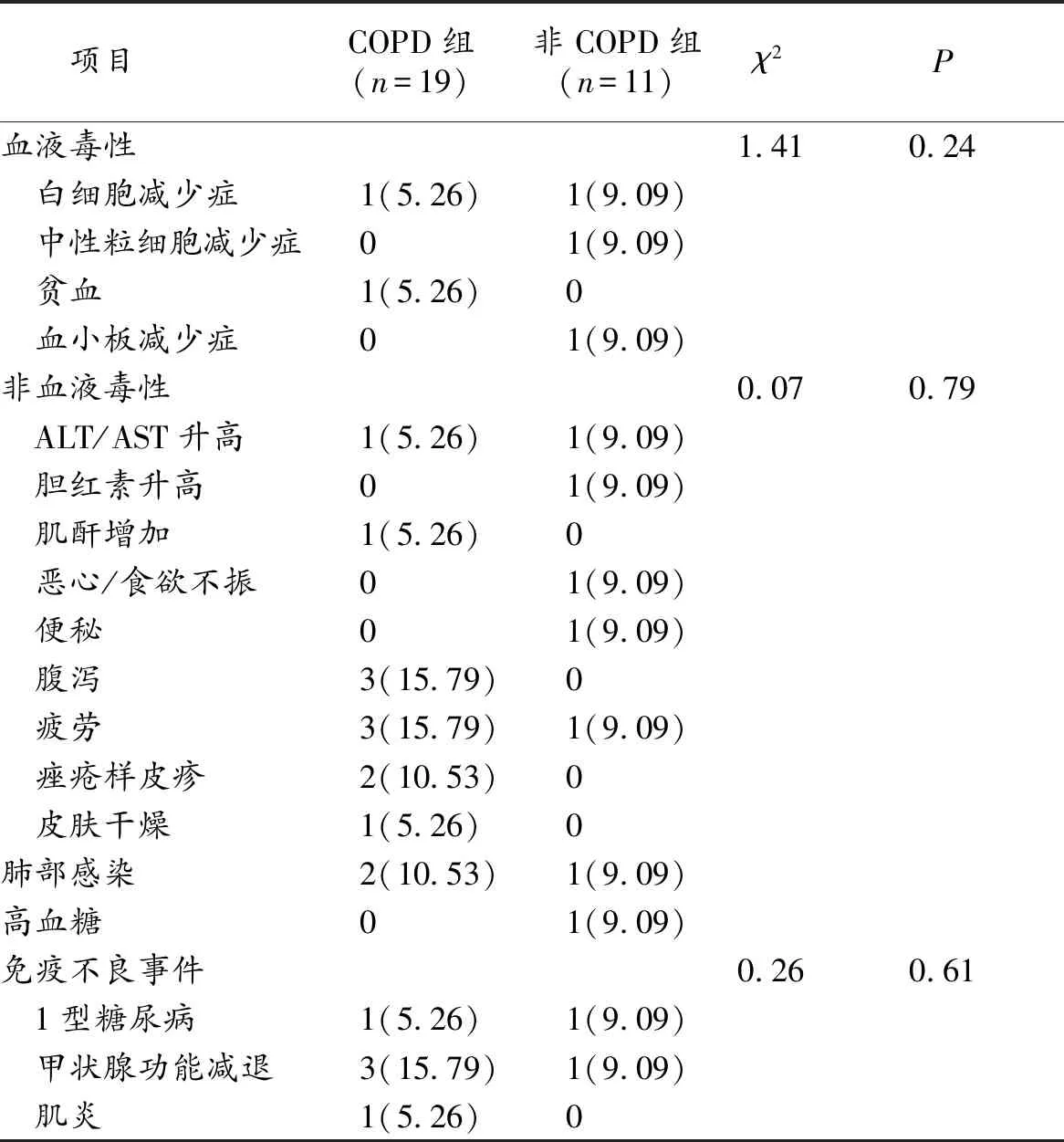
表3 2组免疫治疗期间的不良反应比较(n,%)
3 讨论
肺癌已成为发病率最高的肿瘤,也是恶性肿瘤死亡原因之首,其中以NSCLC最为常见。约50%的肺癌病人确诊年龄在65岁以上,80%以上的肿瘤相关死亡发生在60岁以上人群[13-14]。COPD是NSCLC病人非常常见的共病,尤其是老年病人。PD-1/PD-L1抑制剂对NSCLC有效,但该类免疫药物对COPD的不良影响目前尚不清楚。最近有报道显示,PD-1轴参与COPD,提示抑制PD-1轴可能增强COPD病人的肺部炎症,从而导致肺部生理功能恶化[15]。McKendry等[16]和Stoll等[17]的研究显示,PD-1/PD-L1抑制剂对NSCLC获益的同时必须与COPD共病的潜在危害影响进行权衡。
本研究通过对单中心临床病例进行前瞻性研究,旨在观察抗PD-1/PD-L1治疗对NSCLC伴或不伴COPD病人肺部炎症和肺功能的影响。在气道炎性反应方面,FeNO可反映Th2气道炎症,本研究中COPD组受试者在连续4个周期的抗PD-1/PD-L1治疗后, FeNO水平升高显著,但原因尚不清楚。有研究表明,FeNO在非Th2炎症性疾病(例如超敏性肺炎、肺结核和某些病毒感染)中也增加,其中NO的主要来源被认为是巨噬细胞和其他表达高水平诱导型一氧化氮合酶(iNOS)的免疫竞争细胞[18-19]。因此,PD-1/PD-L1抑制剂可能会增强COPD病人肺部的非Th2炎症,从而导致FeNO升高[15]。但本研究中,未使用支气管肺泡灌洗(BAL)或肺活检评估肺部炎症,该结论有待进一步研究证实。
最近的研究揭示,COPD病人的肺内积累了大量表达PD-1的细胞毒性T细胞(CTL)以及免疫抑制调节性T细胞和髓样来源的抑制细胞。这些T细胞具有免疫调节作用,可能通过细胞毒性免疫功能障碍和异常的免疫调节在COPD恶化中发挥作用[20-21]。提示抗PD-1/PD-L1治疗可能会改善COPD中的这种免疫功能障碍。本研究显示,抗PD-1/PD-L1治疗可显著增加COPD病人的FVC和FEV1,并通过mMRC问卷和CAT评分对呼吸困难进行了主观评估,结果2组得分差异均无统计学意义,且在治疗期间无COPD急性加重情况发生。这些观察结果表明,抗PD-1/PD-L1治疗尽管使FeNO含量增加,但并不会使COPD恶化,推测抗PD-1/PD-L1治疗在NSCLC合并COPD病人中具有较高的安全性。以上结论与抗PD-1/PD-L1治疗可能会改善COPD中的T细胞免疫功能障碍机制具有一致性。
但本研究为单中心小样本研究,具有一定的局限性。虽然抗PD-1/PD-L1治疗后FeNO和肺功能的变化很明显,但仍有待进一步多中心、扩大样本量,联合BAL和(或)肺活检的评估,以了解其机制。其次,本研究未观察到在治疗期间出现COPD急性加重,可能与观察期相对较短(8~10周)有关。本研究仅纳入了抗PD-1/PD-L1治疗4个周期的病例,对于更多周期抗PD-1/PD-LI治疗对肺功能的影响仍有待进一步观察研究。
总之,本研究前瞻性地探索了抗PD-1/PD-L1治疗对NSCLC合并COPD病人呼吸系统的影响,提示抗PD-1/PD-L1治疗可能不会使COPD恶化,对NSCLC合并COPD病人进行抗PD-1/PD-L1治疗的安全性提供一定的依据。

