血小板反应蛋白1与老年脑卒中继发癫痫的炎症反应及认知损害的相关性研究
王为 赵蒙 李昀 殷宏宇
脑卒中后癫痫(post-stroke epilepsy,PSE)是缺血性脑卒中常见的神经系统并发症[1],可严重影响病人的神经功能,导致预后不良[2]。外泌体是内皮衍生的胞外囊泡,因其具有良好的结构稳定性和生物学特性,已经成为多种疾病最具潜力的生物标志物之一。Lin等[3]基于蛋白质组学研究,证实血清外泌体蛋白血小板反应蛋白1(thrombospondin-1,TSP-1)在癫痫人群和健康人群中存在差异性表达。TSP-1是转化生长因子(TGF)的主要活化剂,也是介导炎症反应的重要因子,可诱导受损组织产生强烈的趋化反应。从生理学上讲,局灶性或全身性非调控的炎症过程可导致神经连接异常和神经元网络超兴奋,从而介导癫痫的发生[4]。本研究旨在分析TSP-1表达变化与PSE发生的相关性,为进一步阐述PSE的发生机制以及寻找临床生物标志物提供新的循证医学证据。
1 对象与方法
1.1 研究对象 本研究属于单中心、前瞻性队列研究,选取204例于2018年1月至2019年6月在我院急诊就诊的老年缺血性脑卒中病人,男130例,女74例,年龄63~89岁,平均(73.59±14.13)岁,发病至入院时间≤7 d;符合《中国急性缺血性脑卒中诊治指南2018》[5]中对脑卒中的诊断。PSE定义为脑卒中7 d后有2次自发性癫痫发作或1次癫痫发作加上脑电图显示的癫痫样放电或经头颅多模式核磁共振(mMRI)显示的持久相关病变[6]。癫痫持续状态定义为单次癫痫发作持续超过5 min或者在5 min内连续发生≥2次发作且不能恢复正常意识。纳入标准:60~90岁,有明确的缺血性脑卒中病史;符合PSE的诊断标准;临床资料完整。排除标准:(1)有颅脑外伤史、热性惊厥痉挛或癫痫史;(2)合并进行性神经系统疾病、经影像学证实存在颅内占位性病变、精神病史;(3)合并自身免疫性疾病、血液系统或其他恶性肿瘤疾病;(4)合并心、肝、肾、血液等系统严重功能障碍。所有病人及家属均对本研究知情且签署知情同意书,本研究方案经伦理委员会及机构审查委员会审批备案,所有研究人员均遵循《赫尔辛基宣言》。
1.2 基线数据和样本采集 收集研究对象的一般资料,包括脑卒中病史、血管疾病的危险因素(如高血压、糖尿病、心室颤动、高脂血症、冠状动脉疾病、吸烟和脑卒中史)、病因、脑电图、影像学和临床实验室检测结果,包括估算的肾小球滤过率(eGFR)、Hb、血清肌酐(sCr)、FPG、TC、TG、LDL-C、HDL-C以及血清炎症因子IL-6、TNF-α、转化生长因子-β1(TGF-β1)水平。在病人入院时和确诊PSE时采集外周静脉血,分离并提纯血清外泌体后,保存在-80 ℃。收集病人的NIHSS评分,病灶部位及病灶数。
1.3 随访 对所有病人出院后进行为期2年的随访观察,在出院时以及随访结束时由同一组接受过专业培训的研究人员采用MMSE评价认知功能,计算MMSE差值(MMSE差值=随访2年后MMSE评分-出院时MMSE评分),当差值为负数时认为病人出现了认知损害。
1.4 研究方法
1.4.1 血清外泌体的获取及鉴定:所有病人入组当天采集外周静脉血15 mL置于离心管中,室温下静置30 min,待血液凝固后使用离心机3000 r/min离心10 min,获取上清液并置于-80 ℃冰箱中储存待测。使用外泌体分离试剂盒(Invitrogen Life Technologies公司,美国)按说明书方法以10 000 r/min超速离心30 min,去除细胞及碎片后,将外泌体分离试剂与收集的上清液充分混合,并在4℃环境下孵育30 min。之后,在室温下以100 000 r/min二次离心5 min,收集管底沉淀外泌体,再次120 000 r/min离心30 s除去沉淀中多余液体,然后用磷酸盐缓冲液重悬。用透射电镜观察颗粒结构和分布。采用流式细胞术检测外泌体标记物CD9、CD63、CD81、CD31、Rab5b表达。
1.4.2 Western blot法检测外泌体TSP-1蛋白表达:采用RIPA蛋白质提取试剂盒(碧云天生物技术公司,中国)提取外泌体中的蛋白质,使用增强型蛋白质测定试剂盒(Thermo Scientific公司,美国)测定蛋白质浓度,在10%十二烷基硫酸钠-聚丙烯酰胺凝胶进行电泳分离,然后半干法将目标蛋白条带转移到聚偏二氟乙烯膜上,将该膜与TSP-1(1:2000)、GAPDH(1:5000)一抗分别孵育过夜,与二抗孵育60 min。通过电化学发光法及Image J软件进行分析。
1.4.3 ELISA检测血清外泌体TSP-1蛋白水平:将提取的血清外泌体总蛋白,进一步使用MK3酶标仪(Thermo Scientific公司,美国)和TSP-1 ELISA试剂盒(武汉伊莱瑞特生物科技股份有限公司)进行检测。在酶标板上每孔加入100μL样品或标准品,37℃孵育10 min,加入100μL浓缩生物素化Ab,37℃孵育60 min,洗涤3次。然后将100μL抗生物素-生物素-过氧化物酶复合物加入至每个孔中,37 ℃反应30 min。加入四甲基联苯胺37 ℃避光孵育15 min,终止反应后,读取450 nm处的光密度值(OD)。
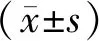
2 结果
2.1 血清外泌体提取和鉴定 经透射电镜观察,可见圆形或椭圆形、茶托状、双膜囊泡状结构,直径为30~150 nm,粒子浓度约为(4.44±0.34)×108/mL。经流式细胞术检测,在分离的外泌体颗粒样本中出现外泌体CD9、CD63、CD81、CD31、Rab5b膜表面标记分子表达,说明获取的血清外泌体可用于蛋白检测。见图1。
2.2 2组病人一般临床资料比较 2组病人在饮酒史、发热、低钙血症、NIHSS评分、病灶累及皮质及eGFR、 IL-6、TGF-β1、TNF-α水平方面差异有统计学意义(P<0.05)。见表1。
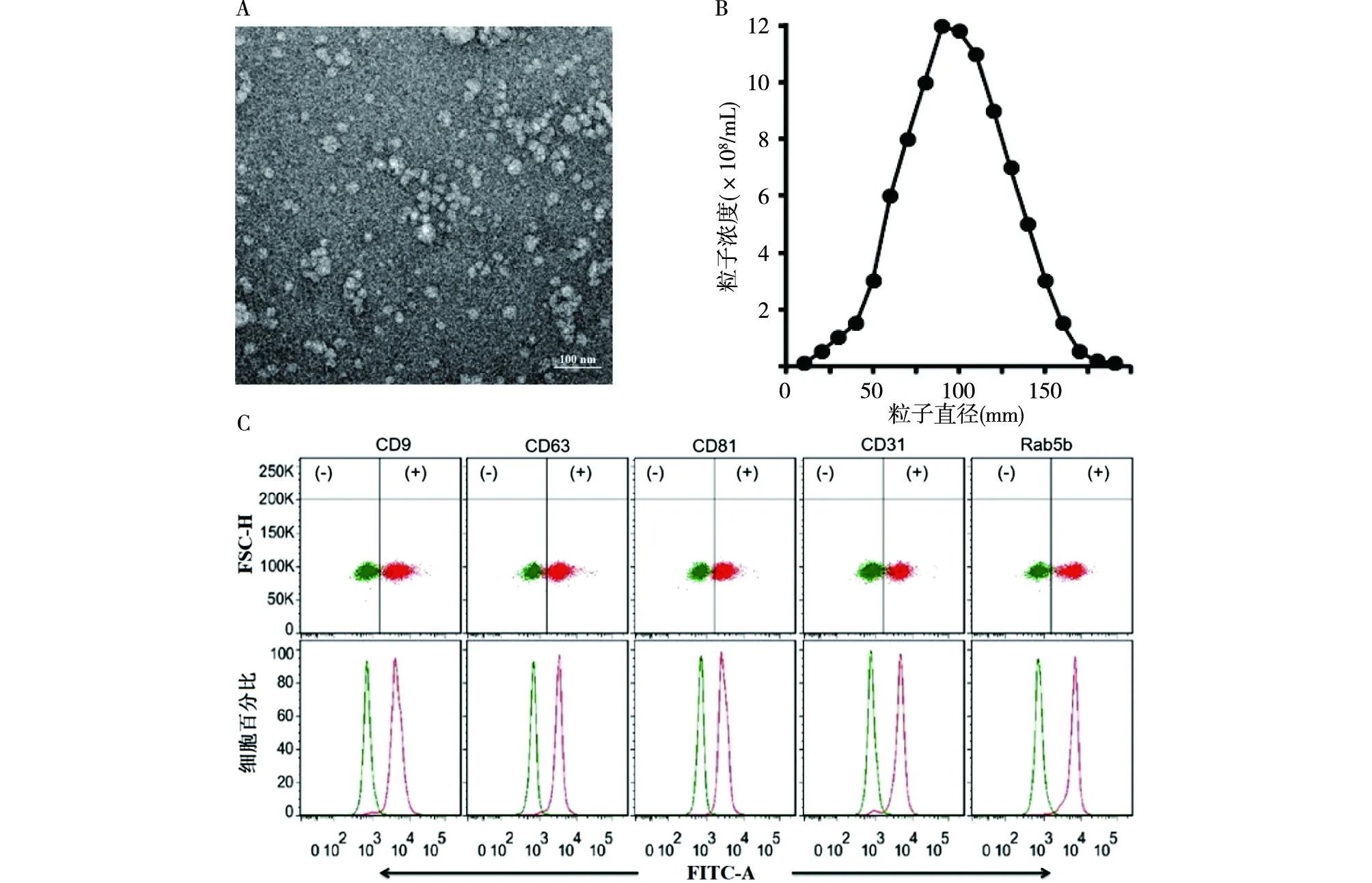
注:A:透射电镜下观察外泌体颗粒形态和大小(×12000); B:纳米粒径追踪分析外泌体粒径分布;C:流式细胞术检测外泌体特征蛋白表达图1 血清外泌体鉴定
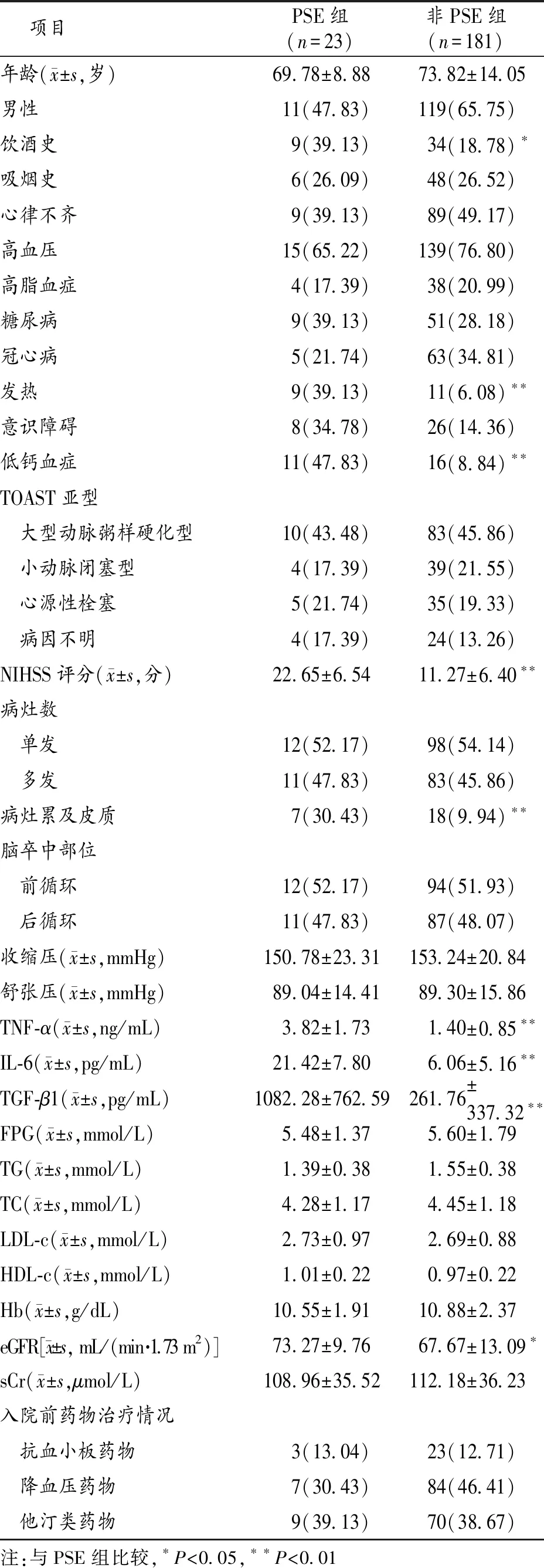
表1 2组病人一般临床资料比较(n,%)
2.3 2组病人血清外泌体蛋白TSP-1表达水平比较 PSE组血清外泌体蛋白TSP-1的表达水平经Western blot法及ELISA法检测均显著高于非PSE组病人,差异均有统计学意义(P<0.01)。见表2。
表2 2组病人血清外泌体蛋白TSP-1表达水平比较
2.4 PSE的影响因素分析 多因素Logistic回归分析显示,发热、低钙血症、NIHSS评分、血清外泌体蛋白TSP-1表达水平均是老年脑卒中病人发生PSE的独立影响因子(P<0.05)。见表3。
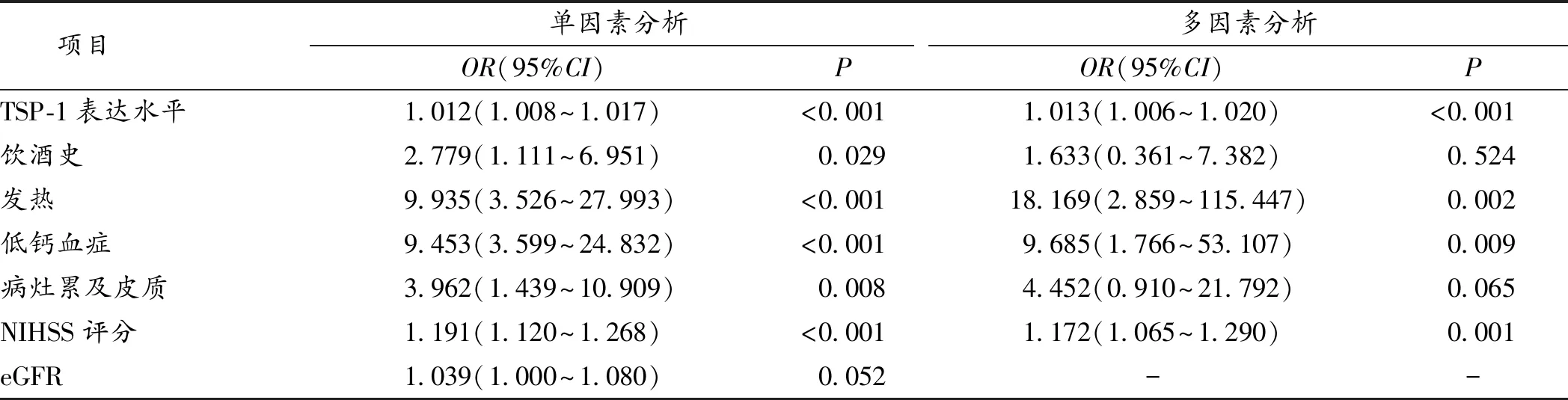
表3 单因素和多因素Logistic回归分析老年脑卒中病人发生PSE的影响因素
2.5 血清外泌体蛋白TSP-1预测PSE的价值 ROC曲线分析结果显示,TSP-1对老年脑卒中病人发生PSE的预测效能AUC为0.886(95%CI:0.829~0.943),阈值为146.565 pg/mL,在该阈值下,特异度和灵敏度分别为81.8%和87.0%,约登指数为0.688。见图2。
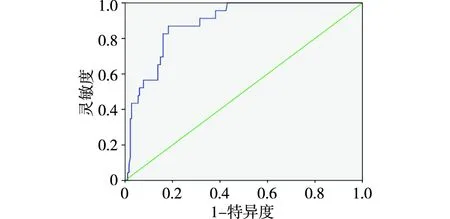
图2 血清外泌体蛋白TSP-1表达水平对老年脑卒中病人发生PSE预测价值的ROC曲线
2.6 PSE病人血清外泌体蛋白TSP-1表达水平与炎症因子和认知损害的相关性 Pearson相关性分析显示,PSE病人血清外泌体蛋白TSP-1表达与IL-6、TGF-β1、TNF-α均呈正相关(r=0.699,0.919,0.680,P<0.001)。Spearman相关性分析显示,PSE病人血清外泌体蛋白TSP-1表达与MMSE差值呈负相关(r=-0.768,P<0.001)。
3 讨论
老年PSE的发病率差异很大,早期癫痫发病率更高[8],其中出血转化被认为是早期癫痫发作最重要的预测因素之一。TSP-1作为一种参与血管生成和炎症反应重要的脱细胞蛋白,在其中的促进作用也不可忽视。本研究结果显示, PSE组病人血清外泌体蛋白TSP-1表达显著高于非PSE组病人,表明TSP-1可能参与了PSE的发病机制,此外血清外泌体蛋白TSP-1表达升高亦是老年脑卒中病人发生PSE的独立预测因子。
本研究中,204例老年卒中病人发生PSE 23例(11.27%)。既往研究显示,缺血性脑卒中发生PSE的原因是神经元的高代谢及高需氧量的特点,使其对缺氧高度敏感,在发生缺血性脑卒中急性期,中枢神经系统因缺血、缺氧释放大量谷氨酸,引起神经细胞膜兴奋、γ-氨基丁酸抑制性功能受损,进而降低了癫痫的阈值[9-11]。缺血、缺氧引起的脑组织损伤会导致葡萄糖代谢异常,同时因钠、钾泵功能受损,使细胞内钠、钙离子增加,电解质及酸碱平衡被破坏,导致细胞毒性水肿、急性代谢功能障碍,同样影响神经元正常放电,引起癫痫发作。众多研究表明,癫痫与炎症反应息息相关,脑损伤可激活星形胶质细胞和小胶质细胞释放促炎因子,诱导血脑屏障损伤引发癫痫,而在癫痫发作后,炎症反应会加重,此时的神经组织微环境常伴随着严重且持续的炎症反应,形成癫痫发展的恶性循环[12]。本研究结果显示,PSE组病人的IL-6、TGF-β1、TNF-α水平均显著高于非PSE组。
TSP-1是一种黏附糖蛋白,最早发现于活化的血小板中,能介导细胞-细胞、细胞-基质的相互作用,在细胞表面表达并调节细胞生物学过程[13]。有研究基于蛋白质组学对轻度脑卒中和短暂性脑缺血发作的生物标志物进行分析,发现TSP-1是短暂性脑缺血发作状态的潜在重要预测因素[14]。因此,本研究探究了血清外泌体蛋白TSP-1表达水平与老年脑卒中病人发生PSE的相关性,结果显示TSP-1是老年脑卒中病人发生PSE的独立影响因素,可预测老年脑卒中病人发生PSE。血浆中TSP-1水平在患有心血管疾病和炎症性疾病以及通常伴有心血管并发症的疾病病人中显著升高,尤其是在缺血性血管疾病中更明显,老年缺血性脑卒中病人的血浆TSP-1水平明显高于正常对照组病人[15],其重要的机制在于TSP-1通过激活TGF-β途径,进而诱导炎症因子表达;此外TSP-1可通过参与调节多种细胞表面受体及NF-κB的活性来影响炎症反应,如TSP-1可通过对IL-1β通路发挥CD47依赖和不依赖的促炎和抗炎作用[16],从而加重机体微炎症状态。在本研究中,PSE病人血清外泌体蛋白TSP-1表达与IL-6、TGF-β1、TNF-α呈正相关。此外Cheng等[17]通过动物实验发现,敲除TSP-1基因小鼠在颅脑外伤后血脑屏障损伤较野生型加重,且表现出运动、认知功能方面的严重神经功能缺损,Kim等[18]也证实人脐带血间充质干细胞分泌的TSP-1可以恢复AD环境中的α2δ-1和Neuroligin-1受体的表达水平,减轻淀粉样蛋白β肽诱导的突触功能障碍,这与认知和记忆障碍密切相关,同时还与癫痫相关。因此我们进一步分析了血清外泌体蛋白TSP-1表达与PSE病人认知功能的关系,发现PSE病人血清外泌体蛋白TSP-1表达与MMSE差值呈负相关,PSE病人的血清外泌体蛋白TSP-1水平越高,越易出现认知损害。
综上所述,对于老年缺血性脑卒中病人,血清外泌体蛋白TSP-1高表达者更易发生PSE,这可能与TSP-1激活TSP-1/TGF-β1途径和诱导血清炎症因子水平升高有关。此外,血清外泌体蛋白TSP-1高表达还可能加重PSE病人的认知损害。检测血清外泌体蛋白TSP-1对预测老年脑卒中病人PSE发生风险有一定参考价值。而且血清外泌体蛋白TSP-1也有望成为预测老年脑卒中病人发生PSE的重要靶标。

