益脉降脂汤含药血清对THP-1源性泡沫细胞增殖活性和胆固醇含量的影响
古展鑫 卢梦月 刘锐 刘付昌盛 刘华盛
(广西中医药大学 1研究生院,广西 南宁 530000;2附属瑞康医院老年病科)
中国心血管病患病率仍在逐年上升,并未见放缓趋势〔1〕。动脉粥样硬化(AS)是一种缓慢进展性疾病,它是心血管疾病的主要病理改变之一。AS发病的病理生理过程复杂,与炎症浸润、内皮损伤、氧化应激反应及免疫等各种因素密切相关〔2~4〕,其中,由动脉管壁上各种脂质成分累积而产生斑块是AS形成的关键环节。因此,如何抑制巨噬细胞吞噬氧化型低密度脂蛋白(ox-LDL)、改善泡沫细胞的脂质代谢,抑制巨噬细胞泡沫化成为防治AS的关键。
中医无AS病名,但依据其血脂异常的发病病因,可归属中医的“痰浊”“膏脂”等范畴。其基本病机以脾肾不足为本,痰瘀互结为标的本虚标实之证。痰瘀互结浸润血脉是其主要病理特征。益脉降脂汤是针对AS脾虚痰浊、肝肾亏虚、痰瘀互结浸润血脉等病机特征,以健脾化痰、滋补肝肾、活血化瘀为主要治疗原则,辨证与辨病结合,标本兼顾。全方有健脾泄浊,滋补肝肾,活血通络之功效。方中黄芪、白术、茯苓、泽泻健脾化痰泄浊;黄精、何首乌、杞子滋补肝肾,丹参活血祛瘀,通利血脉,血行则痰自去;焦山楂消食和胃;菊花、草决明清肝泻火;绞股蓝有明显降血脂作用,为辨病用药。前期临床研究表明,益脉降脂汤能显著降低总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C),升高高密度脂蛋白胆固醇(HDL-C)〔5〕,还能降低C反应蛋白,改善血液流变学指标水平〔6〕,从而改善AS。为进一步阐明益脉降脂汤改善脂质代谢的作用,本研究建立泡沫细胞模型,探讨益脉降脂汤含药血清对泡沫细胞增殖活性和胆固醇含量的影响。
1 材料与方法
1.1动物与细胞 30只SPF级SD雌性大鼠,体重(180±20)g,购自湖南斯莱克景达实验动物有限公司,实验动物合格号:SCXK(湘)2018-0002,饲养于广西中医药大学动物实验中心;人急性白血病单核细胞系THP-1,源于ATCC,购自卓一生化(广西)技术有限公司。
1.2实验药物 益脉降脂汤由黄精20 g、山楂20 g,白术10 g,茯苓10 g,丹参10 g,泽泻10 g,绞股蓝10 g,何首乌10 g,黄芪10 g,杞子10 g,菊花10 g,草决明10 g组成,由广西中医药大学附属瑞康医院药剂科制备提供,分别制成含生药1.42、2.84、5.68 g/ml〔大鼠按10 ml/(kg·d)容积灌胃时,相当于成人等效剂量、2倍剂量、4倍剂量〕备用。阿托伐他汀钙片(立普妥)购自桂中大药房,生产批号:H20051408,使用前研磨粉碎,配制成含阿托伐他汀钙0.2 mg/ml〔大鼠按10 ml/(kg·d)容积灌胃时,相当于成人等效剂量〕备用。
1.3主要试剂与仪器 主要试剂:Gibco RPMI1640培养基(Gibco公司,C11875500BT);澳洲进口胎牛血清(Gibco公司,10099141C);ox-LDL(北京Solarbio公司,H7950-2 mg);佛波酯(PMA,北京Solarbio公司,SP9830-1 mg);TC测定试剂盒(北京普利莱生物公司,SJ-E1015);噻唑蓝(MTT,北京Solarbio公司,M8180-250 mg);饱和油红O染色液(北京Solarbio公司,G1260-500 ml)。主要仪器:生物安全柜〔青岛海尔(特种),HR1200-ⅡB2〕;CO2细胞培养箱(日本Sanyo公司,MCO-18AIC);倒置显微镜(德国Leica公司,DMI3000B);高速离心机(美国Thermo公司,ST-16R);全波长酶标仪(美国 Biotek,Epoch Biotek)。
1.4含药血清制备 将SD大鼠30只,随机分成益脉降脂汤(中药)高、中、低剂量组及阿托伐他汀钙(西药)组、生理盐水(空白对照)组各6只;适应性喂养1 w。灌胃时各组每日给药1次,连续7 d。次日晨再灌胃1次,末次给药1 h后,无菌条件下自腹腔动脉采血。将各组全血标本静置3 h后,以3 000 r/min 4℃离心15 min,取同组血清混匀置于56℃水浴中30 min灭活,过滤除菌后EP管分装。-20℃低温冰箱冷藏备用。
1.5THP-1细胞培养及诱导分化 生长状态良好的THP-1细胞使用含10%胎牛血清(FBS)的RPMI1640培养基在37℃、5%CO2条件下培养细胞;使用终浓度为320 mmol/L的PMA混匀共同孵育细胞,诱导其分化为巨噬细胞,24 h后显微镜下拍照观察。
1.6泡沫细胞建立及鉴定 将THP-1细胞刺激诱导分化为具有吞噬能力的巨噬细胞后,继以终浓度为80 mg/L的ox-LDL完全培养液,于37℃,5%CO2的条件下的恒温恒湿培养箱共同孵育48 h,最终建立泡沫细胞模型。
1.7油红O染色方法 将饱和油红O染色液与PBS按3∶2比例配制,用滤纸除杂质;用纯水配制60%异丙醇,备用;将培养好的各组细胞取出,各孔弃上清,PBS缓慢冲洗2遍,加入4%多聚甲醛固定20 min。弃液后,每孔使用1 ml 60%异丙醇冲泡1 min,后弃去;使用配制好的油红O染色液着色20 min。弃染色液,加入1 ml异丙醇分化10~15 s,PBS洗涤2次;苏木素复染2 min,后弃液,PBS洗涤2次,将细胞爬玻片取出,滤纸吸干水液。取载玻片,滴注甘油明胶,盖上细胞爬玻片,轻轻按压使之贴合不留气泡,倒置显微镜下观察染色情况。
1.8MTT比色法检测各组细胞增殖活性 取对数生长期状态良好的THP-1细胞,用10%FBS完全培养基制成细胞悬液,调整细胞浓度为7×104~8×104/ml,加入PMA使细胞悬液终浓度含320 mmol/L的PMA,种于96孔板,每孔100 μl,每组10个复孔。放至37℃、5%CO2条件的诱导分化24 h后贴壁。24 h后除巨噬细胞组加入10%FBS完全培养基外,其余各组分别加入含80 mg/L的ox-LDL 10%FBS完全培养基,使其余各组变成泡沫细胞,建模成功后将巨噬细胞组和模型组加入空白对照组血清,西药组及中药高、中、低剂量组加入相应剂量的10%含药血清,设含药血清干预时间梯度为12、24、48 h。在各时间段干预结束后,每孔加入10 μl MTT溶液,避光继续孵育4 h。后每孔加入150 μl的二甲基亚砜(DMSO),震荡5~10 min后放至全波长酶标仪,吸收波长为490 nm,测定各孔OD值,分析益脉降脂汤含药血清对巨噬细胞泡沫化增殖活性的影响。
1.9细胞内TC含量测定 取对数生长状态良好的THP-1细胞重悬细胞悬液,调整细胞浓度为1×106/ml,每孔2 ml,种于6孔板,经由PMA诱导24 h后贴壁。除巨噬细胞组外,其余各组细胞再由80 mg/L的ox-LDL刺激48 h后,转变为泡沫细胞。将巨噬细胞组和模型组加入空白对照组血清,西药组及中药高、中、低剂量组加入相应剂量的含药血清,使含药血清终浓度为10%,设定含药血清干预时间为12、24、48 h 3个干预时间点。各干预时间结束后严格按照试剂盒说明书步骤检测细胞内TC含量。
1.10油红O染色观察含药血清对泡沫细胞脂质蓄积的影响 取对数生长期状态良好的THP-1细胞,用10%FBS完全培养基制成细胞悬液,调整细胞浓度为1×106/ml,种于6孔板,每孔2 ml,每组种板前在孔内放置1片爬玻片,以便后续染色后观察细胞。诱导分化24 h后取出六孔板,弃上清,除巨噬细胞组加入10%FBS完全培养基外,其余各组分别加入含80 mg/L的ox-LDL 10%FBS完全培养基,使其余各组变成泡沫细胞,将巨噬细胞组和模型组加入空白对照组血清,西药组及中药高、中、低剂量组加入相应剂量的10%含药血清;各组血清干预48 h后,取各组细胞爬玻片,进行油红O 染色,甘油明胶封片后,倒置显微镜下观察各组细胞脂质蓄积情况,染色区域面积用油红O染色面积比重〔Area(%)〕表示,其数值越大,表示染色区域越大,即细胞内脂质蓄积越明显。
1.11统计学分析 采用SPSS22.0软件进行t检验、LSD法、单因素方差分析。
2 结 果
2.1THP-1细胞刺激诱导形成的巨噬细胞形态 经浓度320 mmol/L的PMA刺激诱导THP-1细胞24 h后,可分化成不规则形态或类圆形或梭形状态的贴壁细胞,一般有伪足延伸。见图1。
2.2泡沫细胞模型建立及鉴定 巨噬细胞由于吞噬了大量ox-LDL,会在胞内形成大量脂滴,细胞形态会相应增大,胞内脂滴会被着染形成红色或橘红色脂质累积点,即红色颗粒斑点状代表为脂滴;对照组在无ox-LDL加入共同孵育的情况下,胞内少见或未见明显红色脂滴累积;而在经过ox-LDL共同孵育48 h后的实验组结果显示,可见大量的红色脂滴在细胞内蓄积。见图2。

图1 PMA刺激诱导24 h后不同倍镜下巨噬细胞形态(油红O染色)
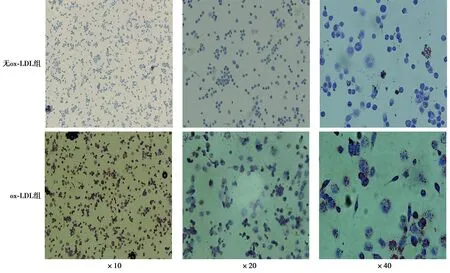
图2 无ox-LDL组和ox-LDL组分别在不同倍镜下脂质蓄积情况(油红O染色)
2.3MTT法检测各组含药血清对泡沫细胞增殖影响 随着干预时间延长,各组吸光度(OD)值逐渐降低,48 h测得各组细胞OD值最低;益脉降脂汤含药血清干预12 h、24 h和48 h后,与巨噬细胞组相比,同时间点模型组OD值显著降低(P<0.05);与模型组相比,同时间点西药组与中药各剂量组的OD值均显著升高(P<0.05),见表1。

表1 各组含药血清干预不同时间对巨噬细胞泡沫化 增殖活性的影响
2.4各组干预不同时间点细胞内TC含量比较 与巨噬细胞组相比,相同时间点模型组细胞内TC含量显著增高(P<0.05);与模型组相比,相同时间点西药组与中药各剂量组细胞内TC含量明显降低(P<0.05),见表2。
2.5油红O染色观察各组含药血清对泡沫细胞脂质蓄积的影响 与模型组对比,巨噬细胞组胞内少见或未见明显红色脂滴累积;而在各组含药血清干预后的泡沫细胞,在显微镜下仍均可见红色脂滴在细胞内蓄积,但与模型组对比,西药组和中药各剂量组脂质蓄积明显减少,见图3。
表2 各组干预下同时间点细胞中TC水平 比较

图3 各组细胞脂质蓄积(油红O染色,×20)
2.6Image J Area(%)的半定量分析 与巨噬细胞组(3.095%)比较,模型组Area(%)(9.944%)明显升高,与模型组比较,西药组和中药高、中、低各剂量组Area(%)(6.033%、6.819%、6.215%、7.494%)明显降低(P<0.05)。
3 讨 论
本研究根据前期研究和实践经验,通过应用中药血清药理学〔7~9〕药方法,进一步探究益脉降脂汤含药血清对泡沫细胞的脂质代谢的影响作用。美国心脏协会指出,易损性斑块所包括的薄纤维帽状AS,其特征是病变由一个小于65 μm厚的纤维帽覆盖,其中就包含许多富含脂质的巨噬细胞泡沫细胞,巨噬细胞能合成和释放多种生长因子和炎症因子,还分泌多种基质金属蛋白酶(MMPs),削弱纤维帽并使其容易破裂。而当泡沫细胞凋亡坏死,会将细胞内大量的脂质释放出来,积累形成脂核,导致不稳定易损斑块的形成。因此,脂质浸润特别是巨噬细胞泡沫化是AS斑块具有不稳定易损斑块的特征之一〔10〕,所以如何稳定斑块也是众多学者共同努力的方向。本研究发现,巨噬细胞在大量吞噬ox-LDL后,从形态上,细胞体形会相应增大,说明脂质蓄积在胞内蓄积,而当这种情况发生在易损斑块,这无疑是会造成脂核的增大。因此本文希望通过在中药含药血清的干预下,在已经发生巨噬细胞泡沫化之后,能够稳定泡沫细胞,使其减少细胞破裂而趋于相对稳定。通常根据测得OD值,来判断活细胞数量,OD值越大,细胞活性越强〔11〕。由于巨噬细胞属于高级分化的终末细胞,是一种非特异性免疫细胞,一般不具备增殖能力〔12〕,因此也更能反映泡沫细胞的活性情况。在加入含药血清12、24、48 h后,细胞总体增殖活性即细胞存活率随培养时间增长而OD值逐渐下降,这可能也与高浓度的ox-LDL刺激有关,加速了细胞凋亡〔13〕。这并非代表含药血清对细胞的破坏作用,而是相对时间延长,细胞凋亡增加。本研究说明了ox-LDL诱导下的泡沫细胞并非在含药血清的干预下实现细胞增殖,而是细胞存活能力相对提高,因此含药血清各组细胞相对模型组细胞的死亡减少。提示西药组和中药各剂量组的含药血清均能对泡沫细胞存活率具有促进作用,具有稳定泡沫细胞使其免于凋亡破裂而加重AS。
细胞内胆固醇含量是泡沫细胞脂质累积最直观的评价指标〔14〕,检测细胞内胆固醇含量水平也可从另外一个角度阐明益脉降脂汤含药血清对巨噬细胞源性泡沫细胞脂质代谢影响的干预作用。事实上,许多中药的有效成分如决明子总蒽醌、绞股蓝皂苷、黄芪多糖丹参多酚等已被证实具有抗巨噬细胞泡沫化的作用〔15〕,而益脉降脂汤中诸如绞股蓝、山楂、泽泻等中药更是具有明确的降脂效果。在AS发生过程中,动脉内膜可见脂质条纹和纤维样斑块,主要是由单核巨噬细胞吞噬胆固醇后的泡沫细胞构成。泡沫细胞的形成是以巨噬细胞内胆固醇酯的含量占TC含量的将近一半〔16〕。本研究结果提示泡沫细胞是终末细胞,细胞会随时间延长而凋亡,因而细胞内脂质含量会随时间增加而降低。同时说明了模型组内与模型组在吞噬大量ox-LDL之后,泡沫细胞内的脂质含量明显增高;中药各剂量组含药血清均对泡沫细胞的脂质累积有明显改善作用。
此外,本文也从形态学的角度直观地观察了不同组别含药血清干预各组泡沫细胞48 h后油红O染色情况,表明从细胞形态学上,经过各组含药血清干预处理后,泡沫细胞的脂质蓄积情况明显改善,与上述结果基本一致,从而进一步表明益脉降脂汤含药血清可明显改善泡沫细胞的脂质代谢。
综上,益脉降脂汤含药血清可能提高泡沫细胞生存活性,具有减少泡沫细胞凋亡、改善泡沫细胞胆固醇蓄积的作用,而益脉降脂汤的所发挥的抗AS作用机制仍需进一步探究。

