利用ceRNA网络研究2型糖尿病周围神经病变的相关基因
辛宁 李小明
(1福建医科大学省立临床医学院,福建 福州 350001;2福建省立医院老年科;3福建省老年病研究所)
糖尿病(DM)周围神经病变(DPN)可影响30%~50%的DM患者,尤其是老年患者〔1〕。DPN的临床症状通常是疼痛、瘙痒和皮肤感觉丧失,这会导致感染甚至截肢,从而影响生活质量和损害身体功能〔2〕。目前,随着高通量测序技术的广泛应用,生物信息学分析对于深入了解DPN发病机制具有重要意义。Salmena等〔3〕在2011年提出,微小(mi)RNA、长非编码(lnc)RNA在各种生物学过程中起到重要作用。miRNA通过与目标mRNA结合,抑制目标mRNA的翻译。lncRNA可与miRNA结合,起到吸附miRNA的作用,从而调节mRNA的表达水平,起到竞争性内源(ce)RNA的作用〔3〕。一些学者对DPN的发病机制进行了相关的生物学信息学分析,但仅对差异的mRNA进行了研究,没有对lncRNA的调控机制进行研究〔4〕。本研究通过构建ceRNA调控网络,以探讨DPN发病的分子机制。
1 资料与方法
1.1数据下载 选取GEO数据库作为研究对象,下载了芯片GSE95849(平台GPL22448)。GSE95849中纳入12份样品,其中6份为2型(T2)DM且已排除DPN为DM组,6份为2型DPN为DPN组。样本来自外周血。下载芯片中的矩阵文件和平台文件。
1.2矩阵注释 运用Perl软件(v5.30.1)将矩阵文件和平台文件对比,将GSE95849的矩阵文件中的探针ID转换为基因名称。本文从https://genome.ucsc.edu/index.html下载Human.gtf人类基因注释文件,并使用Perl软件将基因属性添加到基因名中以区分lncRNA和 mRNA。
1.3差异分析 运用R软件(版本3.6.2)的limma包分析,并对数据进行标准化和Log2 转化,见图1,对芯片中的基因表达量以log2差异倍数(logFC)>0.5或者<-0.5,并且P<0.05为筛选参数,得到差异的lncRNA与mRNA,用R软件绘制差异表达的lncRNA和mRNA的分层聚类热图。logFC大于0代表此差异的RNA在DPN组上调。
1.4预测lncRNA结合的miRNA 从miRcode数据库下载高度保守的microRNA家族文件,用Perl软件将差异基因对应到这些文件中的miRNA,分别预测得到上调的lncRNA-miRNA关联和下调的lncRNA-miRNA关联。
1.5预测miRNA调控的mRNA及构建ceRNA网络 使用3个miRNA数据库〔TargetScan(http://www.targetscan.org/vert_72/)、miRTarBase(http://amp.pharm.mssm.edu/Harmonizome/resource/MiRTarBase)、miRDB(http://mirdb.org/)〕,预测与miRNA相关的靶基因mRNA。将预测中上调的mRNA和实际上调的差异mRNA取交集,将预测中下调的mRNA和实际下调的差异mRNA取交集。利用Cytoscape软件(3.7.2版),用lncRNA、miRNA与mRNA之间的相互作用构建ceRNA网络。

图1 GSE95849数据标准化
1.6基因功能注释和信号通路分析 将获得的差异表达基因输入DAVID6.8(https://david.ncifcrf.gov/)在线工具进行基因本体论(GO)功能分析,主要分析生物过程。再利用京都基因和基因组百科全书(KEGG)工具对这些基因进行信号通路分析,以P<0.05同时伴通路基因数>3个为有意义,按P值从小到大筛选前10条项目。使用R语言将结果可视化。
1.7蛋白互作网络构建与模块分析 使用STRING数据库v11.0(https://string-db.org/)分析ceRNA网络中mRNA编码蛋白的相互作用。设定置信度得分>0.9为筛选参数,分析蛋白互作关系。再使用STRING得到的蛋白互作(PPI)网络数据输入 Cytoscape 软件v3.7.2进行可视化分析,使用 MCODE 插件分析出 PPI 网络中的关键子网络。
2 结 果
2.1DM与DPN差异表达的mRNA和lncRNA DPN组与DM组比较共获得58个差异表达的lncRNA,其中19个为上调,39个为下调。共获得4 647个差异表达mRNA,2 360个上调,2 287个下调。差异表达的lncRNA的聚类热图及前100个P值最小的差异mRNA的聚类热图,见图2。
2.2DM与DPN差异表达lncRNA的ceRNA网络
2.2.1上调lncRNA的ceRNA网络 在上调的差异表达的lncRNA中,预测得到37个miRNA,238个mRNA,见图3。该网络一共有285个节点(10个lncRNA、37个miRNA、238个mRNA),478条相互作用联系(112条lncRNA-miRNA,366条miRNA-mRNA)。
2.2.2下调lncRNA的ceRNA网络 在下调的差异表达的lncRNA中,预测得到35个miRNA,145个mRNA,见图4。该网络一共有203个节点(23个lncRNA、35个miRNA、145个mRNA),403条相互作用联系(182条lncRNA-miRNA,221条miRNA-mRNA)。
2.3GO分析 GO富集分析结果中,本文主要研究了生物过程。上调的差异lncRNA调控的mRNA主要参与的生物过程为:RNA聚合酶Ⅱ启动子对转录的正调控、共价染色质修饰、凋亡过程、组蛋白H3乙酰化等,见图5。下调的差异lncRNA调控的mRNA主要参与的生物过程为:细胞凋亡信号通路中线粒体膜蛋白插入的正向调节、巨噬细胞自噬的正向调控、细胞对DNA损伤刺激的反应、细胞对缺氧的反应等,见图6。
2.4KEGG分析 上调的差异lncRNA调控的mRNA主要参与的KEGG信号通路有丝裂原活化蛋白激酶(MAPK)信号通路、转化生长因子(TGF)-β信号传导途径、肿瘤坏死因子(TNF)信号通路等,见图7。下调的差异lncRNA调控的mRNA主要参与的KEGG信号通路有胰腺癌、癌症信号通路、Wnt信号通路等,见图8。
2.5PPI网络及模块分析 共有个383个mRNA输入STRING数据库,以置信度得分>0.9为筛选参数,除外孤立的蛋白,共得到330对PPI关系,159个蛋白,见图9。运用MCODE插件筛选得到1个关键蛋白互作模块,见图10。其中,本文发现残疾基因同源物(DAB)2及热休克蛋白(HSP)A8与DPN的发生发展有关。蛋白的lncRNA-miRNA-mRNA关系,见表1。度值越高代表与网络中其他蛋白关系越密切。

红色代表高表达,绿色代表低表达,黑色代表相对表达差异不 显著图2 差异表达的 lncRNA及 mRNA 分层聚类树形图和热图

红色代表上调的lncRNA,绿色代表 miRNA,蓝色代表mRNA,连线代表二者之间有调控关系图3 上调lncRNA的ceRNA网络

红色代表下调的lncRNA,绿色代表 miRNA,蓝色代表mRNA,连线代表二者之间有调控关系图4 下调lncRNA的ceRNA网络

图5 上调的差异lncRNA调控的mRNA 主要参与的生物过程气泡图

图6 下调的差异lncRNA调控的mRNA 主要参与的生物过程气泡图

HTLV-Ⅰ: 人嗜T-淋巴病毒1型;PI3K-Akt:磷脂酰激酶-3-激酶/蛋白激酶B;Fox叉头盒O亚组;AMPK:腺苷酸活化蛋白激酶图7 上调的差异lncRNA调控的mRNA 主要参与的KEGG通路

图8 下调的差异lncRNA调控的mRNA 主要参与的KEGG通路
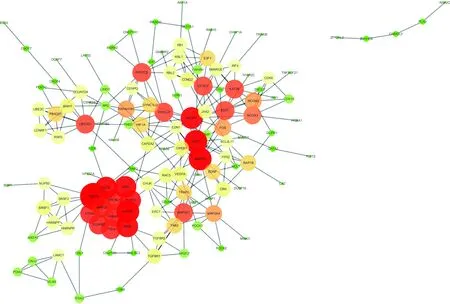
圆圈越大,颜色越红代表该节点的度值越高图9 PPI网络

三角形代表上调的mRNA,V形代表下调的mRNA图10 关键蛋白模块

表1 关键蛋白的lncRNA-miRNA-mRNA关系
3 讨 论
通过生物信息学分析,本文找到了DPN组与DM不伴DPN组之间的差异lncRNA。这些lncRNA通过调节miRNA而间接调节目标mRNA的翻译。lncRNA上调后,可以结合更多的miRNA,从而降低了 miRNA 对 mRNA翻译的抑制,促进mRNA表达,反之则抑制mRNA表达。DPN组中上调的差异lncRNA调控的mRNA富集的功能为:(1)在生物过程方面,TNF-α通过促进依赖于RNA聚合酶Ⅱ的RNA聚合酶Ⅱ的代谢型谷氨酸受体(mGluR)5蛋白磷酸化,从而参与神经病理性疼痛的发生〔5〕。DPN的病理改变以施旺细胞凋亡引起的脱髓鞘为主要特征。改善细胞凋亡在DPN的修复和改善中发挥着重要作用〔6〕。组蛋白H3乙酰化也与DPN有关,神经损伤引起的疼痛可以增加背根节中嘌呤能X3受体(P2X3-R)的水平。P2X3-R位点正是通过招募介导组蛋白乙酰化的表观遗传调节子来控制P2X3-R基因的转录〔7〕。最后,持续性高血糖会激活NF-κB信号通路,从而触发各种细胞因子、趋化因子和细胞黏附分子的表达〔8〕。(2)KEGG通路方面,MAPK信号途径参与转录因子磷酸化。这些转录因子调节的基因产物参与了神经的生长发育,包括树突修剪、轴突生长、突触的可塑性等〔9〕。TGF-β是多效性细胞因子,参与炎症反应。在神经系统损伤后,TGF-β调节神经元和胶质细胞的行为,从而介导再生过程〔10〕。因此,TGF-β信号传导上调则可能是神经损伤后的病理反应。硫辛酸是常见的治疗DPN的抗氧化剂,而TGF-β可增加脂质过氧化作用,硫辛酸可降低TGF-β表达〔11〕。TNF可导致中枢水平的β肾上腺素能受体表达改变,导致神经的痛阈降低,还能间接调节神经细胞合成的疼痛介质〔12〕。
由下调的差异lncRNA调控的mRNA参与功能为:(1)在生物学过程方面,细胞凋亡信号通路与DPN关系在前文已述及。通常自噬可通过清除受损细胞器以维持细胞的正常生理代谢。DPN患者神经组织长期处于氧化应激状态,导致自噬现象出现异常〔13〕。目前许多实验支持DM会抑制神经细胞的自噬。有学者观察到DM小鼠坐骨神经自噬标志物(LC3-Ⅱ/LC3-Ⅰ,p62)较正常小鼠减少,并伴有有髓神经纤维丢失和髓鞘异常〔14〕。自噬可以通过减少受损的细胞器与蛋白在神经元胞体内的堆积发挥神经保护作用〔15,16〕。(2)KEGG通路分析主要涉及肿瘤及p53信号通路、Wnt信号通路等。DM与多种肿瘤的发生密切相关〔17,18〕,这可能是因为肿瘤和DM具有一些共同的危险因素:长期的糖、脂肪代谢紊乱、胰岛素抵抗等。Wnt信号通路与DPN的关系是近年研究的热点。DM神经病变大鼠坐骨神经Wnt通路蛋白c-myc和基质金属蛋白酶(MMP)-2表达增加〔19〕。动物实验表明,抑制Wnt信号可抑制炎症反应,显著改善行为痛阈和神经功能参数〔20〕。
通过对关键基因的筛选,通过查阅文献,本研究认为HSPA8、DAB2可能是DPN发生的关键基因。如HSPA8可与自噬相关的蛋白结合,在自噬中发挥重要作用。在自噬过程中,HSPA8与HSPB8结合形成复合物,若这些HSP家族成员相互作用受到影响,则会阻断自噬途径〔21〕。DAB2可抑制神经生长因子诱导的神经突起生长,同时下调神经元特异性细胞骨架蛋白β-TubulinⅢ的表达。DAB2在神经生长因子介导的神经突起生长中是一个负调控因子〔22〕。本研究发现C20orf197、ITPK1-AS1 2种lncRNA能同时调控HSPA8及DAB2蛋白,因此可推测,这2种lncRNA可能在DPN发生中起到关键作用。本文检索了Pubmed数据库,以DPN及C20orf197、DPN及ITPK1-AS1为摘要或者标题搜索词,未检索到任何结果。因此,C20orf197、ITPK1-AS1在DPN的发生中可能扮演了一种尚未被认识到的角色,有待进一步验证。本研究的优势是利用ceRNA网络研究了lncRNA在DPN中扮演的角色。相比于mRNA,对非编码RNA的研究能更深入地了解DPN的发病机制,从而寻找治疗的靶点。
综上,本研究揭示了DM和DPN的差异 lncRNA。差异lncRNA 与 mRNA 竞争 miRNA,从而调控蛋白合成,最终影响MAPK信号通路、TNF信号通路、TGF-β信号传导途径、肿瘤信号通路、p53信号通路、Wnt信号通路等,发现了5种途径可能是DPN的发病机制:通过上调ITPK1-AS1以下调hsa-miR-17-5最终上调HSPA8;通过上调C20orf197以下调hsa-miR-20b-5p最终上调HSPA8;通过上调C20orf197以下调hsa-miR-129-5p,最终上调DAB2;通过上调MIR600HG以下调hsa-miR-129-5p,最终上调DAB2;通过上调ITPK1-AS1以下调hsa-miR-129-5p,最终上调DAB2。而C20orf197、ITPK1-AS1 2种lncRNA在DPN发生中同时调控HSPA8及DAB2蛋白,起到关键作用。

