NLRP3炎性小体水平检测在非霍奇金淋巴瘤患者免疫治疗相关细胞因子风暴及化疗相关间质性肺炎中的预测价值分析
张艳彬,陈文昆,周寅,张小娟,李魁星
非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)是一种具有恶性增殖性、高度异质性的淋巴系统肿瘤,多采用放疗、化疗治疗,虽可使部分患者获得长期生存,但难以彻底清除肿瘤细胞,且治疗期间易损伤机体正常细胞,产生化疗相关间质性肺炎(interstitial pneumonia,IP)等诸多毒副作用[1-2]。嵌合抗原受体T细胞(CAR-T)作为一种新兴免疫治疗方案,可特异性识别靶抗原、杀伤靶细胞,在治疗难治性、复发恶性淋巴瘤中的完全缓解率高达90%[3]。但CAR-T治疗后的细胞因子风暴(cytokine release syndrome,CRS)发生率较高,患者临床常表现为凝血功能异常、肝肾功能受损、发热等,重度CRS可出现多器官功能障碍,甚至危及患者生命[4-5]。因此,早期预测、识别及干预IP、CRS等不良反应是NHL患者免疫治疗、化学治疗成功的关键环节。炎性体信号通路的异常激活在诸多炎性疾病的发生、发展过程中发挥关键作用,其中NOD样受体家族3(NLRP3)炎性小体激活后可加快IL-18等炎性因子的分泌及成熟,加剧炎性反应及组织损伤,故积极探讨相关炎性体信号通路的激活机制及表达可指导临床诊治[6-7]。目前关于NLRP3炎性体信号通路的激活机制研究较少,且少见有关其在CRS、IP中的研究报道。鉴于此,本研究就NLRP3炎性小体水平检测在NHL患者免疫治疗相关CRS及化疗相关IP中的预测价值进行分析,旨在为CRS、IP的防治提供一个潜在的靶点,报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2019年3月—2021年4月在北京协和医院血液内科接受CAR-T免疫治疗联合化疗的NHL患者125例临床资料,其中男68例,女57例;年龄39~79(53.65±6.27)岁;病程8~24(15.32±2.15)个月;淋巴瘤国际预后指数(IPI)评分(2.68±0.24)分;体质量指数(BMI)(21.03±1.68)kg/m2;疾病类型:弥漫大B细胞淋巴瘤101例,NK/T细胞淋巴瘤7例,滤泡淋巴瘤14例,淋巴浆细胞淋巴瘤3例。
1.2 病例选择标准 (1)纳入标准:符合NHL相关诊断标准[8-9];化疗前胸部CT显示无IP及严重感染表现;临床资料完整。(2)排除标准:胸部CT显示有间质性改变,但未伴有任何临床表现;化疗期间新发真菌性、细菌性、病毒性肺部感染;难以耐受CAR-T免疫治疗联合化疗;伴有心、肝、肾等重要脏器功能障碍或器质性病变;伴有意识障碍、精神障碍、活动困难;妊娠期或哺乳期女性。
1.3 分组方法 (1) CRS :生命体征平稳,发热和/或1级脏器毒性,无低血压发生为1级CRS;2级脏器毒性,血压降低和缺氧,使用低剂量升压药或静脉补液可纠正低血压,吸氧浓度<40%为2级CRS;3级脏器毒性,血压降低和缺氧,使用大剂量升压药可纠正低血压,吸氧浓度≥40%为3级CRS;4级脏器毒性,需呼吸机辅助呼吸,生命体征难以维持为4级CRS[10-11]。将发生1~4级CRS的患者99例纳入CRS组,其余26例为非CRS组。(2)IP[12]:①临床表现为咳嗽、气促、咯痰、发热、胸闷等;②胸部CT表现两肺伴有斑片状、蜂窝状、网格状、磨玻璃影,可伴或不伴有肺气肿、胸膜增厚征、牵拉性支气管扩张、肺大泡。结合胸部CT确诊IP 28例为IP组,未确诊IP 97例为非IP组。
1.4 治疗方法
1.4.1 CAR-T免疫治疗:输入前采用FC方案对肿瘤负荷进行预处理,CAR-T细胞均为患者来源,回输前第14 d,采集患者外周血淋巴细胞,送至实验室进行基因修饰,CAR-T细胞由北京亿鸣复兴生物科技有限公司制备,细胞结构包括4-1BB/CD3ζ信号区、抗CD19 scFv、跨膜区;使用转录的病毒为慢病毒;回输前1 d休息;分3次进行CAR-T细胞回输治疗(第0、1、2 d分别回输总剂量的10%、30%、60%),CAR-T细胞回输总数为0.62(0.39~1.30)×106个/kg;回输当日,使用盐酸异丙嗪、吲哚美辛栓药物,以预防过敏反应。
1.4.2 化疗方案:第1 d,环磷酰胺750 mg/m2,多柔比星40~50 mg/m2,长春地辛3~4 mg;第1~5 d,地塞米松15 mg。
1.5 观察指标与方法
1.5.1 NLRP3炎性小体检测:治疗前采集患者外周血3 ml,置于EDTA抗凝试管,置于离心机中1 500 rpm×10 min,取血浆置于1.5 ml无菌EP管。参考Trizol试剂盒、总RNA提取试剂盒(武汉纯度生物科技有限公司)说明书提取血浆中总RNA,使用逆转录试剂盒将总RNA逆转录为cDNA,按说明书进行操作。以逆转录的cDNA为模板,用荧光定量PCR技术(PRISM 7000型定量PCR仪)检测NLRP3炎性小体表达水平,总反应体系为20 μl,将β-actin作为内参,上游:5'-GTCGGAGATTCGTAGCTGGAT-3',下游:5'-GCCCCATCTAACCCATGCTTC-3'。NLRP3上游:5'-GAGTTCTTCGCTGCTATGT-3',下游:5'-ACCTTCACGTCTCGGTTC-3'。凋亡相关斑点样蛋白(ASC)上游:5'-CAACTGCGAGAAGGCTAT-3',下游:5'-GTGACCCTGGCAATGAGT-3'。半胱氨酸蛋白酶-1(Caspase-1)上游:5'-TGGAAGGTAGGCAAGACT-3',下游:5'-ATAGTGGGCATCTGGGTC-3'。PCR条件:94℃ 5 min,94℃ 30 s,54℃ 30 s,72℃ 30 s,共39个循环,72℃ 5min,收集荧光信号,用2-ΔΔCt法计算外周血NLRP3、ASC、Caspase-1的mRNA表达。
1.5.2 炎性因子检测:治疗后采集患者外周血3 ml,置于离心机中3 000 rpm×5 min,取上清,采用酶联免疫吸附法(ELISA)测定血清白介素(IL)-6、IL-10、干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)水平,试剂盒购自科邦兴业(北京)科技有限公司;采用免疫比浊法测定C反应蛋白(CRP)水平,试剂盒购自南京诺唯赞生物科技股份有限公司。
1.5.3 血常规及生化指标检测:采集患者治疗后外周血,采用COULTER LH 780/LH 785血细胞分析仪[贝克曼库尔特商贸(中国)有限公司]测定中性粒细胞计数(N)、血小板计数(PLT)、单核细胞计数(MON)、淋巴细胞计数(L)水平;采用ELISA法测定白蛋白(Alb)水平,采用速率法(上海梵态生物科技有限公司)测定α-羟丁酸脱氢酶(α-HBDH)、乳酸脱氢酶(LDH)水平。

2 结 果
2.1 CRS组、非CRS组一般资料比较 CRS组性别、年龄、病程、IPI评分、BMI、疾病类型与非CRS组比较,差异无统计学意义(P>0.05),见表1。
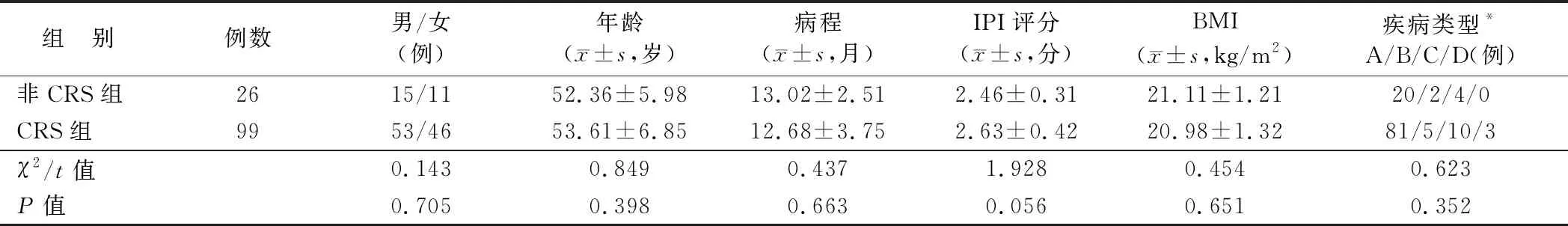
表1 CRS组、非CRS组一般资料比较
2.2 CRS组、非CRS组NLRP3炎性小体各基因mRNA表达比较 CRS组外周血NLRP3、ASC、Caspase-1的mRNA表达水平均高于非CRS组,差异有统计学意义(P<0.01),见表2。
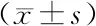
表2 CRS组、非CRS组NLRP3炎性小体各基因mRNA表达比较
2.3 CRS组、非CRS组炎性细胞因子表达比较 CRS组外周血CRP、IL-6、IL-10、IFN-γ、TNF-α水平均高于非CRS组,差异有统计学意义(P<0.01),见表3。
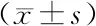
表3 CRS组、非CRS组炎性细胞因子表达比较
2.4 CRS组、非CRS组血常规及血生化指标比较 CRS组PLT、N、MON、L、α-HBDH、Alb水平与非CRS组比较,差异无统计学意义(P>0.05);CRS组LDH水平高于非CRS组,差异有统计学意义(P<0.01),见表4。
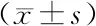
表4 CRS组、非CRS组血常规及血生化指标比较
2.5 NLRP3炎性小体表达与炎性细胞因子、血生化指标水平相关性 双变量Preason相关性显示,CRS患者外周血NLRP3、ASC、Caspase-1的mRNA表达均与CRP、IL-6、IL-10、IFN-γ、TNF-α、LDH水平呈正相关(P<0.01),见表5。
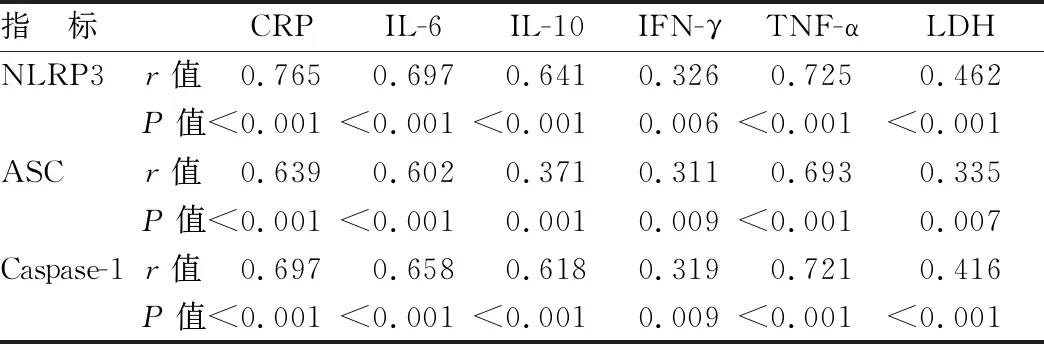
表5 NLRP3炎性小体表达与炎性细胞因子、血生化指标水平相关性
2.6 IP组、非IP组一般资料比较 IP组性别、年龄、病程、IPI评分、BMI及疾病类型与非IP组比较,差异无统计学意义(P>0.05),见表6。
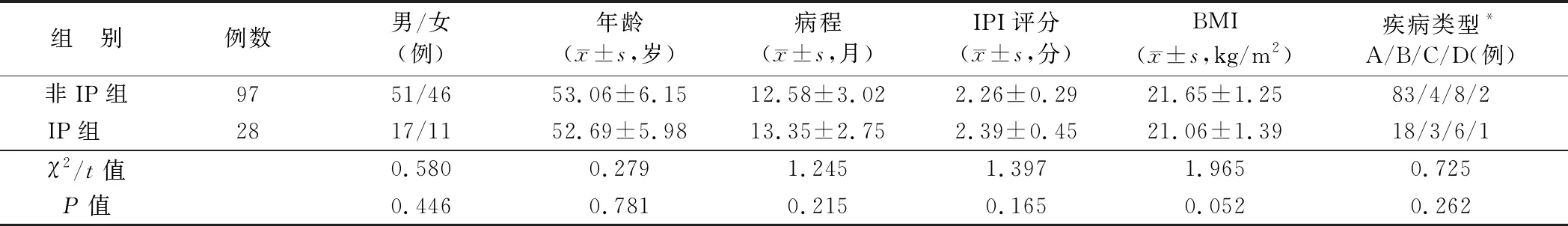
表6 IP组、非IP组一般资料比较
2.7 IP组、非IP组NLRP3炎性小体各基因mRNA表达比较 IP组外周血NLRP3、ASC、Caspase-1的mRNA表达水平均高于非IP组,差异有统计学意义(P<0.01),见表7。
表7 IP组、非IP组NLRP3炎性小体各基因mRNA表达比较
2.8 IP组、非IP组血常规及血生化指标比较 IP组血常规、血生化相关指标水平与非IP组比较,差异均无统计学意义(P>0.05),见表8。
表8 IP组、非IP组血常规及血生化指标比较
2.9 IP组、非IP组炎性细胞因子表达比较 IP组外周血CRP、IL-6、IL-10、IFN-γ、TNF-α水平均高于非IP组,差异有统计学意义(P<0.01),见表9。
表9 IP组、非IP组炎性细胞因子表达比较
2.10 NHL患者CRS、IP发生的危险因素分析 将单因素分析中有统计学意义的指标纳入自变量,将NHL患者是否发生CRS、IP作为因变量,经Logistic回归分析显示,NLRP3、ASC、Caspase-1的mRNA表达升高均为影响NHL患者CRS、IP发生的危险因素(P<0.05),见表10、11。
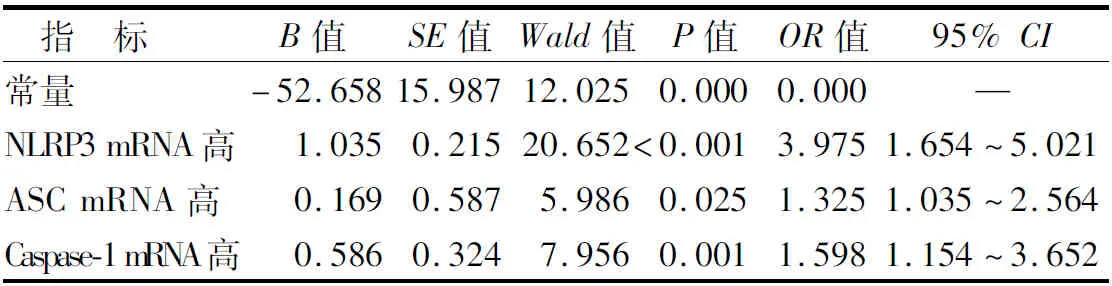
表10 影响NHL患者CRS发生的多因素分析
2.11 NLRP3炎性小体表达预测NHL患者CRS、IP发生的价值 ROC曲线分析结果显示,NLRP3、ASC、Caspase-1及三者联合预测NHL患者CRS发生的AUC分别为0.890、0.715、0.800、0.916,预测IP发生的AUC分别为0.901、0.868、0.880、0.935,见表12、图1、图2。
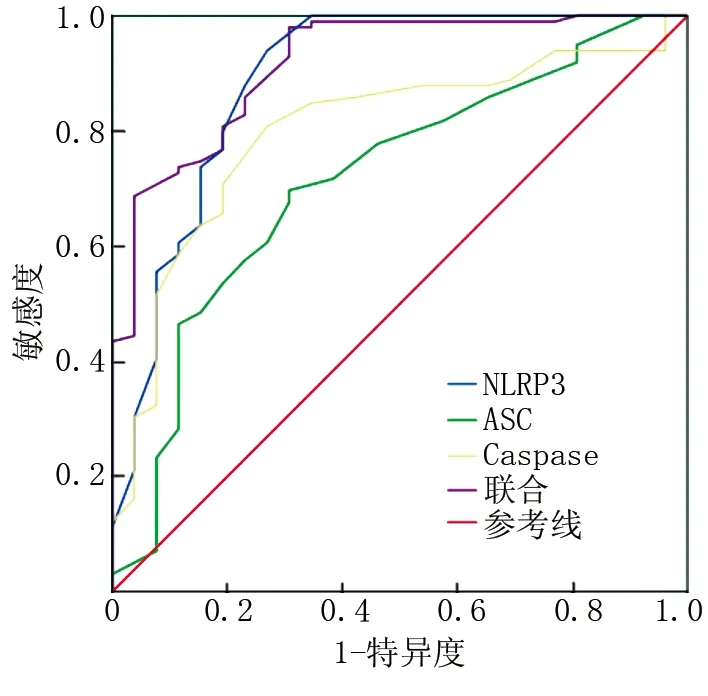
图1 NLRP3炎性小体预测CRS的ROC图
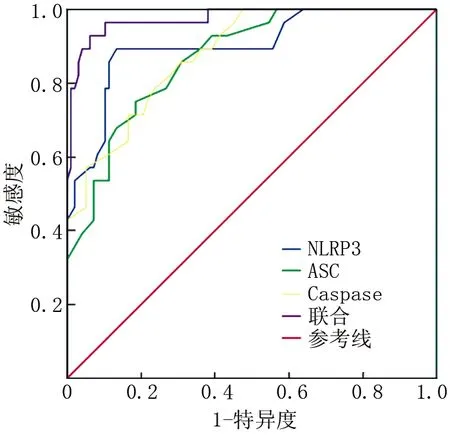
图2 NLRP3炎性小体预测IP的ROC图

表11 影响NHL患者IP发生的多因素分析

表12 NLRP3炎性小体基因表达预测NHL患者CRS、IP发生的价值分析
3 讨 论
正常状态下,机体抗炎性细胞因子与促炎性细胞因子保持相对平衡,当病毒、细菌等侵入机体后可导致诸多免疫细胞激活,释放大量细胞因子,当体内细胞因子到达某一阈值即可引起CRS。而IP的发生也与炎性因子密切相关,故从该角度而言2种疾病的发生机制存在一定共性。现有研究发现,炎性小体与动脉粥样硬化、慢性关节炎等炎性疾病及肿瘤密切相关[13]。NLRP3炎性小体是目前研究热点,其常表达于单核细胞、中性粒细胞、树突状细胞及巨噬细胞中,是由Caspase-1、ASC及NLRP3组成的蛋白复合物,其可通过调节适应性免疫及固有免疫、肠道微生物、细胞凋亡等生物学行为影响肿瘤进程,其活化介导的炎性反应可影响肿瘤发生、进展、侵袭、转移等阶段[14-15]。关于NLRP3炎性小体与CRS、IP关系的研究是近年来国内外新的方向及思路,相关报道少见。
CAR-T免疫疗法是一种精准型靶向治疗肿瘤细胞技术,通过提取患者自身T淋巴细胞,实验室培养后回输至患者体内,以达到攻击自身肿瘤细胞的目的。Neelapu等[16]研究发现,101例弥漫性大B细胞淋巴瘤经CAR-T细胞免疫治疗后的完全缓解率、总体反应率分别为54%、82%,18个月总生存率为52%。肖霞等[17]研究报道,22例B细胞淋巴瘤输注CAR-T细胞后总体完全缓解率、部分缓解率、总有效率分别为45.5%、31.8%、77.3%,但CRS的发生率为63.6%。目前,临床针对CRS的发病机制尚未完全阐明,多认为与免疫细胞过度激活、细胞因子大量释放等有关。Hu等[18]研究发现,CAR-T细胞的单链抗体可变区片段与肿瘤细胞表面的靶抗原相结合后,可促使IL-10、IFN-γ、IL-6等炎性细胞因子大量分泌,导致抗炎、促炎细胞因子失衡,进而造成剧烈的炎性免疫反应发生。Shimabukuro-Vornhagen等[19]研究报道,CAR-T治疗后CRS的发生与靶细胞直接裂解所释放的IFN-γ、IL-6等因子有关,且还可能由活化的T细胞释放的趋化因子及促炎细胞因子刺激内皮细胞、树突状细胞及巨噬细胞活化所诱导。本研究中,CRS组外周血NLRP3、ASC、Caspase-1的mRNA表达及CRP、IL-6、IL-10等炎性细胞因子水平均高于非CRS组,NLRP3、ASC、Caspase-1的mRNA表达水平均与炎性细胞因子水平呈正相关,且三者升高是CRS发生的危险因素,联合预测CRS发生的AUC为0.916,可见NLRP3炎性小体的活化在CRS患者CRP、IL-6等各种炎性因子的释放及成熟过程中发挥重要作用,且可有效预测CRS的发生。推测其原因可能在于NLRP3通路信号被激活后可经 Caspase-1水解前体IL-18、前体IL-1β等,使其成为具有活性的IL-18、IL-1β,进一步诱导相关细胞因子的加工分泌、细胞凋亡,从而调节固有免疫系统过程,加剧炎性反应。
国内外关于NHL患者化疗后IP发生率的报道不一,蒙延娜等[20]研究报道,弥漫大B细胞淋巴瘤接受RCHOP、RCDOP化疗方案后的IP发生率分别为2.60%、28.95%。Huang等[21]研究报道,NHL患者化疗后IP发生率为4.9%。临床针对化疗相关IP的诊断以影像学特点、临床表现为主,但仍面临一定挑战,如影像学特征中的磨玻璃样表现与肺孢子虫感染或病毒性感染相似,临床症状与感染性肺部疾病难以鉴别。近年来,不断有研究证实,NLRP3炎性小体与肺部疾病相关。张燕等[22]研究报道,NLRP3 mRNA可能参与活动期结核的炎性反应过程。张帆等[23]研究发现,NLRP3炎性小体促分泌产物IL-18、IL-1β可有效预测风湿性关节炎合并IP。本研究中,IP组外周血NLRP3、ASC、Caspase-1的mRNA表达水平均高于非IP组,且NLRP3炎性小体预测化疗相关IP发生的AUC为0.935,可见NLRP3炎性小体表达在IP的发生中发挥重要作用,推测其机制可能与炎性小体的激活物和/或炎性小体的效应产物均存在于IP患者的气道中,可伴随炎性因子活性增加并与炎性小体的信号通路激活有关;此外,NLRP3炎性小体可通过活化后产生的IL-1β等炎性因子调控TGF-β表达,促进成纤维细胞活化为肌成纤维细胞,合成分泌细胞外基质,促进基质沉积,从而导致肺纤维化,诱发IP。但本研究为单中心、回顾性分析,且纳入的样本量较少,导致结果存在一定偏倚,故后期需进一步展开前瞻性、大样本量的临床研究。
综上所述,NHL初诊时NLRP3炎性体信号通路的异常活化与炎性细胞因子水平相关,且NLRP3炎性小体表达水平是影响CRS及IP发生的危险因素,可有效预测CRS及IP发生。
利益冲突:所有作者声明无利益冲突
作者贡献声明
张艳彬:提出研究思路,设计研究方向,课题设计,论文撰写;陈文昆:设计研究方案、研究流程;周寅:实施研究过程,资料搜集整理;张小娟:分析整理试验数据,进行统计学分析;李魁星:课题设计,论文审核,论文修改

