一株耐高温诱变鼠李糖乳杆菌产酸条件优化及其特性分析
高若珊,杨春华,王 冰,石彦国,吕铭守
(哈尔滨商业大学食品工程学院 黑龙江省普通高校食品科学与工程重点实验室黑龙江省谷物食品与谷物资源综合加工重点实验室 哈尔滨 150028)
豆腐制作过程中产生的副产物——黄浆水,是一种富含蛋白质、脂肪、糖类、盐类等物质的天然培养基[1-3]。我国传统的酸浆豆腐是由黄浆水自然发酵形成的酸浆经点制而成,而传统的酸浆大多由地方小作坊自然发酵制成,地域性强,难以大规模生产[4-5]。酸浆的酸度容易受外界因素影响,环境不稳定,酸浆品质也不稳定,导致制作的酸浆豆腐品质不稳定。现有研究发现酸浆在自然发酵过程中的主要产酸菌为乳酸菌[6-9],所产多种有机酸丰富了酸浆豆腐的风味,同时可作为酸浆豆腐的蛋白凝聚剂。此外,酸浆在自然发酵过程中除有益菌以外,还产生许多杂菌,容易导致所生产的酸浆豆腐品质不好,货架期短。若将酸浆改为纯种发酵[10-11],则可有效解决以上问题。
本研究以豆腐生产过程中的副产物——黄浆水为培养基,对实验室前期诱变选育的耐高温乳酸菌(鼠李糖乳杆菌)进行纯种发酵制作酸浆。以产酸量、pH 值为考察指标,研究发酵温度、发酵时间、乳酸菌接种量及预培养时间对乳酸菌纯种发酵黄浆水产酸量和pH 值的影响,采用正交试验对乳酸菌纯种发酵黄浆水制作酸浆的工艺条件进行优化,采用高效液相色谱法(HPLC)测定酸浆中有机酸的种类、含量,对乳酸菌诱变前、后的产酸条件及代谢通路进行对比分析[12-15],以期提高豆腐酸浆的产酸量,提高酸浆豆腐的品质,为丰富酸浆豆腐风味提供理论依据和技术支持。
1 材料与方法
1.1 材料与试剂
发酵酸浆用菌株为本实验室前期保存及诱变选育的鼠李糖乳杆菌 (Lactobacillus rhamnosus),分别编号为:HCUL 1.1801-1912 (哈尔滨商业大学食品工程学院粮油学科实验室保藏)、HCUL 1.1901-1912(哈尔滨商业大学食品工程学院粮油学科实验室保藏,CGMCC 保藏登记入册编号:19309)。文中涉及菌株均以编号代替。
黄浆水:哈尔滨商业大学实验室自制。
无水乙醇、氢氧化钠、酚酞均为分析纯级,天津市光复科技发展有限公司;氯化镁(食品级),天津硕海化工有限公司;琥珀酸标准品、草酸标准品、富马酸标准品、苹果酸标准品、柠檬酸标准品、α-酮戊二酸、乳酸标准品、丙酮酸标准品均为分析纯级,美国Sigma-Aldrich 公司。
1.2 仪器与设备
FDM-Z100 自分离大豆磨浆机,镇江新区大港晶晶食品机械厂;DHP-9052 培养箱,上海合恒仪器设备有限公司;HWS 水浴锅,绍兴万力仪器有限公司;PHS-3C pH 计,上海仪电分析仪器有限公司;HPLC I-Class 超高效液相色谱、LC-MS/MS XEVO TQ-XS 串联四极杆质谱、ACQUITY UPLC BEH C8 反向色谱柱,美国Waters 公司。
1.3 试验方法
1.3.1 试验技术路线 豆腐黄浆水→过滤灭菌→接菌发酵→单因素实验→正交优化→有机酸检测→代谢通路分析
1.3.2 菌株活化扩培 采用MRS 肉汤培养基对乳酸菌HCUL 1.1901-1912 进行活化,将前期保存的乳酸菌接种于10 mL MRS 液体培养基中,37℃恒温培养24 h,再用接菌环将其接种于另一个装有10 mL MRS 液体培养基的试管中,37 ℃恒温培养24 h,经过2~4 次活化后,采用平板计数法测定其活菌数,直至培养基内活菌数大于106CFU/mL,待用。
将预先活化好的乳酸菌以5%的接菌量接种于100 mL 灭菌的MRS 液体培养基内,置于37 ℃恒温培养箱内静置培养24 h 后,备用。
1.3.3 酸浆中产酸量及pH 值的测定 将5 mL待测液放入250 mL 的锥形瓶中,用排CO2后的蒸馏水稀释适当倍数,滴3 滴指示液(0.1%)并摇匀,用0.1 mol/L NaOH 的标准溶液对试液进行滴定,滴定终点为微红色且30 s 不褪色,记录消耗标准NaOH 溶液的体积并计算其总产酸量[16-17]。

式中,C2——产酸量,g/L;C1——标准NaOH溶液浓度,mol/L;F——试液稀释倍数;V1——滴定发酵液所消耗NaOH 标准溶液的体积,mL;V2——滴定空白对照组所消耗NaOH 标准溶液的体积,mL;V3——待测发酵液体积,mL。
采用雷磁PHS-3C pH 计测定pH 值。
1.3.4 乳酸菌纯种发酵黄浆水的产酸条件优化
1.3.4.1 发酵温度对产酸量及pH 值的影响 将活化好的菌株HCUL 1.1901-1912 以12 h 的预培养时间,按5%的乳酸菌接种量接种于500 mL 灭菌的黄浆水中,分别置于32,35,37,39,42 ℃的培养箱中静置发酵培养24 h,在无菌操作下取出少量发酵液,测其发酵液的总酸和pH 值,以产酸量和pH 值为指标,考察发酵温度对乳酸菌发酵黄浆水的影响。
1.3.4.2 发酵时间对产酸量及pH 值的影响 将活化好的菌株HCUL 1.1901-1912 以12 h 的预培养时间,按5%的乳酸菌接种量接种于500 mL 灭菌的黄浆水中,置于37 ℃的培养箱中静置培养,分别发酵培养8,12,16,20,24 h,在无菌操作下取出少量发酵液,测其发酵液的总酸和pH 值,以产酸量和pH 值为指标,考察发酵时间对乳酸菌发酵黄浆水的影响。
1.3.4.3 乳酸菌接种量对产酸量及pH 值的影响 将活化好的菌株HCUL 1.1901-1912 以12 h 的预培养时间,分别按3%,4%,5%,6%,7%的乳酸菌接种量接种于500 mL 灭菌的黄浆水中,置于37 ℃的培养箱中静置发酵培养24 h,在无菌操作下取出少量发酵液,测其发酵液的总酸和pH 值,以产酸量和pH 值为指标,考察接种量对乳酸菌发酵黄浆水的影响。
1.3.4.4 预培养时间对产酸量及pH 值的影响 将活化好的菌株HCUL 1.1901-1912 分别预培养8,10,12,14,16 h,按5%的接种量接种于500 mL灭菌的黄浆水中,置于37 ℃的培养箱中静置发酵培养24 h,在无菌操作下取出少量发酵液,测其发酵液的总酸和pH 值,以产酸量和pH 值为指标,考察预培养时间对乳酸菌发酵黄浆水的影响。
1.3.5 乳酸菌纯种发酵黄浆水条件优化试验 由于在不同的发酵温度、发酵时间、乳酸菌接种量及预培养时间下产酸量相差较大,为了得到更佳的工艺参数,在单因素实验结果的基础上,设计了L9(34)正交试验。正交试验因素和水平见表1。

表1 L9(34)正交试验的因素和水平Table 1 Factors and levels of orthogonal experiment
1.3.6 酸浆中有机酸HPLC 分析法
1.3.6.1 样品处理 自制酸浆(HCUL 1801-1912纯种发酵酸浆、HCUL 1901-1912 纯种发酵酸浆)经4 000 r/min 离心20 min 后取上清液,经0.45 μm 水系滤膜过滤,若有机酸浓度过高可以适当稀释,经超声脱气后供分析使用。
1.3.6.2 有机酸HPLC 分析方法 色谱条件参照食品安全国家标准 食品有机酸的测定(GB 5009.157-2016)[17],色谱柱:ZORBAX Eclipse Plus C18 4.6 mm×250 mm,5 μm;柱温:40 ℃;进样量:20 μL;检测器:UV 210 nm;流动相:用0.1%磷酸溶液+甲醇=97.5%+2.5%(体积分数)流动相等度洗脱10 min,然后用1 min 让甲醇相达到100%并平衡5 min,再将流动相调整为0.1%磷酸溶液+甲醇=97.5%+2.5%(体积分数),平衡5 min。8 种有机酸在此条件下可以达到基线分离。
1.4 数据处理
有机酸数据使用TargetLynx 数据分析软件。采用内标标曲法,以浓度对应化合物峰面积与同位素峰面积的比值做线性回归方程和线性相关系数。使用此标曲定量样本。
本试验每组数据平行测定3 次,结果取平均值,并使用Spss16.0 统计软件、Origin Pro 2018 软件及Excel 软件,对试验所得数据进行整理及处理,计算相对标准偏差并绘图分析。
2 结果与分析
2.1 产酸条件优化结果分析
不同发酵温度对黄浆水的产酸量及pH 值的影响如图1所示。不同发酵时间对黄浆水的产酸量及pH 值的影响如图2所示。不同接种量对黄浆水的产酸量及pH 值的影响如图3所示。不同预培养时间对黄浆水的产酸量及pH 值的影响如图4所示。
由图1可知,随着发酵温度的不断升高,产酸量先上升后下降,pH 值先下降后上升。当发酵温度从32 ℃升至37 ℃时,产酸量也在不断上升,pH值不断下降;当发酵温度为37 ℃时,产酸量达到最高49.00 g/L,pH 值则达到最低3.6,说明这株乳酸菌在此温度下能够很好的生长繁殖,其代谢产生的酸也最多;发酵温度在37 ℃之后继续升高,产酸量开始下降,pH 值开始上升。这表明发酵温度在一定范围内能够促进乳酸菌的生长,超过这一范围则会限制其生长,因此这株乳酸菌在黄浆水中的最适生长繁殖温度为37 ℃。
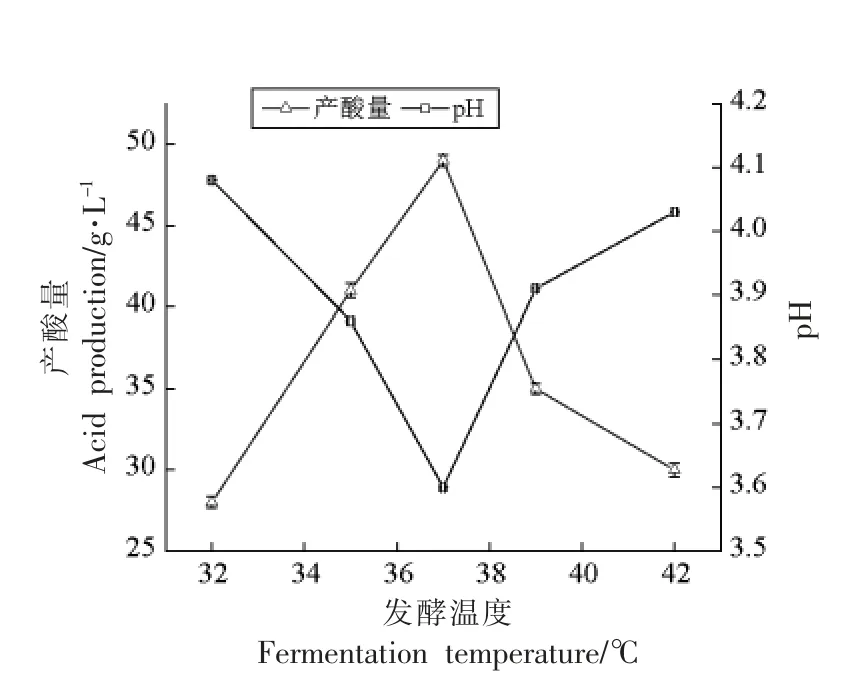
图1 不同发酵温度对发酵黄浆水产酸量及pH 值的影响Fig.1 Changes of acid production and pH values of the tofu whey during fermentation under different fermentation temperatures
由图2可知,随着发酵时间的延长,产酸量也逐渐升高。当发酵时间由8 h 升至16 h 时,pH 值显著下降,产酸量逐渐增加,说明适当延长发酵时间会促进菌株生长,从而提高产酸量。当发酵时间由16 h 升至24 h 时,pH 值和产酸量变化趋于平稳。随着发酵时间的逐渐延长,pH 值并没有显著降低,这说明并非发酵时间越长越好,因为发酵时间过长,乳酸菌产酸量过多,使发酵液内的环境不适合乳酸菌的生长,从而抑制乳酸菌发酵黄浆水的后发酵品质,易污染杂菌。综合发酵周期、产酸量等方面的因素,发酵时间在16 h 时发酵液的pH 值和产酸量均较好,此时发酵液pH 值为4.11,产酸量为66.01 g/L。

图2 不同发酵时间对发酵黄浆水产酸量及pH 值的影响Fig.2 Changes of acid production and pH values of the tofu whey during fermentation under different fermentation time
由图3可知,随着接种量的增加,发酵24 h内,酸浆的产酸量先增加后降低,pH 值先降低后升高,当接种量为5%时,酸浆的pH 值下降最快,同时产酸量也增加最多,当接种量超过5%时酸浆的pH 值开始上升,产酸量逐渐下降,接种量为5%时酸浆的pH 值为3.6,产酸量为47.03 g/L。当接种量过低,乳酸菌的生长缓慢,导致产酸速率较慢;当接种量过大时,乳酸菌生长过快,会造成发酵液内菌体密度过高,抑制乳酸菌后期生长,从而抑制其产酸。综上所述,本研究选择5%的乳酸菌接种量进行后续研究。

图3 不同接种量对发酵黄浆水产酸量及pH 值的影响Fig.3 Changes of acid production and pH values of the tofu whey during fermentation under different inoculum amounts
由图4可知,当预培养时间由8 h 升至12 h时,产酸量缓慢升高,pH 值显著上升。当预培养时间由12 h 升至16 h 时,产酸量迅速降低,pH 值缓慢降低后趋于平稳。随着预培养时间的逐渐延长,pH 值并没有显著降低,这说明并非预培养时间越长越好。由于乳酸菌在8 h 时为对数生长期初期,综合乳酸菌生长周期、产酸量等方面的因素,预培养时间为8 h 时发酵液pH 值最好,产酸量较好,此时发酵液的pH 值为3.4,产酸量为46.04 g/L。

图4 不同预培养时间对发酵黄浆水产酸量及pH 值的影响Fig.4 Changes of acid production and pH values of the tofu whey during fermentation under different preculture time
在乳酸菌发酵黄浆水单因素实验结果的基础上,以发酵时间、发酵温度、乳酸菌接种量、预培养时间为影响乳酸菌发酵黄浆水产酸量的因素,其正交优化试验结果见表2。
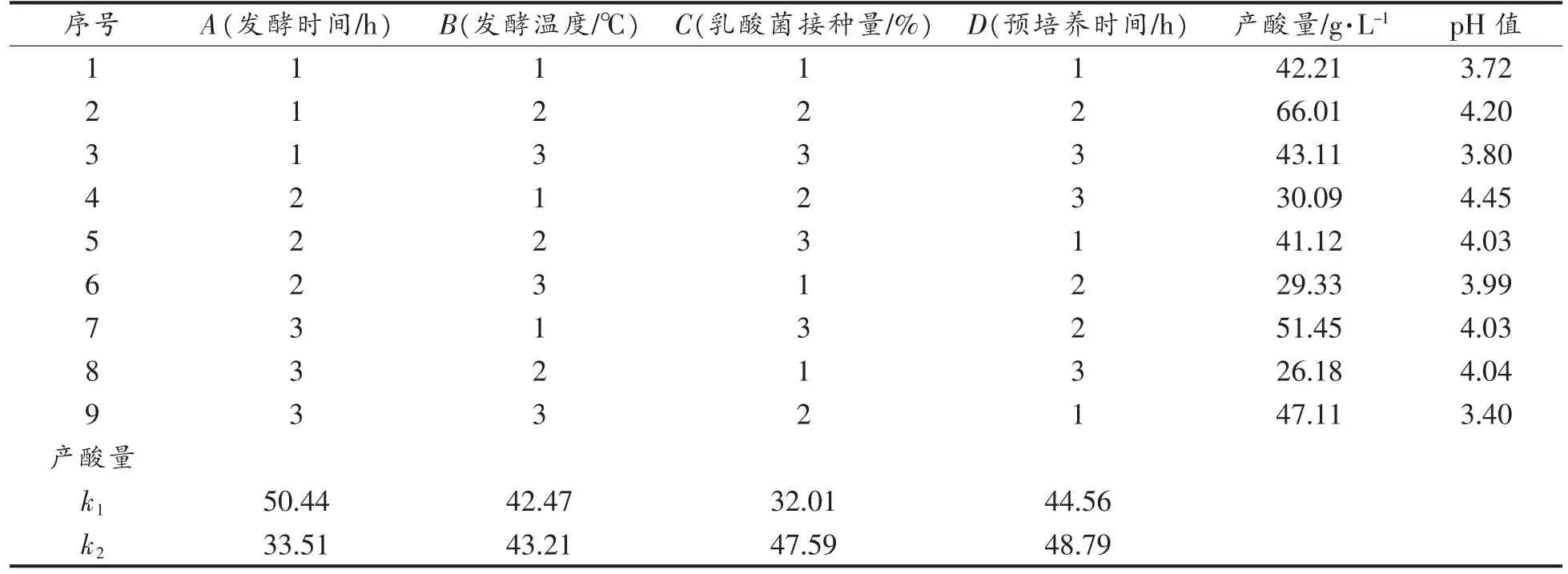
表2 正交试验L9(34)结果及分析Table 2 Results and analysis of the orthogonal experiment L9(34)

(续表2)
通过表2的正交试验结果可知,根据r 值确定影响乳酸菌发酵黄浆水产酸量的因素由主到次依次为:A(发酵时间)>D(预培养时间)>C(接种量)>B(发酵温度);影响乳酸菌发酵黄浆水pH 值的因素由大到小依次为:D(预培养时间)>B(发酵温度)>A(发酵时间)>C(接种量)。由极差分析得出各因素的最优组合,以产酸量为评价指标时,得出最优的发酵工艺条件是A1D2C2B2;而以pH 值为评价指标时,最优的发酵工艺条件为D3B2A2C2。最终选择A2D2C2B2为最优组合,即:发酵温度37 ℃,发酵时间16 h,预培养时间12 h,接种量5%。对比课题组前期优化的诱变前菌株HCUL 1.1801-1912 纯种发酵酸浆条件,即:发酵温度37 ℃,发酵时间48 h,预培养时间24 h,接种量5%,产酸量为39.3 g/L。可以发现HCUL 1.1901-1912 纯种发酵酸浆所需的发酵时间及预培养时间都较HCUL 1.1801-1912 纯种发酵酸浆所需发酵时间及预培养时间大大缩短。且HCUL 1.1901-1912 纯种发酵酸浆的发酵终点产酸为43.11 g/L,比诱变前产酸量高了9.7%。因此,得出HCUL 1.1801-1912 纯种发酵酸浆优化后的条件不仅可以保证酸浆发酵效果,而且可以提高生产效率,对于酸浆发酵生产工业化及酸浆豆腐生产制作工业化提供了理论依据和技术支撑。
2.2 纯种发酵酸浆有机酸组成及代谢通路分析
2.2.1 纯种发酵酸浆有机酸组成分析 用HPLC法检测纯种发酵酸浆中的有机酸组成成分及含量,将诱变前、后菌株发酵的酸浆作为对比,其有机酸组成成分及含量如图5、图6所示。

图5 菌株HCUL 1.1801-1912 及HCUL 1.1901-1912分别纯种发酵2 种有机酸含量对比图Fig.5 Two major organic acids concentrations fermented by HCUL 1.1801-1912 and HCUL 1.1901-1912

图6 菌株HCUL 1.1801-1912 及HCUL 1.901-1912分别纯种发酵6 种有机酸含量对比图Fig.6 Six organic acids concentrations fermented by HCUL 1.1801-1912 and HCUL 1.1901-1912
由图5、图6有机酸HPLC 分析结果可知,HCUL 1.1801-1912 纯种发酵的酸浆中8 种有机酸的含量从大到小分别为:乳酸2 374.78 μg/mL、柠檬酸977.46 μg/mL、琥珀酸35.21 μg/mL、草酸19.57 μg/mL、丙酮酸15.75 μg/mL、α-酮戊二酸9.56 μg/mL、苹果酸4.16 μg/mL、富马酸0.10 μg/mL,8 种有机酸总含量为3 436.61 μg/mL。由此可知,菌株HCUL 1.1801-1912 发酵黄浆水的过程中主要产乳酸,符合制作酸浆豆腐凝固剂的要求,适合用来点制酸浆豆腐。
HCUL 1.1901-1912 纯种发酵的酸浆中8 种有机酸的含量从大到小分别为:乳酸2 904.16 μg/mL、柠檬酸1 106.87 μg/mL、琥珀酸110.67 μg/mL、丙酮酸28.91 μg/mL、草酸19.64 μg/mL、苹果酸18.58 μg/mL、α-酮戊二酸11.24 μg/mL、富马酸4.90 μg/mL,8 种有机酸总含量为4 204.99 μg/mL,其中乳酸、柠檬酸、琥珀酸、丙酮酸、草酸、苹果酸、α-酮戊二酸、富马酸分别较诱变前纯种发酵的酸浆提高了1.22,1.13,3.14,1.84,0.01,4.47,1.18,49.00 倍,由此可知,菌株HCUL 1.1901-1912 发酵黄浆水的过程中主要产乳酸,其次是柠檬酸,其它有机酸含量较低。
2.2.2 纯种发酵酸浆的有机酸代谢通路分析 根据对乳酸菌代谢通路的研究,结合酸浆中有机酸含量变化,绘制图7为乳酸菌发酵黄浆水的代谢通路图。

图7 乳酸菌发酵黄浆水的代谢通路图(μg/mL)Fig.7 Organic acid metabolic pathway of fermented tofu whey cultured by lactic acid bacteria (μg/mL)
由图7可知,乳酸菌加入黄浆水后,利用黄浆水本身的营养物质进行发酵。葡萄糖进入细胞后发生糖酵解反应生成丙酮酸。丙酮酸在L-乳酸脱氢酶的作用下生成乳酸,在未破碎细胞的情况下进行有机酸检测,测得的丙酮酸含量较低,乳酸含量很高。这是由于丙酮酸主要作为代谢中间产物在细胞内反应,只有少量丙酮酸在胞外分泌,而乳酸作为初级代谢产物大部分分泌到胞外环境。这解释了丙酮酸与乳酸之间为可逆反应,然而检测出的结果显示乳酸含量远大于丙酮酸。丙酮酸在丙酮酸羧化酶的作用下生成草酰乙酸,进入三羧酸循环。草酰乙酸作为代谢中间产物,在胞内反应,因此在胞外的含量极低,以至于无法检测到。草酰乙酸在苹果酸脱氢酶的作用下与苹果酸发生可逆反应,同时苹果酸在苹果酸脱氢酶(醌)的作用下生成草酰乙酸,检测出苹果酸含量却未检测出草酰乙酸含量,是由于大部分草酰乙酸转换为苹果酸,而少量苹果酸转化为草酰乙酸,说明苹果酸脱氢酶(醌)为惰性酶。苹果酸在富马酸水合酶的作用下与富马酸发生可逆反应,检测出的苹果酸含量大于富马酸含量,富马酸在琥珀酸脱氢酶作用下与琥珀酸发生可逆反应,检测出的琥珀酸含量也远大于富马酸含量。草酰乙酸在乙醛氧化酶作用下生成草酸,草酸在草酸脱酸酶作用下生成富马酸,检测出的草酸含量大于富马酸含量。产生此结果是由于富马酸不断在胞内进行三羧酸反应,只有少量富马酸在胞外被检测到。富马酸代谢生成络氨酸和精氨酸,是三羧酸循环中重要的一个环节。琥珀酸先生成琥珀酰-CoA,琥珀酰-CoA再生成α-酮戊二酸,α-酮戊二酸代谢生成精氨酸、抗坏血酸、醛酸、丙氨酸、天冬氨酸、谷氨酸、谷氨酰胺和D-谷氨酸。α-酮戊二酸生成异柠檬酸,异柠檬酸生成乌头顺酸,乌头顺酸生成柠檬酸,这个过程中柠檬酸含量大幅提升,说明这几个过程的酶都比较活跃,柠檬酸在ATP 柠檬酸合酶的作用下又生成草酰乙酸,实现三羧酸循环[18-20]。产酸含量的差异对酸浆豆腐的风味、蛋白凝聚效果等均会产生影响[21-22]。
3 结论
本研究对酸浆发酵条件进行优化,通过发酵时间、发酵温度、乳酸菌接种量及预培养时间的单因素实验结果,从中选择对纯种乳酸菌发酵影响最大的4 因素3 水平进行正交试验[23-26]。通过正交试验优化得到黄浆水纯种发酵产酸量最佳的发酵条件为:发酵温度37 ℃,发酵时间16 h,预培养时间12 h,接种量5%,产酸量达6.57 g/L。将HCUL 1.1901-1912 纯种发酵黄浆水得到的酸浆和HCUL 1.1801-1912 纯种发酵黄浆水得到的酸浆进行有机酸对比分析,可知诱变后的耐高温菌HCUL 1.1901-1912 有机酸种类不变,且各个有机酸含量均大幅增长,特别是乳酸的含量显著提高[27]。其中乳酸、柠檬酸、琥珀酸、丙酮酸、草酸、苹果酸、α-酮戊二酸、富马酸分别较诱变前的乳酸菌HCUL 1.1801-1912 纯种发酵的酸浆提高了1.22,1.13,3.14,1.84,0.01,4.47,1.18,49.00 倍。不同种类的有机酸含量增长可在一定程度上丰富酸浆豆腐产品的风味及蛋白凝聚性[28]。因此,本研究得到的乳酸菌纯种发酵酸浆优化条件,可以为以黄浆水为发酵基质开发的发酵凝固剂提供理论依据和技术支持。

