白藜芦醇调控Wnt/β-catenin信号通路抑制胶质瘤细胞的机制*
宁晓丽, 王炎, 余跃
(安徽医科大学附属巢湖医院 麻醉与疼痛科, 安徽 合肥 238000)
胶质瘤是中枢神经系统最具有侵袭性的肿瘤之一,其发病率和死亡率均居世界前列[1]。尽管随着医疗技术的发展,对于各类肿瘤的治疗效果已经取得了巨大进展,但是胶质瘤患者的预后仍然较差、死亡率较高,主要是因为胶质瘤具有较强的增殖性和侵袭能力,因此对胶质瘤患者的治疗可考虑由其分子机制入手,抑制肿瘤细胞的增殖、侵袭和迁移,提高凋亡率,以获得较佳的临床疗效[2]。白藜芦醇是花生、葡萄、虎杖等植物中广泛存在的物质,已有作为一种抗氧剂,能够抑制血小板聚集、预防心脑血管疾病,临床多将其用于对冠心病、动脉粥样硬化、高血脂以及缺血性心脏病等患者的防治中[3]。白藜芦醇可抑制多种细胞的增殖,促进肿瘤细胞凋亡,并在结肠癌、肺癌、乳腺癌、肝癌等的研究中获得一定的效果,虽然尚未明确其具体作用机制,但是其作用效果仍为临床治疗胶质瘤患者提供了新的方向[4]。Wnt信号转导通路对于胚胎的生长和形态发育具有一定调控作用,且Wnt/β-catenin信号转导通路已经明确与胶质瘤的发生和发展相关[5],因此本研究从白藜芦醇对Wnt/β-catenin信号通路的调控作用来分析其对胶质瘤细胞的作用机制,以期能为临床治疗提供参考,现报道如下。
1 村料与方法
1.1 材料
1.1.1细胞 由上海中国科学院细胞库购入胶质瘤细胞株U251,将其培养于高糖克改良伊格尔培养基(dulbecco modified eagle medium, DMEM)培养基(四季青公司,含10%胎牛血清、链霉素 10 mg/L、青霉素105 IU/L),置于5%二氧化碳(carbon dioxide,CO2)、37 ℃的细胞恒温培养箱内培养,细胞融合度为70%及以上时进行细胞传代,取对数生长期的细胞用于实验。
1.1.2试剂与器材 试剂:胎牛血清(杭州江滨生物技术有限公司)、DMEM细胞培养液(美国Hyclone公司)、二甲基亚砜[百运渡(上海)生物科技有限公司]、Trizol试剂(美国Invitrogen公司)、噻唑蓝(武汉卡诺斯科技有限公司)、CCK-8试剂盒(碧云天生物技术有限公司)、Annexin V/PI凋亡试剂盒(北京索莱宝科技有限公司)、反转录试剂盒(伊艾博医疗有限公司)、实时定量PCR(real-time quantitative,qPCR)试剂盒(日本Toyobo公司)、碘化丙啶(PI,西安瑞禧生物科技有限公司)、四甲基偶氮唑盐(MTT,美国Sigma公司)、磷酸缓冲盐溶液(PBS,武汉普诺赛生命科技有限公司)、SYBR mix(碧云天生物技术有限公司)、注射用白藜芦醇(扶风斯诺特生物科技有限公司)。器材:超净工作台(山东博科生物产业有限公司)、恒温培养箱(无锡玛瑞特科技有限公司)、电子天平(邢台中德机械制造有限公司)、TGL-16台式高速离心机(金坛市科析仪器有限公司)、酶标仪(美国Thermo公司)、流式细胞仪(美国BD公司)。
1.2 实验方法
1.2.1CCK-8试剂盒检测细胞活性 将胶质瘤细胞U251细胞接种于完全培养基(100 μL)的96孔板内,密度为2×103细胞/孔,细胞贴壁后,分别于每孔内加入0(对照组)、25(低剂量组)、50(中剂量组)以及100 μmol/L(高剂量组)的白藜芦醇[6]进行24、48、72 h处理;并在各时间点处理完毕后弃去培养液,每孔内加入100 μL二甲基亚砜,室温下震荡10 min,使用酶联免疫检测仪检测波长450 nm的吸光值(OD值)。
1.2.2Transwells小室检测细胞迁移和侵袭情况 (1)迁移:在Transwell小室上室内加入DMEM培养基(1 ∶8稀释),将0.5 g/L Fibronectin使用移液枪涂抹至下室面,置于5%CO2、37 ℃的培养箱内包被2 h,加Matrigel凝固成胶,置于4 ℃下过夜风干;将所取U251细胞分别加入0(对照组)、25(低剂量组)、50(中剂量组)以及100 μmol/L(高剂量组)的白藜芦醇干预24、48以及72 h;将细胞拿出小室,并吸去残余液体,每小室内加入100 μL的DMEM,置于37 ℃孵育30 min,水化基底膜。收集各组细胞,重悬于DMEM培养液内,调整密度为5×107/L,接种于上室,下室内加入10%胎牛血清的DMEM培养液(600 μL),置于5%CO2、37 ℃下培养24 h,取出小室,PBS清洗2次,加入4%多聚甲醛室温下固定15 min,PBS清洗2次,将上室面残余细胞擦拭干净,使用结晶紫染色15 min,使用200倍光镜观察穿膜细胞数,设3个独立样本,由两位实验人员平行观测各2次;(2)侵袭:操作同迁移检测实验,各组细胞培养24、48以及72 h后,将小室上层细胞和Matrigel基质胶轻擦后PBS洗涤3次,后续操作同迁移检测,封片后拍照观察6个视野的细胞计数。
1.2.3Annexin V/PI凋亡试剂盒检测细胞凋亡率 收集白藜芦醇处理的各组细胞,使用PBS清洗3次,25 ℃, Annexin V-FITC 5 μL和PI 10 μL对细胞悬液进行黑暗染色15 min,混匀置于2~8 ℃下孵育5 min,1 h内使用流式细胞仪检测细胞凋亡率,各设3个独立样本,由两位实验人员平行观测各2次,依据散点图计算各组细胞的凋亡率。
1.2.4Western blot检测细胞Wnt3a、β-catenin蛋白表达 将对数生长期U251细胞内加入蛋白酶抑制剂PMSF和RIPA裂解缓冲液,4 ℃下孵育30 min,以12 000 r/min的速率离心10 min(半径7 cm),分离细胞碎片。使用蛋白浓度定量法对蛋白浓度进行测定,加入蛋白上样缓冲液煮沸蛋白5 min,进行聚丙烯酰胺凝胶电泳(90 min),以分离蛋白;用湿转法将分离后的蛋白转移至聚偏二氟乙烯膜上(PVDF),切取目的条带PVDF膜,使用5%脱脂奶粉封闭液于室温下封闭2h,分别加入一抗Wnt3a(1 ∶1 000)、β-catenin(1 ∶1 000),置于4 ℃下反应过夜;使用TBST洗膜3次、5 min/次,然后加入对应二抗(稀释比例均为1 ∶10 000),置于37 ℃下孵育2 h,TBST洗膜2次、10 min/次,以β-actin为参照,电化学发光法显影。
1.2.5RT-qPCR检测Wnt3a、β-cateninmRNA表达 使用Trizol试剂盒提取U251细胞总RNA,使用RNA反转录试剂盒反转录为cDNA,在Bio-Rad IQ5 PCR仪上扩增,并检测mRNA表达量。反应体系为cDNA模板1 μL,SYBR mix 10 μL,20 μmol/L PCR上下游引物各1 μL,RNA无酶水20 μL。条件:95 ℃、5 min,95 ℃、30 s,60 ℃、30 s,40个循环;72 ℃、30 s,72 ℃、10 min。β-catenin上游引物5′-CTGCAGGGGTCCTCTGTG-3′,下游引物5′-TGCATATGTCGCCACACC-3′;Wnt3a上游引物5′-GTCACCTAGCAAGCTGCCGAACC-3′,下游引物5′-CGACAGACAAAGCGTCCCTCAAG-3′。
1.3 统计学分析
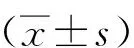
2 结果
2.1 细胞活性
与对照组相比,各白藜芦醇培养组细胞培养24、48以及72 h时细胞活性均降低,且各白藜芦醇培养组的细胞活性随培养时间的延长而降低(P<0.05);各培养时间下,低剂量组的细胞活性均最高,高剂量组均最低,差异有统计学意义(P<0.025)。见表1。
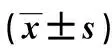
表1 不同培养时间下各组细胞的活性比较Tab.1 Comparison of cell viability at different time points in each
2.2 细胞侵袭实验
与对照组相比,各白藜芦醇培养组细胞培养24、48、72 h时细胞侵袭个数均减少,且各白藜芦醇培养组的细胞侵袭个数均随培养时间的延长而增加(P<0.05);各培养时间下,低剂量组的细胞侵袭个数均最多,高剂量组均最少,差异有统计学意义(P<0.025)。见表2、图1。
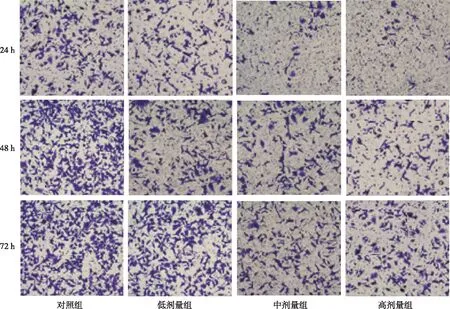
图1 各组细胞的侵袭实验结果(Transwells小室,×400)Fig.1 Cell Invasion at different time points in each group (Transwell chamber,×400)
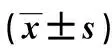
表2 不同培养时间下各组的细胞侵袭个数比较Tab.2 Comparison of invading cell numbers at different time points in each
2.3 细胞迁移实验
与对照组相比,各白藜芦醇培养组细胞培养24 h、48 h、72 h时细胞迁移个数均减少,且各白藜芦醇培养组的细胞迁移个数均随培养时间的延长而增加,差异有统计学意义(P<0.05);各培养时间下,低剂量组的细胞迁移个数均最多,高剂量组均最少,差异有统计学意义(P<0.025)。见表3、图2。
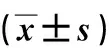
表3 不同培养时间各组细胞迁移数比较Tab.3 Comparison of migrating cell numbers at different time points in each
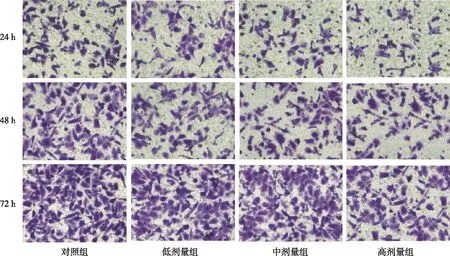
图2 不同培养时间各组细胞的迁移情况(Transwells小室,×400)Fig.2 Cell migration at different time points in each group (Transwell chamber,×400)
2.4 细胞凋亡率
与对照组相比,各白藜芦醇培养组细胞培养24、48以及72 h时细胞凋亡率均升高,且各白藜芦醇培养组的细胞凋亡率均随培养时间的延长而增加(P<0.05);各培养时间下,低剂量组的细胞凋亡率均最低,高剂量组均最高,差异有统计学意义(P<0.025)。见表4、图3。
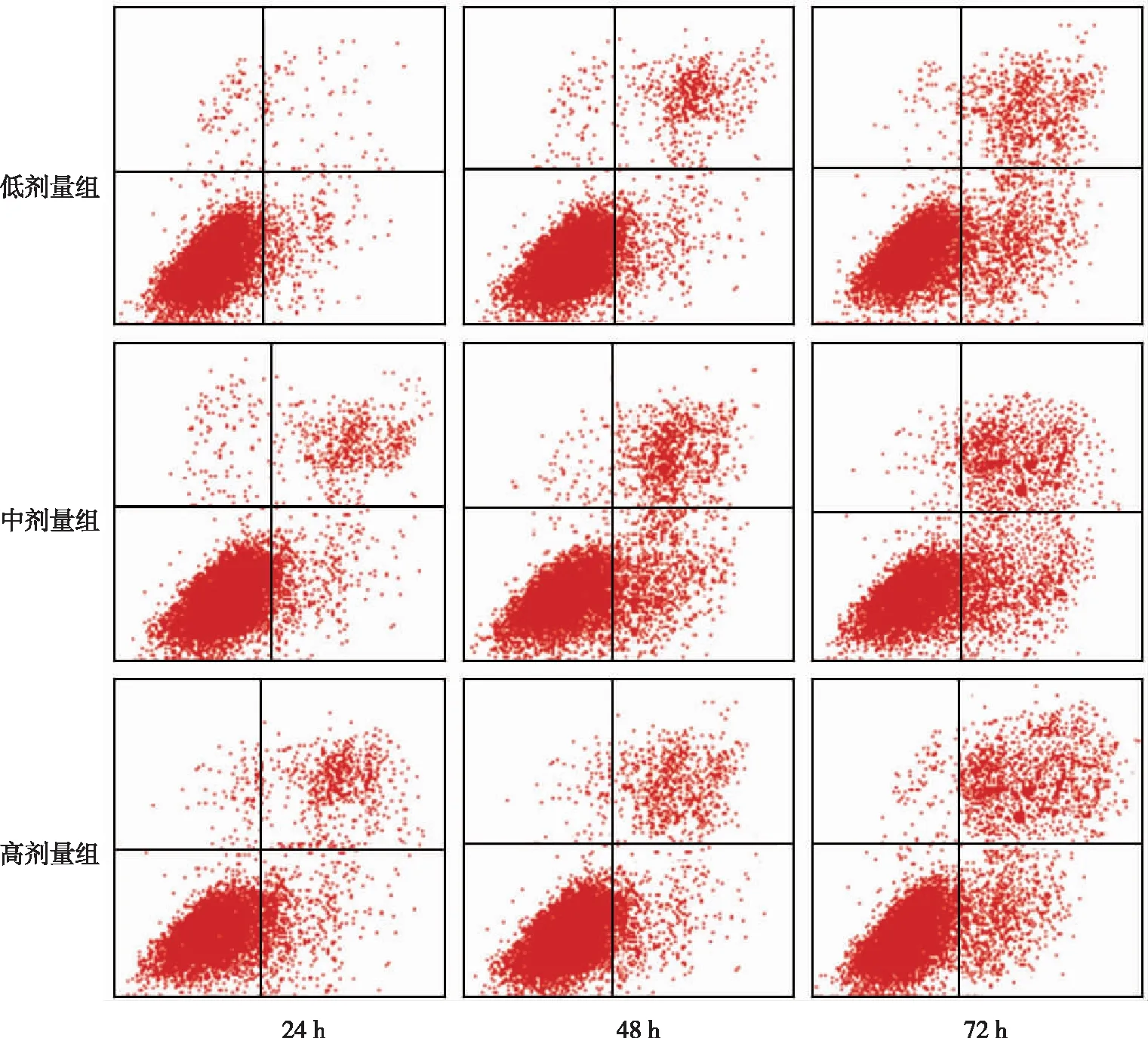
图3 不同培养时间下各组细胞的凋亡情况Fig.3 Cellular apoptosis at different time points in each group
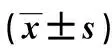
表4 不同培养时间下各组细胞的凋亡率比较Tab.4 Comparison of apoptotic rates at different time points in each
2.5 Wnt3a、β-catenin蛋白表达
与对照组相比,各白藜芦醇培养组细胞培养72 h时Wnt3a、β-catenin蛋白表达均降低,且低剂量组的细胞Wnt3a、β-catenin蛋白表达最高,高剂量组最低,差异有统计学意义(P<0.05)。见表5、图4。
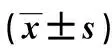
表5 各组细胞培养72 h时的Wnt3a、β-catenin蛋白表达Tab.5 The relative protein expression levels of Wnt3a and β-catenin at 72 h after the treatment in each

图4 各组细胞培养72 h时的Wnt3a、β-catenin蛋白表达(Western blot)Fig.4 The protein expression levels of Wnt3a and β-catenin at 72 h after the treatment in each group (Western blot)
2.6 Wnt3a、β-catenin mRNA水平
与对照组相比,各白藜芦醇培养组细胞培养72 h时Wnt3a、β-cateninmRNA水平均降低,且低剂量组的细胞Wnt3a、β-cateninmRNA水平最高,高剂量组最低,差异有统计学意义(P<0.05)。见表6。
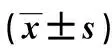
表6 各组细胞培养72 h时的Wnt3a、β-catenin mRNA水平Tab.6 The relative mRNA levels of Wnt3a and β-catenin at 72 h after the treatment in each
3 讨论
Wnt/β-catenin信号通路是一个能够调控胚胎发育、组织器官形成的高度保守通路,其能够激活β-catenin,促使其在细胞核内聚集,进而影响靶基因的转录和表达,对细胞生长进行调控[7-8]。机体在正常状态下的Wnt/β-catenin信号通路为抑制状态,细胞内的β-catenin及其他蛋白以复合物的形式存在于体内,但当机体遭受某些刺激时,泛素蛋白酶依赖的蛋白降解,进而促使机体内β-catenin复合物降解成为β-catenin,导致机体内β-catenin表达明显升高,激活Wnt/β-catenin信号通路[9-10]。研究发现,鼻咽癌、肝癌、舌鳞癌等多种癌症患者体内均存在β-catenin过度表达的情况,而给予患者Wnt/β-catenin信号通路抑制剂则能够抑制肝癌细胞等癌细胞的生长、迁移能力,为临床治疗提供了新方向[11-12]。
白藜芦醇作为植物内常见的含有芪类结构的非黄酮类多酚化合物,早期研究发现其具有抗菌、抗炎、抑制血小板聚集、抗氧化、保肝、降血脂、平喘、镇咳以及免疫调节等生物活性[13-14]。近年来,有学者指出白藜芦醇可发挥抗肿瘤效果,如给予结肠癌细胞系HCT116白藜芦醇培养,能够对多种信号传导通路产生抑制,进而抑制癌细胞增殖[15-16]。细胞恶性增殖为肿瘤的生物特性之一,其主要机制为生物周期紊乱而导致的凋亡受阻和增殖过多,进而导致肿瘤细胞始终处于无法进入静止期的增殖期,而使癌细胞快速增殖,加速病情进展[17-19]。本文研究结果显示,给予胶质瘤细胞U251白藜芦醇干预后,其可通过抑制Wnt/β-catenin信号通路抑制胶质瘤细胞活性,减少细胞侵袭和迁移,促进细胞凋亡,且随着白藜芦醇剂量的升高而作用增强。胰岛素样生长因子-1能够对Wnt/β-catenin信号通路的下游激酶磷脂酰肌醇3-激酶(PI3K)及蛋白激酶B(Akt)产生刺激,进而增加Akt、糖原合成酶激酶3β(GSK3β)的磷酸化和细胞周期蛋白D1水平,促进肿瘤细胞增殖[20-21]。当给予胶质瘤U251白藜芦醇干预时,其能够抑制IGF-1诱导的IGF-1受体-Akt-Wnt信号传导通路,进而下调IGF-1受体信号蛋白表达,抑制胶质瘤细胞的增殖[22-23]。经典Wnt信号通路中,β-catenin浓度为通路的中心地位,若为Wnt信号分子存在,则β-catenin被CKI和GSK3β磷酸化后进入蛋白酶体内降解,而Wnt蛋白与受体结合,则能够通过膜上信号引导APC复合体解体,促使机体内β-catenin表达升高[24-25]。因此在本研究给予胶质瘤细胞U251白藜芦醇干预后,细胞内异常聚集的β-catenin水平降低,进而抑制了c-Myc和cyclinD1基因的表达,进而发挥抑制胶质瘤细胞生长的效果。但是白藜芦醇如何降低异常聚集β-catenin表达,如何促使其降解,或者降低其转录的具体作用机制仍需要进一步探究。
综上所述,白藜芦醇可通过抑制Wnt/β-catenin信号通路抑制胶质瘤细胞活性,减少细胞侵袭和迁移,促进细胞凋亡。

