基于肿瘤基因组图谱数据库分析血管活性肠肽受体1基因在肺腺癌组织中的表达及其临床意义
李晓博,王华启,王云飞,魏小婉,张国俊
(郑州大学第一附属医院 呼吸与危重症医学科,河南 郑州 450052)
人口老龄化、环境恶化、不良生活习惯等使全球癌症负担急剧增加。癌症在中国也成为主要的死亡原因,病例数每年仍在上升,其中肺癌是我国乃至全世界发病率及病死率最高的癌症[1]。2020年,在我国所有疾病中,肺癌病死率居第四,其中肺腺癌已经超越肺鳞癌成为发病率最高的肺癌类型[2]。由于早期肺腺癌多无明显的临床症状,大多数患者初次就诊时已经处于晚期。目前常用于肺腺癌临床诊断及早期筛查的指标有甲状腺转录因子1、NapsinA、细胞角蛋白7、白细胞分化抗原15等,但其特异度和灵敏度均欠佳,能够反映预后的相关标志分子也有待进一步探索。早期肺腺癌常选择手术治疗,Ⅲ期多以放化疗为主,Ⅳ期则以全身治疗为主,可选择放化疗结合靶向治疗及免疫治疗。靶向治疗及免疫疗法已经成为晚期肺腺癌的一线疗法,虽然在临床实践中取得了一定的成绩,但是患者易出现耐药且5 a生存率仍然不高,所以积极寻找相关分子标志物对于肺腺癌的诊断和治疗有重要意义。血管活性肠肽(vasoactive intestinal peptide,VIP)参与肺上皮和肠上皮平滑肌松弛,具有营养神经的作用,能够促进外周神经元存活并抑制损伤后神经元的死亡[3],可以通过上调P53,下调核因子-κB、血管内皮生长因子、CD-34表达水平抑制人肾细胞癌A498细胞的增殖及转移[4],同时也具有免疫调节功能,是巨噬细胞、B细胞、T细胞的特异性趋化因子和激活因子[5-6],并且能抑制肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)、IL-12、巨噬细胞炎症蛋白1(macrophage inflammatory protein 1,MIP-1)、MIP-2在内的多种促炎因子及趋化因子的产生[4],促进抗炎细胞因子IL-10、IL-1R 等 拮 抗 剂 的 产 生,其 中TNF-α、IL-12、MIP-1、MIP-2、IL-10主要通过血管活性肠肽受体1(vasoactive intestinal peptide receptor 1,VIPR1)调节[7]。VIPR1是VIP最主要的作用受体,主要存在于人脑的一些区域,也在大鼠和人类肺巨噬细胞、肺静脉血管平滑肌和从支气管至呼吸性细支气管的气道上皮中表达[8]。VIPR1在不同肿瘤组织中呈不同表达,在乳腺癌组织中的表达量高于正常乳腺组织的5倍[9],在胰腺癌[10]、肝癌[11]、甲状腺癌[12]、非小细胞肺癌[13]肿瘤组织中的表达量则低于正常组织。在乳腺癌中VIP作用于VIPR1能引起癌细胞增殖[14],而肝细胞癌中,高表达VIPR1患者的预后相对较好[11]。越来越多研究证明VIPR1在人类癌症的鉴别及治疗中起重要作用,如在前列腺癌中拮抗VIP与VIPR1的结合能抑制肿瘤细胞生长[11],在乳腺癌中作为分子靶点进行肿瘤组织功能成像及靶向化疗[15]。在肺腺癌中上调VIPR1基因的表达能抑制H1299细胞的生长[16-17]。近年来,免疫治疗日益成为肺癌治疗的热点,其效果也与肿瘤微环境中的免疫细胞浸润有关。目前尚无VIPR1基因在肺腺癌免疫浸润中的作用的相关研究,所以本研究拟通过多种生物信息学方法对VIPR1基因在肺腺癌中的作用进行研究,并挖掘其对免疫细胞浸润模式的影响,为临床提供新的免疫相关基因的预后标志物。
1 资料与方法
1.1 数据资料收集及整理分析从肿瘤基因组图谱(The Cancer Genome Atlas,TCGA)数据库下载肺腺癌患者转录组数据和临床病理数据(535例为肿瘤样本,59例为正常对照样本),分析肿瘤组织和正常组织基因表达的差异,通过单因素Cox回归分析探讨VIPR1表达水平与肺腺癌患者总生存时间的关系。选取T分期、M分期、N分期、年龄、性别、临床分期作为肺腺癌临床病理特征。用箱线图显示正常组和肿瘤组基因表达的差异。
1.2 基因富集分析采用GSEA 4.0.1软件分析探索与VIPR1相关的重要信号通路。根据VIPR1表达水平分为高表达组及低表达组。通过基因集富集分析(gene set enrichment analysis,GSEA)网 站 获 取c2.cp.kegg.v7.4.symbols.gmt数据集。采用缺省加权富集统计方法进行富集分析并设置随机组合次数为1 000次。
1.3 免疫浸润评估采用CIBERSORT(http://cibersort.stanford.edu/)估算肺腺癌组织及正常肺组织中22种免疫细胞的组成。通过反卷积算法,采用CIBERSORT软件基于标准化的基因表达数据计算复杂细胞中的免疫细胞组成,并给出计算结果的可信度,将P<0.05作为计算所得结果可靠。
1.4 VIPR1与免疫浸润细胞关系分析通过TIMER 2.0数据库(http://timer.cistrome.org/)的Immune板块分析VIPR1表达水平与CD4+T细胞、B细胞、中性粒细胞、髓系抑制性细胞等免疫细胞浸润的关系,在所有计算结果中选择肿瘤类别为肺腺癌,保存并下载所需结果至本地计算机。
1.5 统计学方法采用R 4.1.0软件进行数据分析。采用Wilcoxon秩和检验比较肺腺癌组织和正常肺组织中VIPR1的表达,采用单因素方差分析比较不同TNM分期肺腺癌组织中VIPR1的表达水平,采用Spearman相关性检验分析两组间的相关性,通过Kaplan-Meier曲线分析VIPR1与总生存期的关系,并采用log-rank法进行检验。检验水准α=0.05。
2 结果
2.1 VIPR1基因在肺腺癌组织和正常组织中的表达通过TCGA公共数据库分析VIPR1在肺腺癌组织及正常肺组织中的差异,结果显示VIPR1在正常肺组织中的表达水平较肺腺癌组织高,差异有统计学意义(P<0.05)。见图1。

图1 VIPR1基因在肺腺癌组织和正常组织中的表达
2.2 VIPR1基因高表达组和低表达组的预后VIPR1高表达组患者的预后较低表达组好(P<0.05)。见图2。
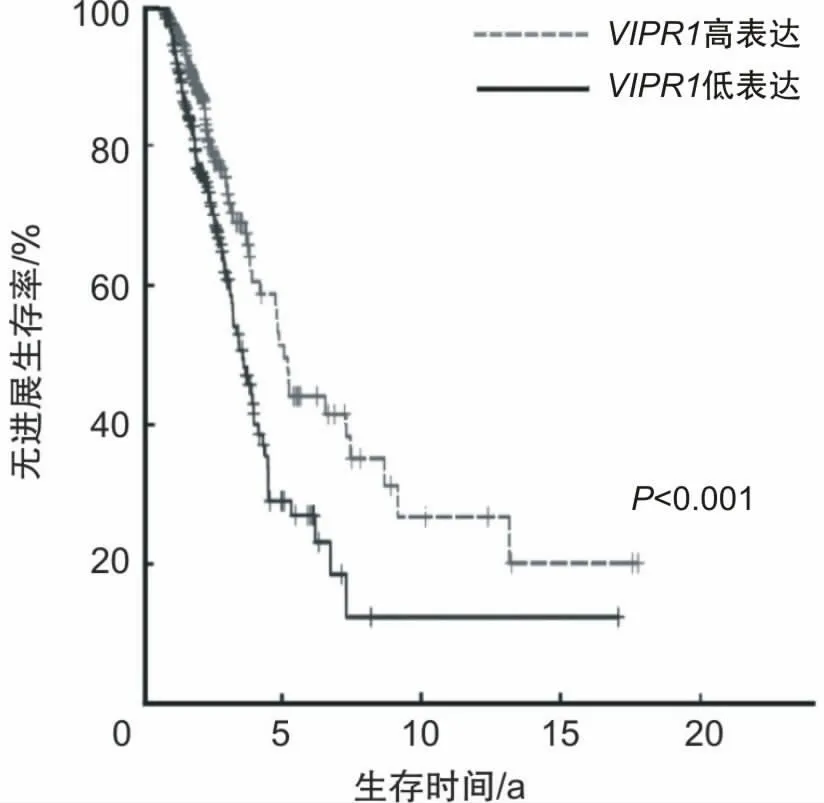
图2 VIPR1高低表达组的预后分析
2.3 VIPR1基因表达水平与肺腺癌患者的临床病理特征关系根据VIPR1在肺腺癌组织中表达的中位值,将患者分为高表达组(267例)和低表达组(268例),其中,部分患者的性别(22例)、年龄(41例)、T分期(25例)、N分期(34例)、M 分期(166例)、临床分期(30例)、生存状态(23例)信息不完整,未对该部分患者相关信息分析。进一步分析肺腺癌中VIPR1表达与临床病理特征的关系,结果显示VIPR1的表达与患者的生存状态(P<0.001)、N 分 期(P=0.010)、临 床 分 期(P=0.011)有关,与性别、年龄、T分期、M 分期无关(P>0.05)。见表1。
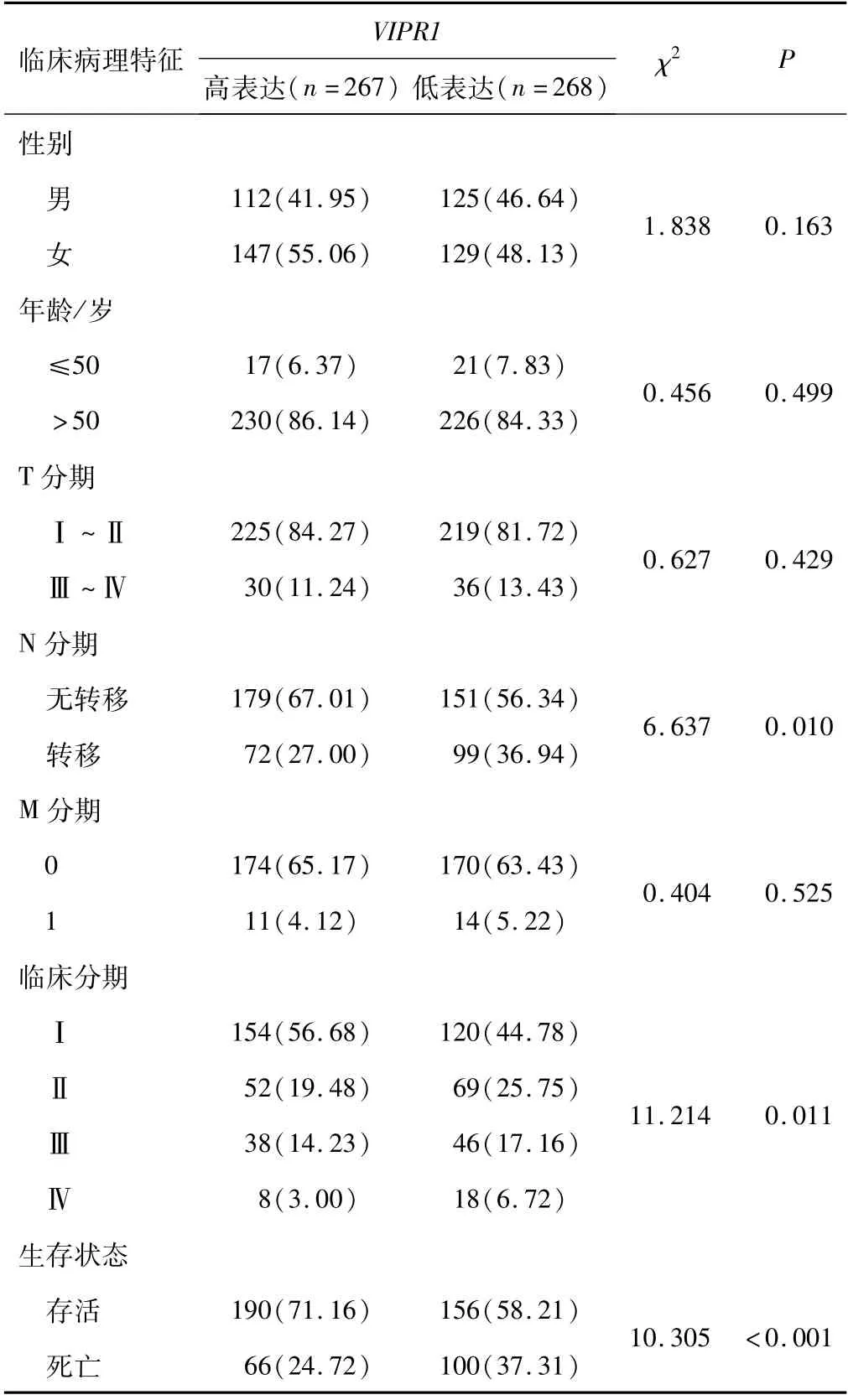
表1 不同临床特征肺腺癌患者VIPR1的表达[n(%)]
2.4 VIPR1低表达组的功能富集分析通过VIPR1表达的中位数将肺腺癌患者分为高、低表达组,GSEA富集分析结果表明,VIPR1低表达样本富集在一些信号通路中,如细胞周期通路、P53信号通路、DNA复制通路、RNA降解通路等。见表2。
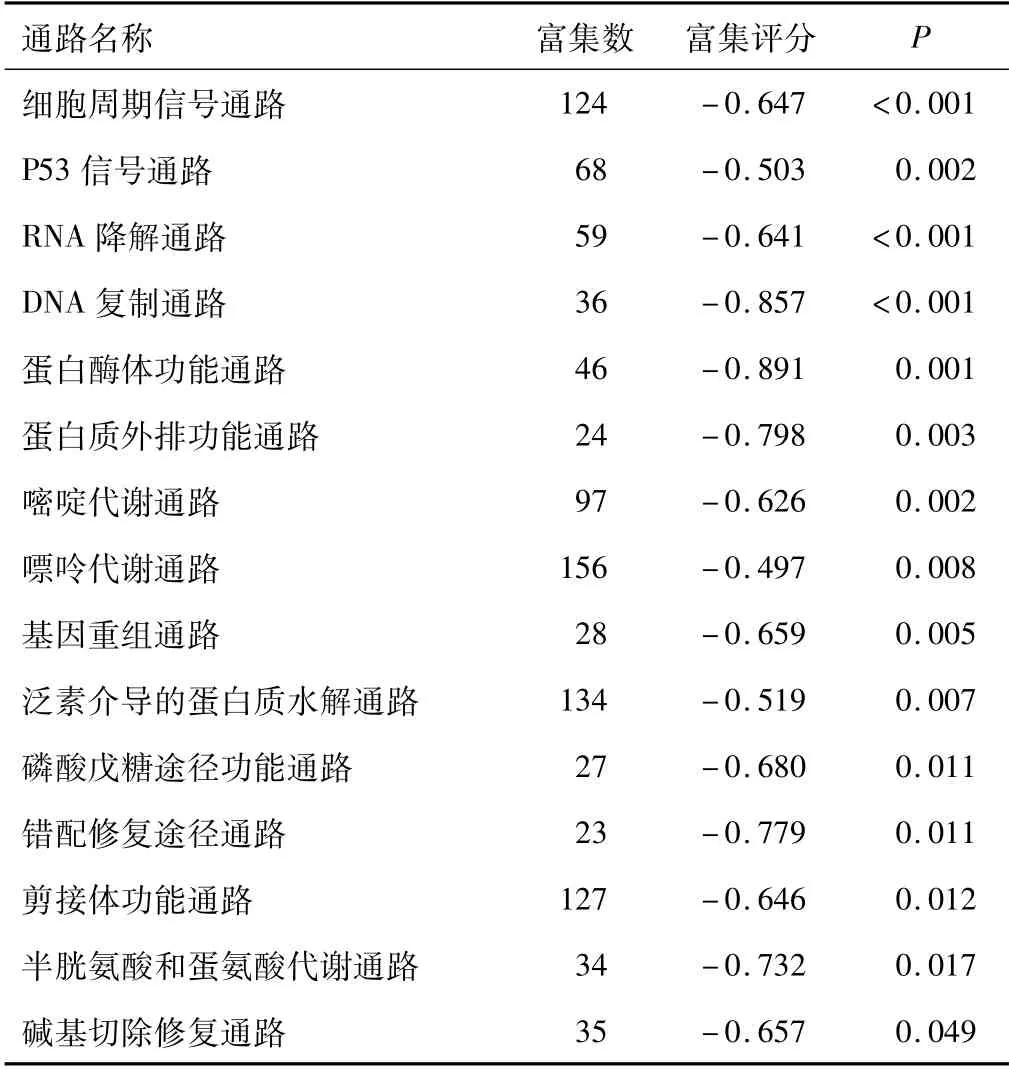
表2 VIPR1低表达组基因功能富集分析
2.5 肺腺癌和正常组织中免疫细胞浸润情况肺癌组织与正常组织中免疫细胞的浸润构成存在差异。肺腺癌组织中幼稚B细胞、浆细胞、激活的CD4+T细胞、滤泡辅助T细胞、调节性T细胞、γδT细胞、M1型巨噬细胞、静息的树突状细胞浸润水平较正常肺组织高(P<0.05),而正常肺组织静息的CD4+T细胞、静息的NK细胞、单核细胞、M0型巨噬细胞、M2型巨噬细胞、激活的树突状细胞、静息的肥大细胞、嗜酸性粒细胞、中性粒细胞的浸润水平高于肺腺癌组织(P<0.05);在两种组织中均未发现幼稚的CD4+T细胞;记忆B细胞、CD8+T细胞、激活的NK细胞、激活的肥大细胞在肺腺癌组织和正常组织中的浸润水平比较,差异无统计学意义(P>0.05)。见图3。

图3 正常肺组织与肺腺癌组织中免疫细胞组成的差异
2.6 VIPR1基因表达水平与免疫浸润细胞表达相关性通过TIMER 2.0分析发现,VIPR1基因的表达水平与髓系抑制性细胞的浸润水平(相对水平)呈负相关(r=-0.488,P<0.001)。见图4。
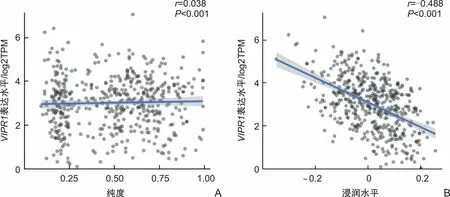
图4 VIPR1表达水平与免疫浸润水平的相关性
3 讨论
在中国,肺癌给国家带来了极大的经济负担,肺癌的预防、诊断、治疗仍是当今的一大难题。目前肺腺癌尚无有效的分子标志物及治疗靶点,探讨肺腺癌的生物学发病机制及分子治疗靶点有重要意义。本研究通过TCGA数据库分析发现,肺腺癌组织的VIPR1表达水平低于正常肺组织。肺腺癌中VIPR1高表达组的生存率优于低表达组,这提示VIPR1可能是肺腺癌的一个重要的抑癌基因,这与Zhao等[16]发现的在H1299细胞中过表达VIPR1能够抑制该细胞增殖、生长及侵袭的结果相符。进一步分析VIPR1与肺腺癌临床特征的关系,结果显示,VIPR1的表达与患者的生存状态、N分期、临床分期相关,在肺腺癌患者中VIPR1的低表达可能引起肿瘤组织淋巴结转移,这往往提示预后不良。
采用GSEA软件分析预测与肺腺癌组织中VIPR1表达相关的信号通路,结果显示低表达VIPR1组富集在细胞周期信号通路、P53信号通路、RNA降解通路、DNA复制通路、碱基切除修复等信号通路。这些通路主要影响遗传物质的表达,基因突变往往是癌症发生的重要原因。
VIPR1是VIP的主要受体,VIP可以抑制TNF-α、IL-6、血管内皮生长因子的产生[4]。有研究表明,前列腺素E2、TNF-α、IL-6、IL-1、血管内皮生长因子联合粒细胞-巨噬细胞集落刺激因子可以诱导健康受试者外周血分离的CD33+单核细胞分化成髓系抑制性细胞[18]。髓系抑制性细胞是由未成熟的髓系祖细胞发展而来,主要分为两大类:单核髓系抑制性细胞和多形核髓系抑制性细胞[19]。抑制性免疫浸润微环境是造成肿瘤细胞免疫逃逸、免疫治疗效果不佳的主要原因之一,髓系抑制性细胞是构成抑制性免疫浸润微环境的主要细胞之一,可以抑制T细胞、B细胞、巨噬细胞、树突状细胞的作用,并且能直接作用于上皮细胞促进其生长及突变[20]。多形核髓系抑制性细胞可以产生活性氧,直接破坏T细胞抗原受体与主要组织相容性复合体结合,单核髓系抑制性细胞则可以消耗T细胞重要的营养物质,如L-精氨酸,从而抑制T细胞的功能。肿瘤组织高浸润的髓系抑制性细胞能够促进肿瘤细胞血管、淋巴结转移,其往往标志着预后不良。Li等[21]关于三阴乳腺癌小鼠模型的研究显示,多西环素可以减少多形核髓系抑制性细胞的浸润从而增强程序性死亡受体1抑制剂的抗瘤活性进而抑制肿瘤的生长。有研究显示,髓系抑制性细胞可以抑制T细胞、B细胞的功能活性,并使急性炎症转变为慢性炎症,发展为癌前状态,最终发展为癌症,抑制髓系抑制性细胞的募集,进而抑制肺癌的进展[22-23]。有研究显示,激活STAT3信号通路可以增加髓系抑制性细胞的浸润,促进乳腺癌的进展转移[24]。Xu等[25]研究表明,通过P53信号通路可诱导髓系抑制性细胞的凋亡,进而抑制小鼠肺癌组织的生长。本研究通过TIMER分析发现VIPR1低表达能促进髓系抑制性细胞在肿瘤组织的浸润,两者呈负相关,所以推测VIPR1对预后的影响可能是通过改变肿瘤组织髓系抑制性细胞的浸润引起的。
综上所述,本研究通过分析VIPR1表达水平与肺腺癌患者临床特征的关系、对免疫微环境的影响及预后发现,VIPR1可能作为肺腺癌临床预后评估的指标及靶向治疗的新靶点。本研究基于TCGA数据库大样本患者的临床资料、转录组资料进行分析,结果可信性较高。

