lncRNA FGD5-AS1靶向miR-15a-5p调控LPS诱导的脓毒症细胞损伤①
王春枝 武百强 吴 威 赵艳庚 张 娜 唐海霞 杨冬松
(漯河医学高等专科学校第二附属医院重症医学科,漯河 462300)
脓毒症是指由各种病原微生物感染引起的全身炎症反应综合征,其特点是机体不受控制的感染反应导致危及生命的器官功能障碍[1-2]。尽管脓毒症的病理机制尚不清楚,但炎症级联进展和各种促炎递质释放已被证明参与脓毒症发生和发展[3-4]。长链非编码RNA(long non-coding RNA,lncRNA)是指长度超过200个核苷酸且不具备蛋白编码能力的RNA 分子,在多种生物学过程中发挥调节作用。lncRNA FGD5-AS1 是一种新型lncRNA,研究发现,在IL-1β 诱导的关节软骨细胞损伤中,lncRNA FGD5-AS1 负调控miR-103a-3p 抑制细胞凋亡和炎症反应[5]。lncRNA FGD5-AS1 通过 miR-223/IGF1R轴减轻氧糖剥夺/再灌注(OGD/R)诱导的大鼠神经元损伤[6]。过表达lncRNA FGD5-AS1显著缓解脂多糖(lipopolysaccharide,LPS)诱导的人牙周膜细胞(periodontal ligament cells,PDLCs)损伤[7]。但lncRNA FGD5-AS1 在脓毒症诱导的细胞损伤中的作用尚不清楚。本实验通过StarBase 预测发现lncRNA FGD5-AS1 与miR-15a-5p 具有结合位点。有研究报道miR-15a 能够通过靶向BDNF 调节OGD/R 诱导的大鼠 神经 损伤[8]。抑 制 miR-15a-5p 靶向 负 调 控TNIP2 表达能够减轻LPS 诱导的小鼠巨噬细胞炎症反应[9]。尽管已有研究确定 miR-15a-5p 在 LPS 诱导的脓毒症炎症反应中的作用,但lncRNA FGD5-AS1在脓毒症炎症中的作用及其机制是否与miR-15a-5p有关尚未可知。因此,本实验旨在研究lncRNA FGD5-AS1 是否通过靶向调控miR-15a-5p 表达影响脓毒症炎症反应。
1 材料与方法
1.1 材料 THP-1细胞系(人髓系白血病单核细胞系)购自中国科学院细胞库(中国上海);细胞在5%CO2和37 ℃环境中孵育,培养基采用含10%FBS的 DMEM 完全培养基[10];LPS 购自美国 Sigma 公司;Trizol 试剂、反转录试剂盒、荧光定量试剂盒购自日本TaKaRa公司;Annexin V-FITC/PI凋亡检测试剂盒购自北京凯瑞基生物科技有限公司;RIPA蛋白裂解液、BCA 试剂盒购自上海研谨生物科技有限公司;ELISA 试剂盒购自北京天根生物技术公司;双荧光素酶报告基因检测试剂盒购自北京百奥莱博科技有限公司;Lipofectamine2000 购自美国 Invitrogen 公司;RT-qPCR 转染引物由上海生工生物工程公司合成;FGD5-AS1 野生型和突变型荧光素酶表达载体WT-FGD5-AS1、MUT-FGD5-AS1 由上海基因制药有限公司设计。
1.2 方法
1.2.1 LPS 处理与分组 将对数生长期的THP-1细胞调整浓度至 5.0×106个/ml,500 ng/ml LPS 刺激4 h,建立脓毒症模型,记为LPS组[11]。THP-1生长至70%~80%融合时,按照Lipofectamine2000 说明书,将 pcDNA、pcDNA-FGD5-AS1、si-NC、si-FGD5-AS1、anti-miR-NC、anti-miR-15a-5p分别转染至LPS组,记为pcDNA 组、pcDNA-FGD5-AS1 组、si-NC 组、si-FGD5-AS1 组、anti-miR-NC 组、anti-miR-15a-5p 组;pcDNAFGD5-AS1 分 别 与 miR-NC、miR-15a-5p 共 转 染 至LPS 组,记为 pcDNA-FGD5-AS1+miR-NC 组、pcDNAFGD5-AS1+miR-15a-5p组,48 h后用于后续实验。
1.2.2 RT-qPCR 提取细胞总RNA,反转录为cDNA,lncRNA FGD5-AS1 和 miR-15a-5p 分 别 以GAPDH和U6为内参,相对表达量采用2-ΔΔCt法计算,检测各组lncRNA FGD5-AS1 和miR-15a-5p 水平以验证转染效果。lncRNA FGD5-AS1 正向引物序列:5'-AACAGTGCCTATGTGGACGG-3',反向引物序列:5'-CCCATCACAGAGGTCCACAC-3';miR-15a-5p 正向引物序列:5'-GGGTAGCAGCACATAATGGTT-3',反向引物序列:5'-CAGTGCGTGTCGTGGAGT-3';GAPDH 正向引物序列:5'-ACACCCACTCCTCCACCTTT-3',反向引物序列:5'-TTACTCCTTGGAGGCCATGT-3';U6 正向引物序列:5'-GCTTCGGCAGCACATATACTAAAAT-3',反向引物序列:5'-CGCTTCACGAATTTGCGTGTCAT-3'。
1.2.3 Annexin V 检测细胞凋亡 按照ANXA5/Annexin凋亡检测试剂盒说明检测THP-1细胞凋亡,收集细胞并用PBS 漂洗,195µl结合缓冲液重悬后,加入 5 µl ANXA5-FITC 原液、10 µl 碘化丙啶 37 ℃孵育15 min,流式细胞仪检测细胞凋亡。
1.2.4 Western blot 法检测蛋白表达 提取各组细胞总蛋白,BCA 试剂盒进行蛋白定量。各组蛋白上样量 60 µg,SDS-PAGE 后转移至 PVDF 膜,5% 脱脂牛奶室温封闭,加入一抗4 ℃孵育过夜,PBS 洗涤3 次,加入二抗室温孵育 2 h,PBS 洗涤 3 次,暗室中曝光显影,定影,采用Quantity One 软件检测各组蛋白条带灰度值,以目的条带和GAPDH 条带比值作为蛋白表达水平。
1.2.5 ELISA检测炎症细胞因子水平 按照ELISA试剂盒说明检测THP-1 细胞培养上清中IL-6、IL-1β和TNF-α 表达水平。酶标仪检测450 nm 处吸光度,计算IL-6、IL-1β和TNF-α浓度。
1.2.6 双荧光素酶报告实验检测lncRNA FGD5-AS1 和 miR-15a-5p 的靶向关系 FGD5-AS1 野 生 型和突变型荧光素酶表达载体WT-FGD5-AS1和MUTFGD5-AS1 分 别 与 miR-NC 和 miR-15a-5p 共 转 染 至LPS 诱导的 THP-1 细胞中,48 h 后收集细胞,按照双荧光素酶报告基因检测试剂盒说明书检测荧光素酶活性。
1.3 统计学处理 采用SPSS21.0统计学软件分析数据,计量资料以表示且均符合正态分布,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 lncRNA FGD5-AS1 和 miR-15a-5p 在 LPS 诱 导的THP-1 细胞中的表达 与对照组比较,LPS 诱导的THP-1 细胞中FGD5-AS1 表达降低,miR-15a-5p表达升高(P<0.05),见表1。
表1 lncRNA FGD5-AS1 和 miR-15a-5p 在 LPS 诱 导 的THP-1细胞中的表达(,n=30)Tab.1 Expressions of lncRNA FGD5-AS1 and miR-15a-5p in LPS induced THP-1 cells(,n=30)
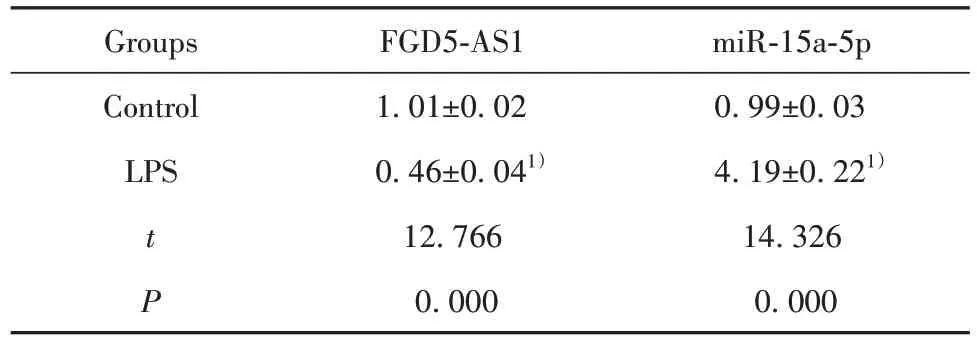
表1 lncRNA FGD5-AS1 和 miR-15a-5p 在 LPS 诱 导 的THP-1细胞中的表达(,n=30)Tab.1 Expressions of lncRNA FGD5-AS1 and miR-15a-5p in LPS induced THP-1 cells(,n=30)
Note:Compared with Control group,1)P<0.05.
miR-15a-5p 0.99±0.03 4.19±0.221)14.326 0.000 Groups Control LPS t P FGD5-AS1 1.01±0.02 0.46±0.041)12.766 0.000
2.2 过表达lncRNA FGD5-AS1 对LPS 诱导THP-1细胞损伤的影响 如图1、表2所示,与对照组比较,LPS 组FGD5-AS1 表达降低,细胞凋亡率升高,Bcl-2表达降低,Bax表达升高,炎症细胞因子IL-6、IL-1β、TNF-α水平升高(P<0.05);与pcDNA组比较,pcDNAFGD5-AS1 组FGD5-AS1 表达升高,细胞凋亡率降低,Bcl-2表达升高,Bax表达降低,炎症细胞因子IL-6、IL-1β、TNF-α水平降低(P<0.05),见图1、表2。
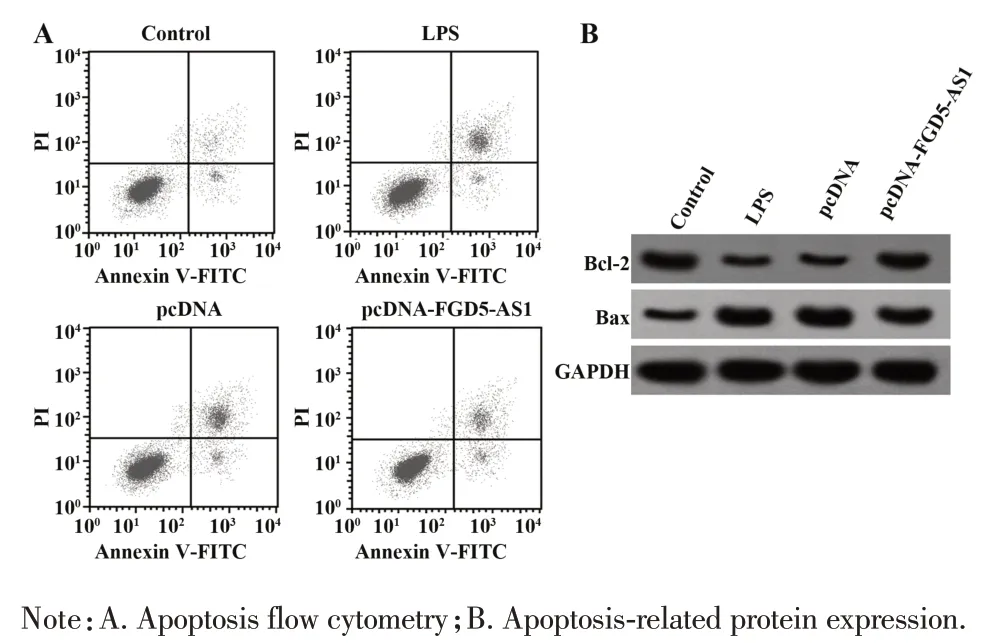
图1 过表达 lncRNA FGD5-AS1 对 LPS 诱导 THP-1 细胞损伤的影响Fig.1 Effects of lncRNA FGD5-AS1 overexpression on LPS induced THP-1 cell injury
表2 过表达lncRNA FGD5-AS1对LPS诱导的THP-1细胞损伤的影响(,n=9)Tab.2 Effects of lncRNA FGD5-AS1 overexpression on LPS induced THP-1 cells(,n=9)
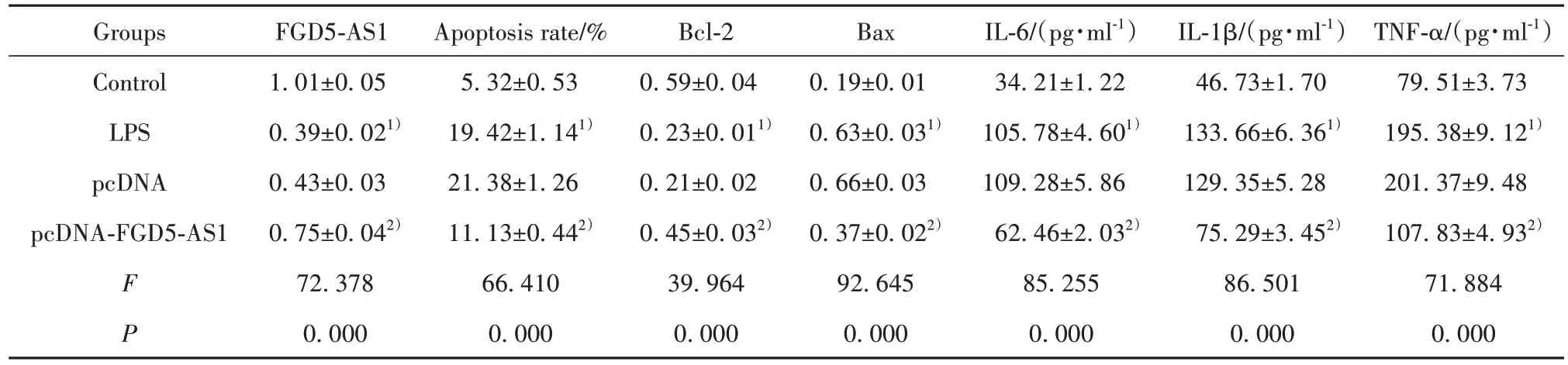
表2 过表达lncRNA FGD5-AS1对LPS诱导的THP-1细胞损伤的影响(,n=9)Tab.2 Effects of lncRNA FGD5-AS1 overexpression on LPS induced THP-1 cells(,n=9)
Note:Compared with Control group,1)P<0.05;compared with pcDNA group,2)P<0.05.
?
2.3 lncRNA FGD5-AS1 靶 向 调 控 miR-15a-5p 表达 StarBase 预测显示lncRNA FGD5-AS1 的序列中含有与miR-15a-5p 互补的核苷酸序列,见图2。双荧光素酶报告实验结果显示,与转染miR-NC 的WT-FGD5-AS1比较,转染miR-15a-5p的荧光素酶活性降低(P<0.05),而转染 miR-NC 和miR-15a-5p 的MUT-FGD5-AS1 中,荧光素酶活性差异无统计学意义(P<0.05),见表 3。与 pcDNA 组比较,pcDNAFGD5-AS1 组的 miR-15a-5p 表达降低(P<0.05);与si-NC 组比较,si-FGD5-AS1 组 miR-15a-5p 表达升高(P<0.05),见表4。
表4 lncRNA FGD5-AS1调控miR-15a-5p表达(,n=9)Tab.4 lncRNA FGD5-AS1 regulates miR-15a-5p expression(,n=9)
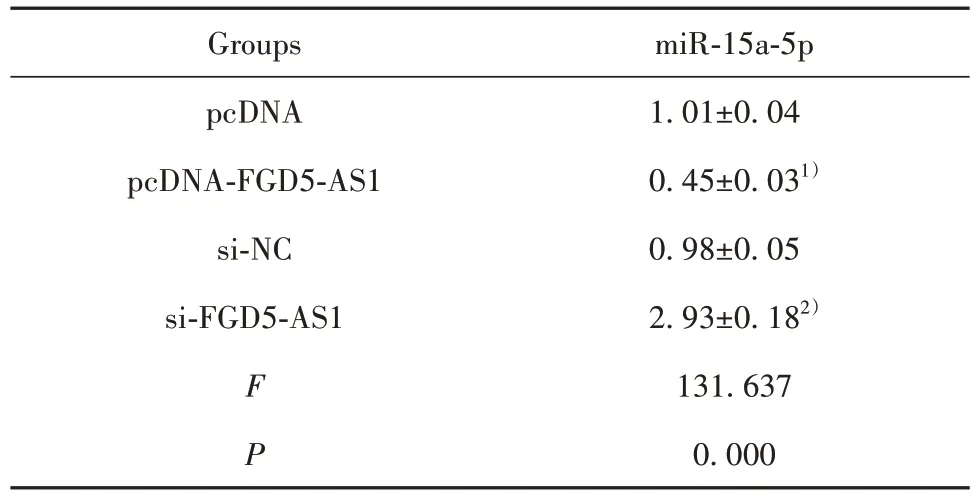
表4 lncRNA FGD5-AS1调控miR-15a-5p表达(,n=9)Tab.4 lncRNA FGD5-AS1 regulates miR-15a-5p expression(,n=9)
Note:Compared with pcDNA group,1)P<0.05;compared with si-NC group,2)P<0.05.
miR-15a-5p 1.01±0.04 0.45±0.031)0.98±0.05 2.93±0.182)131.637 0.000 Groups pcDNA pcDNA-FGD5-AS1 si-NC si-FGD5-AS1 F P

图2 lncRNA FGD5-AS1靶向调控miR-15a-5p表达Fig.2 lncRNA FGD5-AS1 tageting regulates expression of miR-15a-5p
表3 双荧光素酶报告实验(,n=9)Tab.3 Dual luciferase report experiment(,n=9)

表3 双荧光素酶报告实验(,n=9)Tab.3 Dual luciferase report experiment(,n=9)
Note:Compared with miR-NC group,1)P<0.05.
MUT-FGD5-AS1 0.98±0.04 1.02±0.05 0.765 0.487 Groups miR-NC miR-15a-5p t P WT-FGD5-AS1 1.01±0.04 0.38±0.021)14.246 0.000
2.4 下调 miR-15a-5p 对 LPS 诱导的 THP-1 细胞损伤的影响 与anti-miR-NC 组比较,anti-miR-15a-5p组miR-15a-5p表达降低,细胞凋亡率降低,Bcl-2表达升高,Bax表达降低,炎症细胞因子IL-6、IL-1β、TNF-α水平降低(P<0.05),见表5、图3。
表5 下调miR-15a-5p对LPS诱导THP-1细胞损伤的影响(,n=9)Tab.5 Effects of down-regulating miR-15a-5p on LPS induced THP-1 cell injury(,n=9)

表5 下调miR-15a-5p对LPS诱导THP-1细胞损伤的影响(,n=9)Tab.5 Effects of down-regulating miR-15a-5p on LPS induced THP-1 cell injury(,n=9)
Note:Compared with anti-miR-NC group,1)P<0.05.
TNF-α/(pg·ml-1)204.85±6.57 117.53±3.051)12.053 0.000 Groups anti-miR-NC anti-miR-15a-5p F P miR-15a-5p 1.02±0.04 0.37±0.021)15.502 0.000 Apoptosis rate/%22.21±1.04 10.49±0.291)10.841 0.000 Bcl-2 0.20±0.01 0.49±0.021)14.113 0.000 Bax 0.67±0.03 0.32±0.011)10.947 0.000 IL-6/(pg·ml-1)111.13±4.99 53.47±2.081)10.668 0.000 IL-1β/(pg·ml-1)128.27±4.73 69.15±2.341)11.205 0.000

图3 下调miR-15a-5p表达对LPS诱导的THP-1细胞损伤的影响Fig.3 Effects of down-regulating miR-15a-5p on LPS induced THP-1 cell injury
2.5 上调miR-15a-5p 可逆转过表达lncRNA FGD5-AS1对LPS诱导的THP-1细胞损伤的影响 与pcDNA-FGD5-AS1+miR-NC组比较,pcDNA-FGD5-AS1+miR-15a-5p 组miR-15a-5p 表达升高,细胞凋亡率升高,Bcl-2 表达降低,Bax 表达升高,炎症细胞因子IL-6、IL-1β、TNF-α水平升高(P<0.05),见图4、表6。
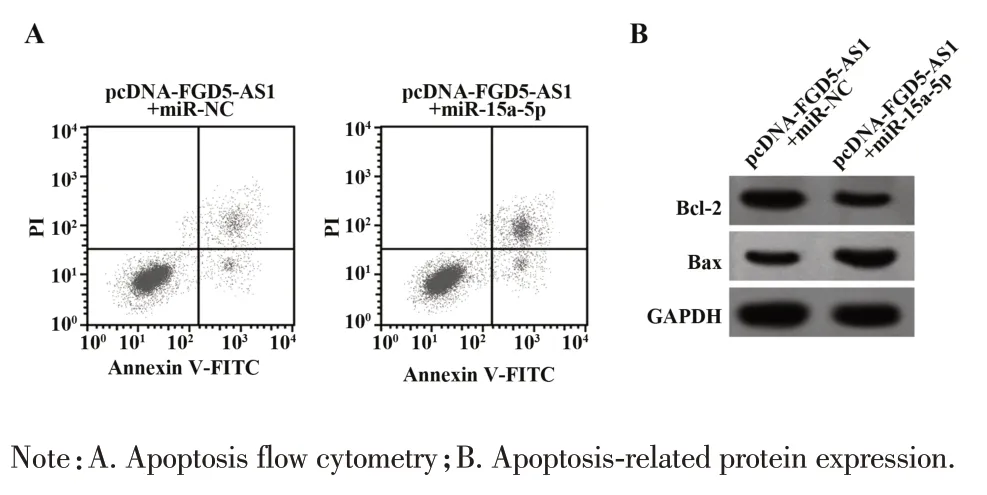
图4 上调miR-15a-5p 表达能逆转过表达lncRNA FGD5-AS1对LPS的诱导THP-1细胞损伤的影响Fig.4 Up-regulating miR-15a-5p can reverse effect of lncRNA FGD5-AS1 overexpression on LPS induced THP-1 cell injury
表6 上调miR-15a-5p表达能逆转过表达lncRNA FGD5-AS1对LPS诱导的THP-1细胞损伤的影响(,n=9)Tab.6 Up-regulating miR-15a-5p can reverse effects of lncRNA FGD5-AS1 overexpression on LPS induced THP-1 cell injury(,n=9)

表6 上调miR-15a-5p表达能逆转过表达lncRNA FGD5-AS1对LPS诱导的THP-1细胞损伤的影响(,n=9)Tab.6 Up-regulating miR-15a-5p can reverse effects of lncRNA FGD5-AS1 overexpression on LPS induced THP-1 cell injury(,n=9)
Note:Compared with pcDNA-FGD5-AS1+miR-NC group,1)P<0.05.
Groups miR-15a-5p Bcl-2Bax IL-6/(pg·ml-1)IL-1β/(pg·ml-1)TNF-α/(pg·ml-1)105.11±2.35 172.53±5.171)11.687 0.000 pcDNA-FGD5-AS1+miR-NC pcDNA-FGD5-AS1+miR-15a-5p F P 0.98±0.03 1.83±0.061)13.564 0.000 Apoptosis rate/%9.22±0.22 16.87±0.841)8.796 0.001 0.51±0.02 0.32±0.011)7.884 0.001 0.28±0.01 0.43±0.021)7.028 0.002 56.29±1.11 91.31±2.691)12.030 0.000 68.77±1.29 109.86±3.111)12.188 0.000
3 讨论
脓毒症是严重感染后由多种先天免疫细胞(包括中性粒细胞、单核细胞和巨噬细胞)介导的全身炎症反应[12]。研究发现,免疫应答和炎症反应在脓毒症发病机制中起关键作用,人体免疫细胞被病原微生物和毒素激活,产生多种炎症细胞因子,导致严重的细胞损伤、微循环障碍和器官功能障碍[13-15]。已有研究发现,lncRNA 异常表达参与多种炎症相关疾病[16-17]。 lncRNA MALAT1 通过 miR-214/TLR5 治疗烧伤患者的脓毒症[18];lncRNA CRNDE 通过 miR-181a-5p/TLR4 轴参与加重脓毒症炎症过程[19];沉默lncRNA XIST 通过抑制BRD4 表达预防脓毒症诱导的 急 性 肝 损 伤[20];lncRNA H19 可 通 过 miR-874/AQP1 显著逆转LPS 诱导的炎症反应和心肌功能障碍[21]。多项研究表明,miRNAs 通过影响重要的信号元件参与脓毒症诱导的炎症反应。上调miR-130b表达抑制LPS诱导的脓毒症模型小鼠的严重肺部炎症;过表达miR-129-5p可通过靶向HMGB1减轻脓毒症诱导的急性肺损伤;miR-21-3p在LPS诱导的心功能障碍中显著升高,miR-21-3p 通过SORBS2 调控脓毒症相关的心脏功能异常;miR-22-3p 通过靶向PTEN抑制脓毒症诱导的急性肾损伤[22-25]。
本研究显示,经LPS 诱导的THP-1 细胞中,lncRNA FGD5-AS1 表达下调,过表达lncRNA FGD5-AS1 抑制细胞凋亡以及炎症细胞因子IL-6、IL-1β、TNF-α 表达,提示过表达 lncRNA FGD5-AS1 可减轻LPS诱导的细胞损伤。研究表明,lncRNA FGD5-AS1可作为竞争性内源RNA 负调控miRNA 表达缓解细胞 损 伤[5-7]。 本 研 究 StarBase 预 测 显 示 lncRNA FGD5-AS1 序列中含有与miR-15a-5p 互补的核苷酸序列,双荧光素酶报告实验结果证实lncRNA FGD5-AS1靶向调控miR-15a-5p表达。下调miR-15a-5p表达亦可抑制细胞凋亡以及炎症细胞因子IL-6、IL-1β、TNF-α表达,提示下调miR-15a-5p表达可缓解LPS 诱导的细胞损伤。而上调miR-15a-5p表达可逆转过表达lncRNA FGD5-AS1对LPS诱导的THP-1细胞凋亡以及炎症细胞因子IL-6、IL-1β、TNF-α的影响。
综上所述,过表达lncRNA FGD5-AS1 可通过靶向下调miR-15a-5p表达减轻LPS诱导的THP-1细胞损伤。

