靶向IL-6慢病毒介导RNA干扰实验性基因治疗类风湿关节炎①
孙琳茜 王子叶 王丽芹 李 清 常晓天 王吉波 (青岛大学附属医院风湿免疫科,青岛 266000)
类风湿关节炎(rheumatoid arthritis,RA)是一种以滑膜关节受累为主要临床表现的慢性炎症性系统疾病,发病及发展过程中有多种细胞因子及炎症介质参与,其中IL-6、TNF-α、IL-1β 等是最重要的致炎因子[1]。RA 有较高致残率并严重影响患者的生活质量,研究者一直在探索其治疗方法。目前治疗RA 的药物及方法虽然较多,但仍不能解决全部问题[2-3]。近十年试验性基因治疗业已悄然兴起,靶向致炎症细胞因子的RNA 干扰(RNA interference,RNAi)成为一种新兴疗法。因为慢病毒具有基因转导效率高、能够通过基因整合而实现基因稳定表达等特点,常用作RNAi 的载体。本研究团队前期已完成慢病毒介导靶向TNF-α 基因RNA 干扰的体外及体内研究,取得了令人振奋的效果[4-5]。本研究再次以慢病毒为载体,以小鼠IL-6 为靶基因,构建RNAi 慢病毒载体颗粒,采用小鼠巨噬细胞株J774A.1细胞与胶原诱导性小鼠关节炎模型(collageninduced arthritis,CIA)分别进行体外、体内试验,以观察其作用效果。
1 材料与方法
1.1 材料 小鼠单核巨噬细胞J774A.1(中国科学院上海生命科学研究院细胞资源中心);DBA/1小鼠(斯莱克实验动物有限公司,上海);DMEM 高糖培养基(HyClone,美国);胎牛血清(fatal bovine serum,FBS,Gibco,美国);IL-6 siRNA及siRNA scramble阴性对照(吉玛基因,上海);lipofectamine3000(Invitrogen,美国);Trizol、反转录试剂盒、qPCR试剂盒(TaKaRa,大连);引物(生工生物,上海);GV248 质粒(吉凯基因,上海);牛Ⅱ型胶原、弗氏完全佐剂(Chondrex,美国);MTX(辉瑞制药,美国);小鼠来源IL-6、IL-1β、TNF-α ELISA 试剂盒(R&D Systems,美国);4%多聚甲醛、10%EDTA 溶液(索莱宝,北京)。
1.2 方法
1.2.1 靶向IL-6的RNAi慢病毒颗粒构建
1.2.1.1 细胞培养 用含10%FBS 的DMEM 高糖培养液培养小鼠巨噬细胞J774A. 1,细胞密度达80%~90%时传代,传代比例1∶3。取生长状态良好、对数生长期细胞进行后续实验。
1.2.1.2 设计、合成、筛选高效siRNA 序列 从Genbank 数据库中获取小鼠IL-6 基因mRNA 序列(NM_031168),根据小干扰 RNA(small interference RNA,siRNA)设计原则,合成3对特异性针对IL-6基因的 siRNA 序列(siRNA-1,siRNA-2 和 siRNA-3)及siRNA scramble阴性对照序列(negative control-RNAi,NC-RNAi,表1)。实验分为siRNA-1组、siRNA-2组、siRNA-3 组,并设NC-RNAi 组、培养基空白对照组。将对数生长期细胞以8×104个/孔接种于24 孔细胞培养板,24 h 后细胞融合达50% 时,利用lipofectamine3000转染J774A.1细胞。48 h后收集细胞,RT-qPCR检测siRNA干扰效率。
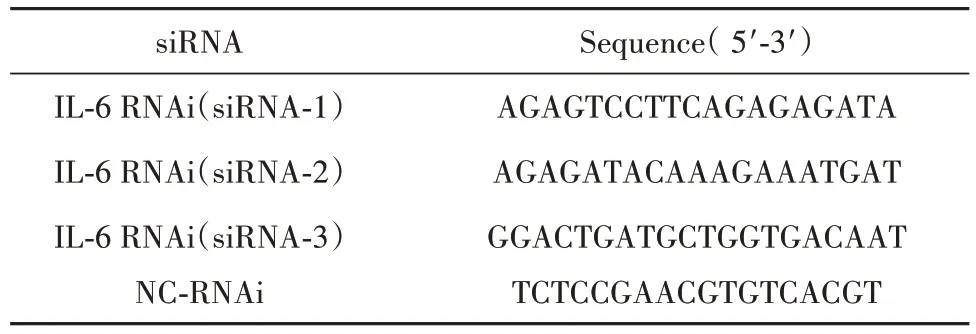
表1 IL-6 RNAi序列Tab.1 IL-6 RNAi sequences
1.2.1.3 RT-qRCR 检 测 Trizol 法 提 取 J774A. 1 细胞总RNA,分光光度计测定RNA 浓度,吸光度值(A260/280)均为 1.8~2.0。使用 PrimeScriptTMRT 试剂盒将1 ug 总RNA 逆转录获得cDNA。逆转录条件:37 ℃ 15 min,85 ℃ 5 s。使用 Premix Ex Tag 试剂盒,采用LightCycler96 PCR仪扩增,反应条件:95 ℃30 s(1 个循环),95 ℃ 5 s 和 60 °C 30 s(40 个循环)。Primer Express 3.0 软件设计小鼠 IL-6 和 GAPDH 基因引物,引物序列见表2。LightCycler96软件自动记录Ct 值,采用2-ΔΔCt方法对数据进行相对定量分析,实验重复3次。
1.2.1.4 shRNA构建 筛选出siRNA-1为高效IL-6 siRNA 序列:5'-AGAGTCCTTCAGAGAGATA-3';阴性对照组(NC-RNAi)核心序列:5'-TTCTCCGAACGTGTCACGT-3'。按慢病毒载体构建要求设计、合成寡核苷酸片段,正向单链内21 nt的寡核苷酸以正反向组合,中间添加loop结构,使寡核苷酸形成短发卡结构(short hairpin RNA,shRNA),寡核苷酸两端带有酶切位点。双链结构序列为:5'-CCGGCCAGAGTCCTTCAGAGAGATACTCGAGTATCTCTCTGAAGGACTCTGGTTTTG-3',用于构建表达绿色荧光蛋白(green fluorescent protein,GFP)的靶向IL-6的 RNAi 慢病毒颗粒(LV-IL-6-RNAi)及阴性对照RNAi慢病毒颗粒(LV-NC-RNAi)。
1.2.1.5 重组慢病毒质粒的构建 寡核苷酸片段退火形成双链DNA 目的片段,GV248 质粒作为工具载体,酶切后与目的片段通过T4连接酶制备载体质粒。载体质粒加入感受态细胞中转化,经PCR 鉴定选取阳性菌落,2%琼脂糖凝胶电泳。选取转化成功的载体质粒PCR 测序检测进一步验证。测序正确的单菌落扩增后,去内毒素质粒抽提试剂盒抽提质粒。
1.2.1.6 慢病毒包装、浓缩纯化、感染滴度确定将制备的载体质粒分别与辅助质粒pHelper1.0 和pHelper 2.0共同转染293T细胞,根据细胞状态48~72 h后收获含病毒的上清。4 000 g 离心10 min 除去细胞碎片后以0.45 µm 滤器过滤,4 ℃、25 000 r/min 离心2 h,弃上清后加病毒保存液重悬,4 ℃、10 000 r/min再次离心5 min取上清病毒液分装。
1.2.2 LV-IL-6-RNAi 转染J774A. 1 细胞的感染滴度及干扰效率测定 将对数生长期J774A.1细胞用DMEM 高糖完全培养基制备 5×104个/ml 悬液,取100 µl/孔加入96孔板,37 ℃、5%CO2培养箱培养24 h细胞融合度约30%时进行LV-IL-6-RNAi、LV-NC-RNAi病毒感染,用病毒稀释液将病毒稀释为1×108TU/ml、1×107TU/ml、1×106TU/ml 3 个浓度梯度,即感染复数(multiplicity of infection,MOI)为1、10、100。每孔加入10µl 病毒液与完全培养基配成100µl 培养体系,培养48~72 h 后荧光显微镜观察表达GFP 细胞数量确定感染滴度。
J774A.1 细胞以 8×104个/孔接种于 24 孔细胞培养板培养 24 h,设 LV-IL-6-RNAi 组、LV-NC-RNAi组、培养基空白对照组,以最佳感染滴度病毒颗粒感染对数生长期J774A.1 细胞,培养96 h,感染效率约80%时,Trizol获取细胞RNA,RT-qPCR检测IL-6、IL-1β、TNF-α mRNA 的相对表达量,引物序列见表2(方法同1.2.1.3)。

表2 RT-qPCR引物序列Tab.2 RT-qPCR primer sequences
1.2.3 LV-IL-6-RNAi治疗CIA疗效观察及测定
1.2.3.1 小鼠CIA 模型构建及CIA 关节炎评分牛Ⅱ型胶原于0.1 mol/L 冰醋酸充分溶解,配成浓度为2 mg/ml 溶液,4 ℃冰箱保存过夜后与等体积弗氏完全佐剂充分混合乳化。第1天每只小鼠尾根部分3点皮内注射乳剂0.1 ml,第21天以同样方法、相同剂量第2 次加强免疫注射[6]。免疫结束后每日观察小鼠关节炎情况,隔日进行CIA 关节炎评分。评分标准如下:0分,正常爪;1分,1趾红肿;2分,>1个趾红肿,但未累及全爪,或全爪中度肿胀;3 分,全爪红肿;4 分,关节重度红肿或强直。四爪总分为该小鼠CIA 评分[7]。
1.2.3.2 LV-IL-6-RNAi 治疗 CIA 的疗效 第 2 次加强免疫注射前24 h,CIA 模型小鼠随机分为CIA-LV-IL-6-RNAi组、CIA-LV-NC-RNAi组、CIA-MTX组、CIA-PBS空白对照每组7只,并设健康对照组。分别向小鼠关节腔内注射LV-IL-6-RNAi(1×106TU/ml)、LV-NC-RNAi(1×106TU/ml),腹腔注射MTX(1 mg/kg)、等体积PBS,健康小鼠腹腔注射等体积PBS,每周3次。
首次免疫注射后第42天(注射LV-IL-6-RNAi等处理后第21 天)麻醉小鼠行心内穿刺取血,ELISA法检测小鼠血清IL-6、TNF-α 及IL-1β 水平。取关节组织置于4%多聚甲醛4 ℃固定过夜,随后在pH7.4的10%EDTA 溶液中4 ℃保存2周,脱钙,石蜡包埋,切片(4µm),室温染色(苏木精5 min、伊红30 s),光学显微镜下观察。
1.3 统计学分析 使用GraphPad Prism 8.0 软件进行数据分析。所得计量资料用表示。两组间比较采用t检验,多组间比较采用单因素方差分析(one-way analysis of variance,one-way ANOVA),P<0.05 为差异有统计学意义。所有细胞实验至少重复3次,每组样本均设3个复孔。
2 结果
2.1 IL-6 RNAi慢病毒颗粒构建
2.1.1 高效siRNA 序列筛选 分别用siRNA-1、siRNA-2、siRNA-3、NC-RNAi 转染 J774A. 1 细胞,并设培养基空白对照组,RT-qPCR 检测结果显示:3 组siRNA-IL-6 的IL-6 mRNA 相对表达量均明显低于NC-RNAi 组和空白对照组,siRNA-1 的干扰效率达80.00%,siRNA-1 组IL-6 mRNA 相对表达量显著低于siRNA-2和siRNA-3(F=58.74,P<0.01,图1)。
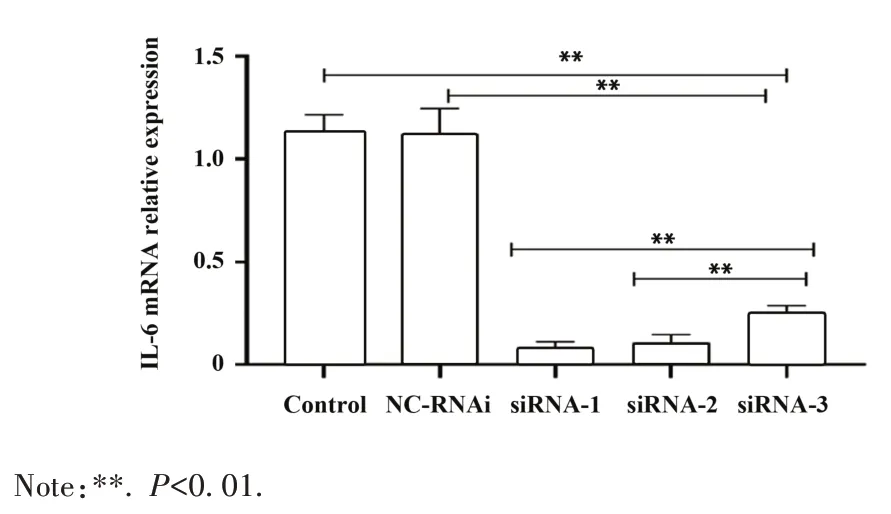
图1 各组IL-6 mRNA相对表达水平Fig.1 IL-6 mRNA relative expression in each group
2.1.2 shRNA、重组慢病毒质粒及目的基因的序列测定 PCR 鉴定感受态细胞中转化的载体质粒,选取阳性菌落,行2%琼脂糖凝胶电泳,结果显示鉴定组分子量略高于空载质粒对照组,说明转化成功(图2)。PCR测序显示插入的针对IL-6基因的siRNA核苷酸序列正确(图3),结果表明成功构建了沉默IL-6基因的慢病毒载体。

图2 重组慢病毒质粒PCR产物电泳图Fig.2 Electrophoregram oflentiviralplasmid PCR products
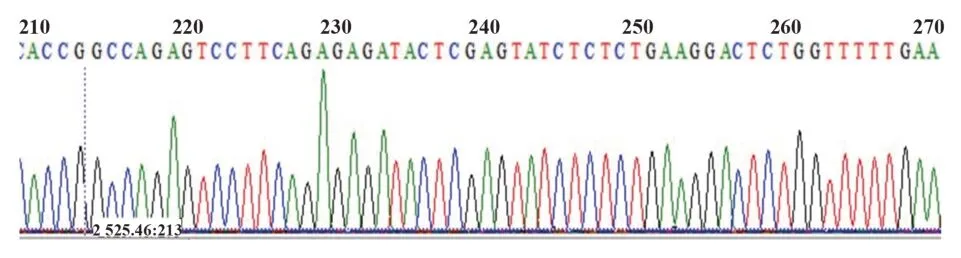
图3 重组慢病毒质粒PCR测序Fig.3 Sequencing of recombinant lentivirus plasmid by PCR
2.2 LV-IL-6-RNAi 感染J774A. 1 细胞的病毒滴度及干扰效率测定 LV-IL-6-RNAi感染J774A.1细胞的滴度 MOI 分别为 1、10、100 时,200 倍显微镜下观察显示,J774A.1细胞表达GFP数占总细胞数分别为(72.56±2.19)%、(85.89±2.45)%、(47.65±2.06)%,MOI 为10 时感染效率显著高于其他组(F=70.57,P<0.01,图4)。以最佳感染滴度LV-IL-6-RNAi感染对数生长期J774A. 1 细胞,IL-6 mRNA 相对表达量显著低于LV-NC-RNAi 组及培养基空白对照组(F=33.47,P<0.01)。IL-1β 和TNF-α mRNA 相对表达差异无统计学意义(P>0.05,图5)。

图4 LV-IL-6-RNAi感染J774A. 1细胞不同MOI值时GFP表达情况(×200)Fig.4 Expression of GFP in J774A. 1 cells infected by LV-IL-6-RNAi with different MOI(×200)
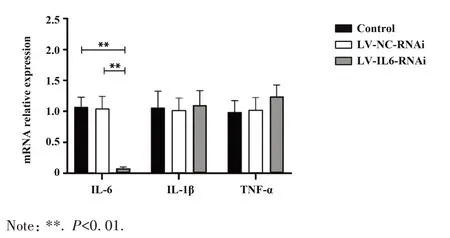
图5 LV-IL-6-RNAi 及 LV-NC-RNAi 感染 J774A.1 细胞后IL-6、IL-1β及TNF-α mRNA相对表达Fig.5 Relative expressions of IL-6,IL-1β and TNF-α mRNA in J774A. 1 cells infected with LV-IL-6-RNAi and LV-NC-RNAi
2.3 LV-IL-6-RNAi治疗CIA的效果
2.3.1 小鼠CIA 模型的构建 注射Ⅱ型胶原及弗氏完全佐剂混合乳化液后第28~35 天,小鼠出现关节红肿、活动受限,多累及后肢足、踝和膝,但前爪也有受累。自第28 天起,关节炎评分显著提高(t=3.83,P<0.01,图6A),成模率为96.43%。CIA 小鼠血清IL-6 水平显著高于健康对照组(t=14.72,P<0.01,图6B)。CIA 小鼠和健康对照组炎症细胞浸润数分别为(207.70±11.04)个和(28.00±4.56)个(P<0.01,图6C、D)。
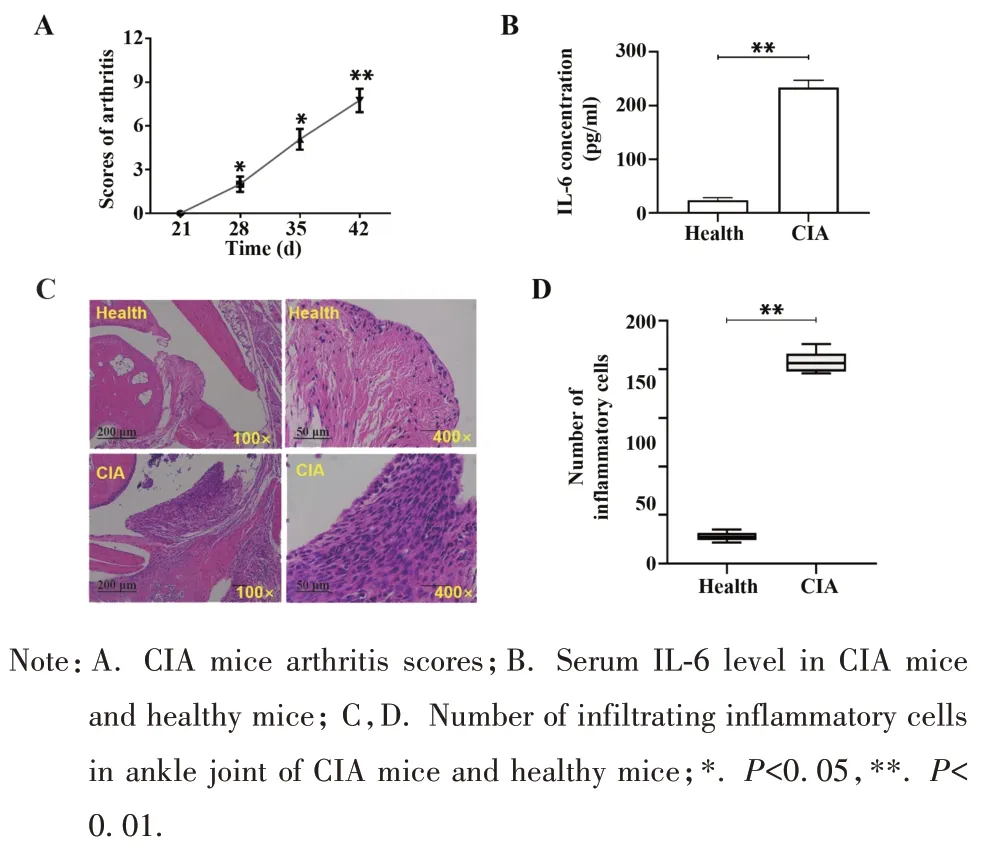
图6 小鼠CIA模型构建情况Fig.6 Construction of CIA mice model
2.3.2 LV-IL-6-RNAi 对CIA 关节炎评分的影响首次免疫注射第35 天后,CIA-LV-IL-6-RNAi 组及CIA-MTX组关节炎评分下降。首次免疫注射第42天,CIA-LV-IL-6-RNAi 组 、CIA-MTX 组 、CIA-LV-NCRNAi 组、CIA-PBS 组关节炎评分分别为(5.00±3.26)分、(5.28±2.22)分、(10.71±2.75)分、(9.86±1.34)分,CIA-LV-IL-6-RNAi 组关节炎评分显著低于 CIA-LV-NC-RNAi 和 CIA-PBS 组(F=10.05,P<0.01)。CIA-LV-IL-6-RNAi 组与 CIA-MTX 组之间差异无统计学意义(t=0.19,P=0.85,图7)。
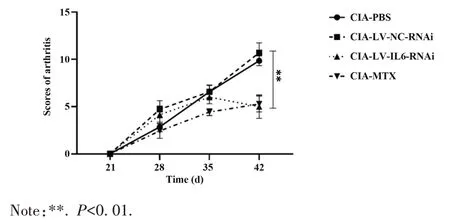
图7 各组CIA小鼠关节炎评分Fig.7 Arthritis score of CIA mice in each group
2.3.3 LV-IL-6-RNAi 对 CIA 血 清 IL-6、IL-1β 和TNF-α 的影响 收集小鼠血清,ELISA 检测结果显示:正常健康组、CIA-PBS 组、CIA-LV-NC-RNAi 组、CIA-LV-IL-6-RNAi 组和 CIA-MTX 组血清 IL-6 水平分别为(28.37±12.35)pg/ml、(234.3±33.55)pg/ml、(272.7±28.46) pg/ml、(117.40±34.69) pg/ml、(158.60±23.97)pg/ml,CIA-LV-IL-6-RNAi 组 血 清IL-6水平显著低于CIA-PBS组和CIA-LV-NC-RNAi组(F=87.29,P<0.01);CIA-LV-IL-6-RNAi 组与 CIAMTX 组血清IL-6 水平差异无统计学意义(t=2.583,P=0.19,图8A)。
正常健康组、CIA-PBS 组、CIA-LV-NC-RNAi 组、CIA-LV-IL-6-RNAi 组和 CIA-MTX 组血清 IL-1β 水平分别为(67.50±6.58)pg/ml、(477.4±58.13)pg/ml、(460.0±70.03)pg/ml、(184.3±24.80)pg/ml、(175.7±20.52)pg/ml,CIA-LV-IL-6-RNAi 组血清 IL-1β 水平显著低于 CIA-PBS 组和 CIA-LV-NC-RNAi 组(F=18.20,P<0.01)。CIA-LV-IL-6-RNAi 组与CIA-MTX组血清IL-1β 水平差异无统计学意义(t=0.27,P=0.79,图8B)。
正常健康组、CIA-PBS 组、CIA-LV-NC-RNAi 组、CIA-LV-IL-6-RNAi组和CIA-MTX组血清TNF-α水平分别为(53.58±11.96)pg/ml、(534.10±53.20)pg/ml、(601.00±40.07)pg/ml、(384.30±39.18)pg/ml、(417.80±33.91)pg/ml,CIA-LV-NC-RNAi 组血清 TNF-α 水平亦显著低于CIA-PBS 组和CIA-LV-NC-RNAi 组(F=30.79,P<0.01)。CIA-LV-IL-6-RNAi 组与CIA-MTX组血清TNF-α 水平差异无统计学意义(t=0.65,P=0.99,图8C)。
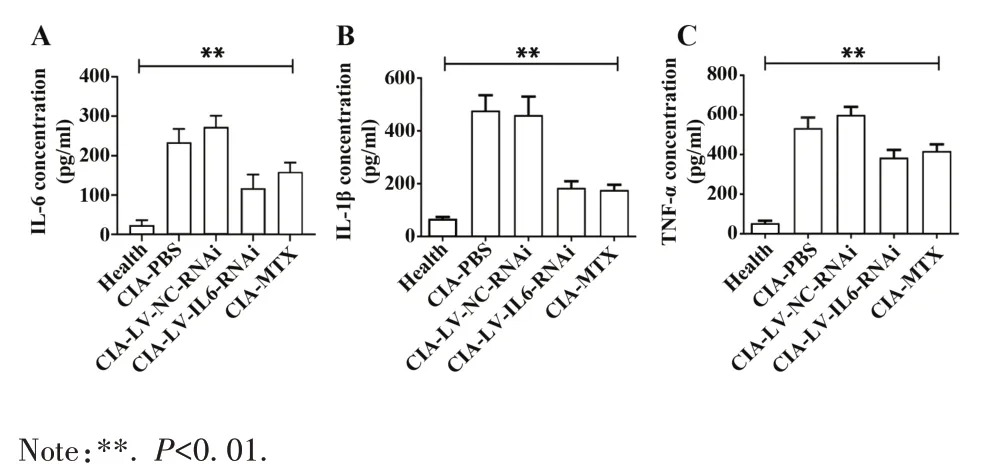
图8 各组小鼠血清IL-6、IL-1β和TNF-α水平Fig.8 Serum IL-6,IL-1β and TNF-α levels of mice in each group
2.3.4 LV-IL-6-RNAi 治疗 CIA 对 CIA 关节炎症细胞浸润的影响 小鼠踝关节石蜡切片HE染色,400倍镜下观察结果显示:健康组、CIA-PBS 组、CIA-LVNC-RNAi 组、CIA-LV-IL-6-RNAi 组和 CIA-MTX 组炎症细胞浸润数分别为(24.71±7.04)个、(173.00±17.14)个、(187.00±13.67)个、(91.71±18.03)个、(97.29±15.10)个,CIA-LV-IL-6-RNAi组和CIA-MTX组炎症细胞的浸润数量均显著少于CIA-LV-NC-RNAi组和 CIA-PBS 组(F=141.80,P<0.01),而 CIA-LVIL-6-RNAi 组和CIA-MTX 组差异无统计学意义(t=0.63,P=0.54,图9)。
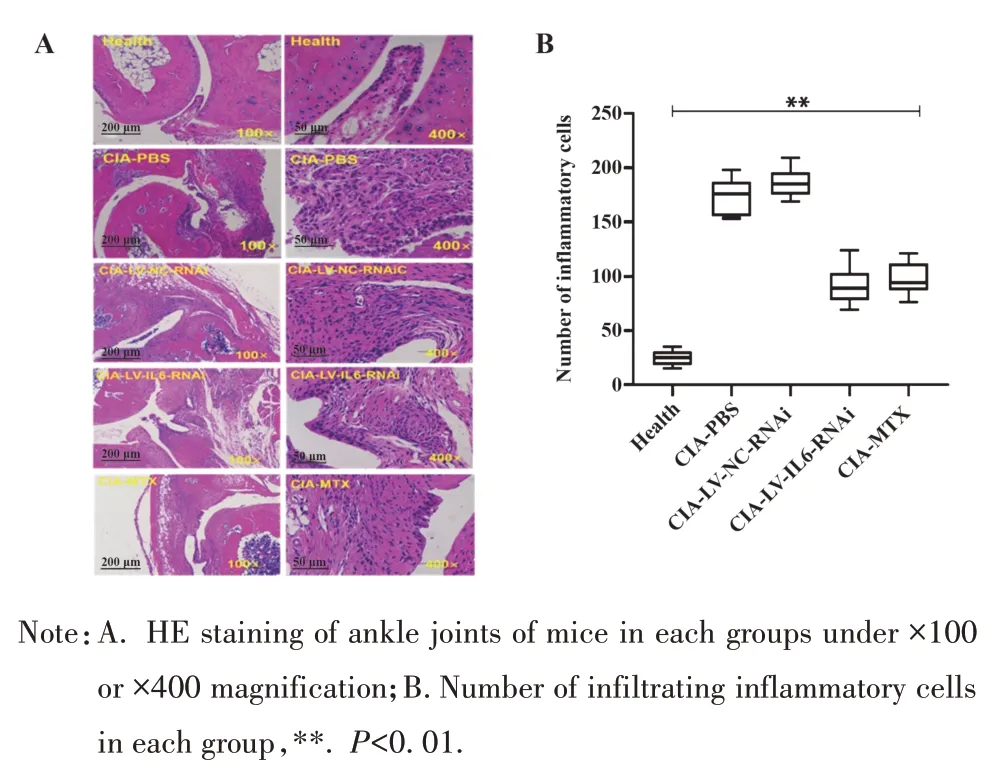
图9 各组小鼠踝关节切片HE染色和炎症细胞浸润数Fig.9 HE staining of ankle joint and number of infiltrating inflammatory cells of mice in each group
3 讨论
基因治疗已成为RA 最有前景的治疗手段之一[8]。RNAi 涉及序列特异性转录后基因沉默,已成为一种主要的基因治疗方法[9]。RNAi 通过转染瞬时作用的siRNA 或通过载体导入稳定的shRNA 实现。RNAi 治疗的关键,是根据靶细胞选择适当靶点、载体及构建高效的RNAi载体颗粒。
IL-6 是RA 发生、发展中主要促炎细胞因子,活化巨噬细胞是产生IL-6 的主要细胞,因此本文拟以巨噬细胞作为靶细胞、IL-6 作为治疗靶点[10-15]。国外研究者用siRNA脂质复合体特异性沉默IL-6治疗CIA取得了令人鼓舞的结果[16]。本文拟通过导入稳定的shRNA,长期干扰巨噬细胞表达IL-6 而达到抗炎治疗作用。目前有多种载体用于携带shRNA,而慢病毒在多种细胞系中具有基因转导效率高、外源基因稳定整合、长期表达、细胞毒性低的特点,已成功作为载体用于基因治疗[17]。单核巨噬细胞、神经元细胞、胰腺细胞等是比较难以转染或感染的细胞系,目前常用的腺病毒载体对其感染率低,而慢病毒可转染或感染单核巨噬细胞系,因此本研究以慢病毒为载体,构建LV-IL-6-RNAi,进行体外和体内研究。
为确保IL-6 被特异性有效抑制,本研究设计并合成3 对针对IL-6 基因的siRNA 序列以及siRNA 阴性对照序列,采用巨噬细胞株J774A.1 检测其敲低效率,结果显示3 对针对IL-6 基因的siRNA 在J774A.1细胞中均能有效沉默IL-6基因,但靶向IL-6基因的 siRNA 不影响 J774A. 1 细胞 IL-1β 和 TNF-α mRNA 表达,说明在体外J774A. 1 细胞水平,通过siRNA转染瞬时作用,RNAi具有有效性及特异性[18]。筛选出敲低效率最高(80.00%)的IL-6 siRNA 序列,构建shRNA、重组慢病毒质粒、测序检测验证后抽提质粒,并进行慢病毒包装,构建LV-IL-6-RNAi 病毒颗粒,稳定沉默IL-6 并表达直接呈现病毒感染能力的GFP。为检测LV-IL-6-RNAi 的安全性和更好把握LV-IL-6-RNAi 病毒颗粒小鼠体内注射剂量,在体外J774A. 1 细胞水平进行病毒颗粒滴度梯度实验,明场下观察,感染滴度为1×108TU/ml的高滴度病毒感染72 h 后J774A. 1 细胞密度仍>90%,说明LV-IL-6-RNAi 具较好的安全性。暗场下观察,表达GFP的J774A.1细胞在1×107TU/ml感染滴度下占比最高,说明该滴度下LV-IL-6-RNAi感染能力最佳。
以慢病毒最佳感染滴度感染J774A. 1 细胞,LV-IL-6-RNAi组IL-6 mRNA相对表达水平显著低于LV-NC-RNAi组和培养基空白对照组,IL-1β和TNF-α mRNA 相对表达差异无统计学意义(P>0.05),再次说明体外J774A.1细胞水平通过载体导入稳定shRNA(LV-IL-6-RNAi)靶向 IL-6 的 RNAi 效果及特异性较好。RUBIN 等[19]利用不同病毒载体进行实验性基因治疗证实,慢病毒载体治疗脱靶效应低于其他病毒载体,结合本研究结果,再次提示慢病毒是一种针对巨噬细胞的高效实用性载体。以上结果表明,通过转染瞬时作用的siRNA 及通过载体导入稳定的shRNA(LV-IL-6-RNAi)在分子水平上实现了对巨噬细胞的RNAi作用。
CIA 在临床表现、免疫病理等方面与人RA 类似,因而RA体内实验性基础研究以CIA作为研究对象。注射Ⅱ型胶原及弗氏完全佐剂混合乳化液后第28~35天,从关节表现、关节病理、血清学方面,均提示建模成功(成模率达96.43%),可用于体内研究。
MTX 作为治疗RA 的重要药物,疗效确切,因而被作为阳性对照;治疗局部关节炎症理应首选关节腔内注射,但小鼠关节腔狭小,MTX 关节腔注射剂量相对较大,因此选择MTX 腹腔注射可能更优于关节腔注射[20-22]。
CIA 模型小鼠二次加强免疫注射前(首次免疫注射后第21 天),分别向4 各组小鼠对应部位注射LV-IL-6-RNAi、LV-NC-RNAi、MTX、PBS 溶液,健康小鼠腹腔注射PBS,首次免疫注射后第28 天,CIA-LV-IL-6-RNAi组和CIA-MTX组关节炎评分增幅减弱;首次免疫注射后第35 天,CIA-LV-IL-6-RNAi组和CIA-MTX 组关节炎评分开始降低,关节炎评分随时间而缓慢降低至首次免疫注射后第42天,而阴性对照、空白对照组的关节评分持续提高。提示LV-IL-6-RNAi 治疗1 周内起效,持续时间至少2 周以上。首次免疫注射后第42天,麻醉小鼠行心内穿刺取血,检测小鼠血清IL-6、IL-1β 和TNF-α 水平,处死小鼠进行病理检查。CIA-LV-IL-6-RNAi 组和CIA-MTX 组血清 IL-6、IL-1β、TNF-α 水平及受累关节炎症细胞浸润数均显著低于阴性对照、空白对照。CIA-LV-IL-6-RNAi 组与CIA-MTX 组在关节评分、血清细胞因子水平、受累关节炎症细胞浸润数三方面差异均无统计学意义,说明LV-IL-6-RNAi 与1 mg/kg 的MTX 疗效相当。本研究从关节表现、血清细胞因子水平、关节病理上,均证实LV-IL-6-RNAi治疗CIA的有效性,为RNAi技术从试验到临床提供了有力支持。考虑到CIA 存活时间问题,本研究的LV-IL-6-RNAi 治疗观察时间仅为3 周,需后续研究探索其长期疗效。与传统药物相比,慢病毒基因治疗无需反复多次应用。另外,在体内CIA 动物水平方面,LV-IL-6-RNAi 虽然特异性干扰IL-6 表达,但由于细胞因子网络因素,同样也间接影响其他炎症因子如IL-1β和TNF-α表达,与体外J774A.1细胞水平RNAi方面特异性不同。
LV-IL-6-RNAi 实验基因治疗RA 可行且有效。虽然RNAi 治疗在基因水平发挥作用,与新兴的针对细胞因子的生物制剂在蛋白水平进行调控相比具有一定优势,但目前RNAi 治疗仍处于试验阶段,仍需大量基础和临床研究方能够应用于临床。希望不久的将来,LV-IL-6-RNAi能够尽快从试验走向临床,为RA患者提供安全有效的治疗。
——一道江苏高考题的奥秘解读和拓展

