棉花纤维发育的分子机理研究进展
上官小霞,曹俊峰,杨琴莉,吴霞
(1.山西农业大学棉花研究所,山西 运城 044000;2.上海交通大学农业与生物学院,上海 200241)
棉花是重要的经济作物,棉纤维是纺织工业最重要的天然原料。 棉纤维品质由细度、长度、强度、马克隆值、黄度等多个指标衡量。 随着植棉机械化进程的推进和纺织行业的发展,对棉花纤维品质的要求也越来越高,原有栽培种的品质需要进一步提升。 因此,全面了解棉花纤维发育的分子机理,对于棉花品质改良和分子设计育种具有十分重要的意义。
1 棉花纤维发育的生物学基础
棉纤维是由胚珠外珠被的表皮细胞分化而成。 成熟的纤维呈扁平带状,并具有不规则的扭曲,纤维的横断面可以观察到初生胞壁、次生胞壁、腔壁及中腔4 个部分。 其发育过程大致可分为相互重叠的起始、伸长、次生壁加厚以及脱水成熟4 个阶段[1]。
棉纤维细胞的分化一般在开花前3 d 到开花当天(0 days post anthesis,0 DPA)完成,约有25%~30%的表皮细胞会分化为纤维细胞形成长纤维。短绒细胞的分化一般在5~10 DPA,最终发育为短纤维。 棉纤维细胞分化和发育具有均一性和同步性。 5~15 DPA 为棉纤维快速伸长时期,此时棉花对水分和温度极为敏感,细胞内也存在大量脂肪酸和糖类物质。 纤维细胞的伸长模式一直存在争议,细胞顶端高浓度的钙离子、活性氧、膜泡的聚集暗示棉纤维可能为顶端伸长模式,但是纤维细胞中微管横向定向于生长轴又呈现出扩散伸长模式[2]。 近期的研究通过活体纤维细胞的荧光观察,认为棉纤维的伸长模式呈现为向顶的扩散模式[3]。 棉纤维次生壁加厚时期始于15 DPA,这一阶段细胞的主要活动是纤维素的合成及沉积。 纤维素的沉积量决定细胞壁的厚度,而原纤维的排列方式决定纤维素的结晶度,两者构成了纤维强度的结构基础。 当细胞壁加厚至3~4 μm时,细胞开始脱水凋亡,整个纤维细胞呈扭曲螺旋状态。 棉纤维的天然扭曲可增加纺纱时纤维之间的抱合力,提高成纱强度。 成熟的棉纤维含有大约95%的纤维素以及少量的角质、蜡质、蛋白质和无机物等[4]。
2 转录因子对棉花纤维发育的调控
棉花纤维细胞的分化和发育由高度程序化的复杂的调控网络所控制,转录因子在调控纤维细胞分化及发育方面起重要作用(表1)。 越来越多的研究表明,棉花纤维细胞分化起始的分子机制与模式植物拟南芥表皮毛的分化机制具有一定的相似性。 拟南芥表皮毛发育过程中,R2R3 MYB 类转录因子GL1、bHLH 类转录因子GL3或EGL3 以及WD40 蛋白TTG1 组成1 个MYBbHLH-WD40 蛋白复合体, 通过激活下游的HD-ZIP 类转录因子GL2 的表达促进表皮毛的发育[5-6]。 一组功能冗余的R3 MYB 家族成员如TRY、CPC、ETC1、ETC2、ETC3、TCL1 和TCL2等通过与GL1 竞争结合GL3 蛋白的MYB 结合位点形成失活的蛋白复合体,从而抑制拟南芥表皮毛发育[7-8]。 棉花中与拟南芥表皮毛发育关键因子的同源基因相继被克隆和验证[9-16]。 与GL1 同源的R2R3 MYB 转录因子GaMYB2 可以完全互补拟南芥gl1突变体的无表皮毛发育的表型[9]。 拟南芥gl1突变体中过量表达棉花GhMYB3基因,不仅可以完全互补该突变体表皮毛缺失的表型,还可以在茎秆、花梗、萼片等部位产生较多的异位表皮毛[10]。在棉花中过量表达GhMYB3基因可以显著促进纤维伸长并增加衣分[10]。GhMYB109基因也编码1 个R2R3 MYB 转录因子,在纤维起始期和快速伸长期高表达;通过RNA 干扰(RNA interference,RNAi)方法降低GhMYB109基因的表达,会使纤维细胞分化延迟、起始数量减少,表明该基因也参与了对棉纤维细胞起始与发育的调节[11]。 GhCPC 为R3 类MYB 因子,与拟南芥R3 MYB 因子CPC 同源性较高,在棉花中过量表达GhCPC基因会抑制纤维的起始和伸长[12]。棉花GhDEL65为GL3的同源基因, 在拟南芥gl3/egl3双突变体中表达该基因, 可以部分恢复突变体表皮毛的发育;在野生型拟南芥中过量表达该基因,则可以在莲座叶、主茎产生过量表皮毛,且部分表皮毛分叉数显著增多;棉花转基因试验也证明GhDEL65的过量表达可促进纤维细胞的伸长[13]。 棉花中分离到4 个与拟南芥TTG1同源的基因,其中GhTTG1和GhTTG3基因可以完全互补拟南芥ttg1突变体的表型[14]。 酵母双杂交结果表明棉花GhTTG3、GhMYB2、GhMYB3 均可以与GhDEL65 蛋白相互作用,暗示在棉花体内这些转录因子也可能通过蛋白复合体行使功能[13]。 尽管棉纤维的发育模式远比拟南芥毛状体复杂,但在不同的物种间存在基因的保守性及其蛋白结构和生物学功能的相似性,推测棉纤维细胞的分化与拟南芥表皮毛分化具有相似的调控机制[15]。

表1 调控棉花纤维发育的关键转录因子Table 1 Key transcription factors in regulating cotton fiber development
陆地棉中包含26 个HD-ZIP IV 家族基因,其中GaHOX1能够完全互补拟南芥gl2突变体的表皮毛缺失表型[16],棉花转基因试验表明GhHOX3在棉纤维伸长过程中起决定性作用[17]。抑制GhHOX3基因的表达, 棉纤维伸长明显受到抑制, 纯合的RNAi 株系棉花种子呈现光籽表型(仅有短绒)。 GhHOX3 可以与另一个正向调控纤维发育的HD-ZIP IV 因子GhHD1(即GhHD-1[18])相互作用[18],激活下游细胞壁疏松蛋白基因GhRDL1和GhEXPA1的表达进而促进纤维细胞的伸长[17]。 赤霉素(Gibberellic acid,GA)信号途径的负调控因子GhSLR1 可以同GhHD1 竞争性地与GhHOX3 结合,以阻碍GA 信号传递,进而抑制纤维细胞伸长所需要的转录激活[17]。GhPRE1基因编码一个非典型的bHLH 转录因子,在棉纤维快速伸长期高表达, 但在GhHOX3基因沉默株系的纤维中表达量明显降低,暗示该基因为纤
维伸长的一个正调控因子[19]。在四倍体棉花中,对纤维伸长起调控作用的主要为来自At 亚基因组的GhPRE1A基因,而其Dt 亚基因组的同源基因因其启动子区域的TATA-box 片段缺失而失去调控活性。棉花中过量表达GhPRE1A基因,成熟纤维的长度比对照明显增加[19]。
miR319 靶向的TCP 家族基因在拟南芥、杨树等植物中可以调控次生壁的合成和表皮毛发育[20-21],棉花中的研究同样表明miR319 的靶基因GhTCP4通过抑制纤维细胞伸长和激活次生壁相关基因的表达来促进纤维细胞壁加厚[22]。在棉花纤维发育的早期阶段,miR319 表达量丰富,其靶基因GhTCP4低水平表达,而GhHOX3基因在这个阶段发挥积极作用,促进纤维细胞伸长。 在纤维生长的后期,miR319 的表达量下降,GhTCP4表达量上升,从而促进纤维素的生物合成和次生壁 的 形 成[22]。 因 此,GhHOX3基 因 和miR319 靶向的GhTCP4基因参与调节棉花纤维从细胞伸长到细胞壁增厚的转变[22]。GhMYB7被认为是GhTCP4 的直接下游基因, 可通过结合纤维素合成酶基因GhCesA4、GhCesA7、GhCesA8的启动子调控纤维细胞次生壁加厚[23]。
金鱼草中的MIXTA基因和矮牵牛中的PhMYB1基因的主要功能是调节花瓣乳突细胞的形成,说明MIXTA 类R2R3 MYB 转录因子同样具有调控植物表皮细胞分化的功能[24]。GhMYB25和GhMYB25-like基因编码MIXTA 类R2R3 MYB 转录因子, 通过RNAi 抑制GhMYB25基因的表达,可使棉花纤维分化起始延迟、纤维细胞数量减少、纤维长度变短,过量表达GhMYB25基因则使叶柄表皮毛数量和纤维细胞起始数量明显增加[25]。GhMYB25-like 与GhMYB25 在蛋白水平上具有69%的相似性, 抑制GhMYB25-like基因的表达,棉纤维发育被完全抑制,种子呈现无纤维表型,然而植株其他部位的表皮毛发育未受到明显影响, 表明GhMYB25-like 是棉纤维细胞起始发育的一个关键调控因子[26]。 对棉花光子突变体N1的图位克隆找到了一个MIXTA 类转录因子基因GhMML3[27],该基因被证实与GhMYB25-like为同一基因。对无长绒突变体Li3的图位克隆找到另一个MIXTA 基因GhMML4,利用病毒诱导的基因沉默 (Virus-induced gene silencing,VIGS) 技术对其干扰会显著减少棉纤维的产生[28]。 综合这些结果,棉花中的MIXTA 类MYB 转录因子已经形成了一个独特的转录调控网络,决定纤维细胞发育的命运。
水稻和拟南芥中NAC 类转录因子在细胞壁纤维素沉积方面发挥着重要的调控作用[29-30]。GhFSN1基因编码一个NAC 类转录因子,通过结合GhMYBL1、GhKNL1等次生壁相关基因的启动子激活其表达进而调控纤维次生壁的形成[31]。通过群体材料的全基因组关联分析(Genome wide association study, GWAS)发现GhMYB46可能也与纤维次生壁的加厚有关[32]。 纤维的伸长使用蔗糖作为直接碳源,GhMYB212 被确认为是纤维伸长过程中蔗糖从胚珠运输到纤维的重要调节因子。 GhMYB212 通过调控蔗糖转运基因GhSWEET12的表达促进纤维细胞的发育[33]。GhWRKY16 是第一个被报道的与棉纤维发育相关的WRKY 类转录因子, 正向调节纤维的起始和伸长[34]。 与对照相比,GhWRKY16基因沉默的转基因棉花胚珠上的纤维突起数量明显减少、纤维较短。GhWRKY16 可以被GhMPK3-1 蛋白磷酸化,磷酸化的GhWRKY16 直接激活GhMYB25、GhHOX3、GhMYB109和GhCesA6D-D11等纤维发育关键基因的转录,调控早期纤维发育。 因此GhWRKY16 的磷酸化对棉花纤维发育过程中下游基因的转录激活至关重要[34]。
综上所述,通过同源克隆、图位克隆和测序等手段挖掘棉花种质资源中的关键基因,已鉴定到在棉纤维起始、伸长及细胞壁加厚过程中发挥重要调控功能的多个转录因子,为全面解析棉花纤维发育的分子调控机制奠定了基础。
3 功能基因对棉花纤维发育的调控
棉花纤维细胞的伸长是一个复杂的生理过程,涉及细胞壁的松弛,液泡膨压变化,膜脂、细胞壁成分和相关蛋白的生物合成及运输。 在这一过程中,参与细胞骨架组装、细胞壁松弛以及糖代谢、脂肪酸代谢等过程的基因发挥了重要作用(表2)。
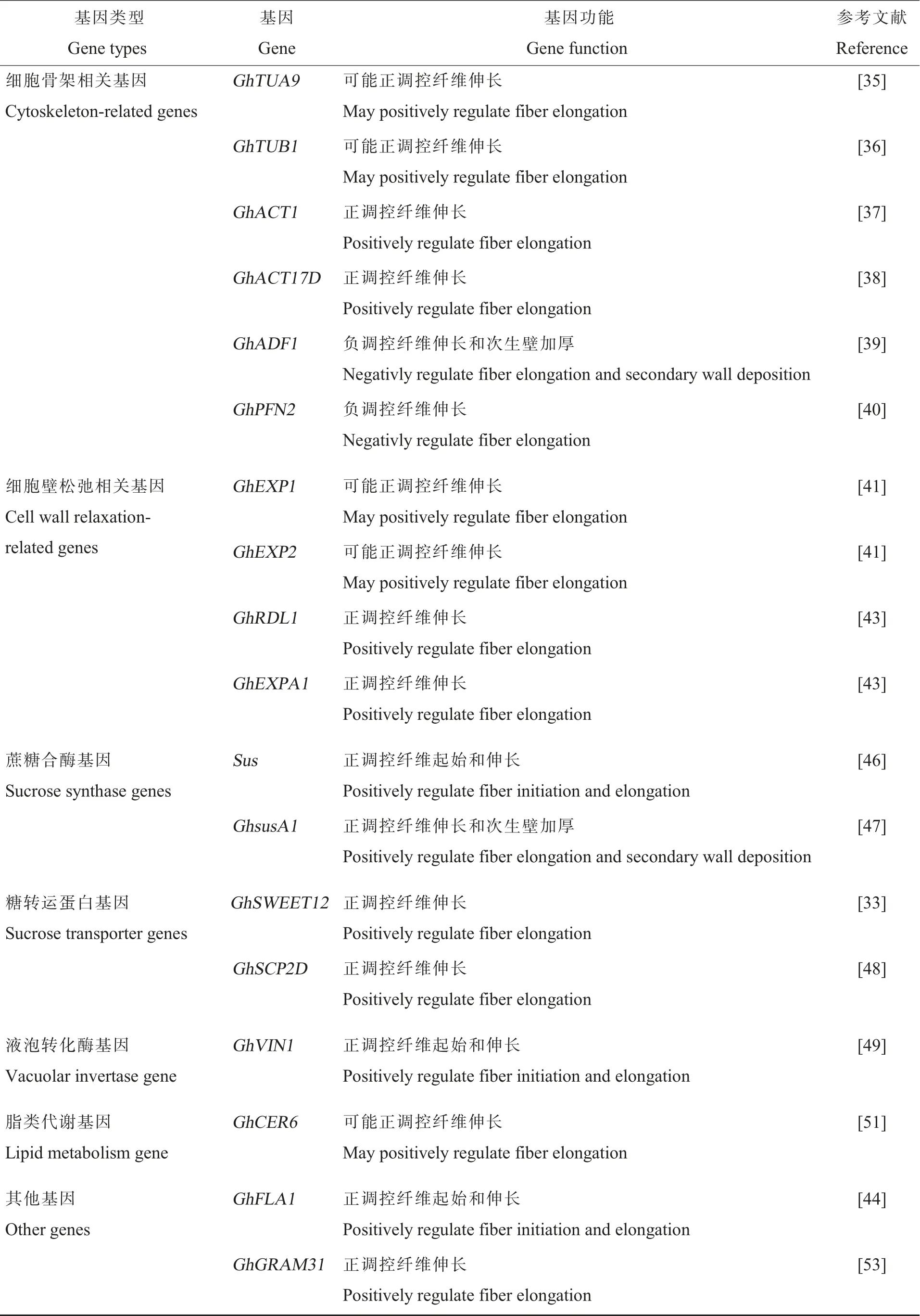
表2 调控棉花纤维发育的主要功能基因Table 2 Key functional genes in regulating cotton fiber development
细胞骨架是细胞的内部支撑,细胞骨架及其动态变化在维持细胞形态、承受外力、保持细胞内部结构的有序性等方面起重要作用。 一些细胞骨架相关基因, 如微管蛋白基因GhTUA9[35]、GhTUB1[36]等,肌动蛋白基因GhACT1[37]、GhACT17D[38]等,肌动蛋白解聚因子基因GhADF1[39]以及肌动蛋白结合蛋白基因GhPFN2[40]等,在棉纤维伸长过程中起核心作用。GhTUA9、GhTUB1分别编码一个α-微管蛋白和一个β-微管蛋白,两者皆在纤维伸长期特异高表达,推测这两个基因可能在纤维细胞的微管组装过程中执行特殊的功能[35-36]。GhTUA9在裂殖酵母(Schizosaccharomyces pombe)中的过量表达可促进宿主细胞非典型纵向伸长1.4~1.7 倍,表明该基因可参与细胞伸长[35]。 肌动蛋白基因GhACT1主要在纤维细胞的伸长期高表达,干扰该基因表达可导致棉纤维细胞中肌动蛋白微丝的含量显著降低,其排列方式变得很不规则,这种微丝骨架系统结构上的紊乱最终导致纤维细胞的伸长生长受阻[37]。 棉花肌动蛋白GhACT17D 中一个氨基酸的替换导致陆地棉Ligon lintless-1(Li1)突变体表型,该氨基酸突变破坏了F 型肌动蛋白的顺向延伸,导致细胞骨架紊乱和细胞极性降低[38]。 抑制肌动蛋白解聚因子GhADF1 表达的转基因棉花纤维长度和强度都有所增加,纤维细胞含有更多的F 型肌动蛋白丝,纤维素含量增加,次生壁也随之加厚,表明肌动蛋白解聚因子对肌动蛋白骨架系统的组装调节对于纤维细胞的伸长和次生壁的合成十分重要[39]。GhPFN2转基因棉纤维中微丝和微管结构方向的变化抑制了棉纤维的伸长,导致纤维伸长提前终止,超表达GhPFN2材料成熟棉纤维长度较野生型明显缩短。 GhPFN2能通过促进束状微丝的形成来影响微丝的结构,从而影响微管排布方向的转变,进而调控棉纤维从伸长到次生壁加厚的转换[40]。
棉纤维发育过程中细胞壁的松弛与纤维细胞的伸长密切相关,与细胞壁松弛相关的延伸蛋白(Expansin)家族成员在这一过程发挥重要作用。 Expansin 蛋白能够打断纤维素微丝间的氢键,从而使细胞壁疏松延展。 陆地棉GhEXP1和GhEXP2基因在棉纤维发育时期特异表达, 推测其对棉纤维发育具有重要作用[41-42]。 含BURP 结构域的蛋白GhRDL1 能与细胞延伸蛋白GhEXPA1 相互作用参与调节纤维伸长过程中的细胞壁疏松[43]。 在棉花中过量表达GhRDL1基因,纤维长度和强度明显增加,同时过表达GhRDL1和GhEXPA1则显著提高棉花的产量[43]。 在棉花中过量表达GhFLA1基因可促进纤维细胞的伸长,抑制该基因的表达则导致棉花纤维发育迟缓、长度变短。 转基因棉花纤维细胞壁组分和单糖(如葡萄糖、阿拉伯糖、半乳糖)的含量与对照相比发生改变,说明GhFLA1 通过影响细胞壁组分等物质的代谢过程来参与棉纤维细胞发育[44]。
蔗糖合酶在维持纤维细胞渗透压方面起重要作用。 与正常纤维材料相比,短纤维突变体中蔗糖合酶在纤维起始后延迟表达,发育过程中胞间连丝开关的时间调控受到了影响,不能正常关闭胞间连丝,造成突变体纤维伸长缓慢[45]。通过转基因反义抑制蔗糖合酶基因Sus的表达可以彻底破坏纤维细胞的伸长[46],而过量表达蔗糖合酶基因GhsusA1则可以促进纤维起始和伸长[47]。MYB 类转录因子GhMYB212 可以直接调控糖类转运蛋白基因GhSWEET12的表达从而影响纤维胞内糖含量,GhSWEET12RNAi 株系棉花纤维长度与对照相比明显变短[33]。 抑制负责蔗糖运输的固醇类运输蛋白GhSCP2D 的表达可导致胞间连丝关闭从而使纤维发育受阻,海岛棉的纤维品质优于陆地棉也有可能与其蔗糖运输通道的开放时间较长有关[48]。 棉花中的液泡转化酶(Vacuolar invertase, VIN) 与纤维细胞的伸长相关。利用RNAi 技术抑制GhVIN1的表达,VIN 活性下降, 棉纤维的起始与发育受到明显抑制,表型严重的转基因棉花后代种子呈现无纤维的表型[49]。体外胚珠培养试验显示,GhVIN1 介导的己糖信号在纤维发育起始阶段起关键作用,可能通过调控MYB 类转录因子和生长素信号等行使功能[49]。
脂类代谢基因在棉纤维迅速伸长中也发挥重要的作用。 长链脂肪酸的积累能够调控乙烯(Ethylene,ET)合成,从而促进纤维伸长[50]。 参与脂类代谢的基因GhCER6在棉纤维细胞伸长期表达量较高,酵母菌株(Saccharomyces cerevisiaeelo3)不能合成26 个碳原子的脂肪酸,生长缓慢,而在该菌株中表达GhCER6基因,可以弥补这一缺陷[51]。 超长链脂肪酸(Very long chain fatty acids,VLCFAs) 可以作为信号分子在细胞的生长发育中发挥生物学功能[52]。 用外加饱和长链、VLCFAs以及VLCFAs 合成抑制剂乙草胺(Acetochlor,ACE)处理体外培养的胚珠,结果表明VLCFAs能显著促进纤维伸长[52]。
GRAM 结构域在真核生物中高度保守,存在于参与膜相关过程的蛋白质中。GhGRAM31主要在纤维发育的快速伸长阶段表达,参与调控纤维长度。 RNAi 转基因棉花株系纤维伸长受到抑制,产生较短的成熟纤维。 GhGRAM31 可以与另外两个GRAM 蛋白GhGRAM5 和GhGRAM35直接相互作用,GhGRAM5 还能与转录因子GhTTG1 相互作用, 而GhGRAM35 与转录因子GhHOX1 和GhHD1 相互作用[53]。 GRAM 蛋白家族基因可作为棉花分子设计育种的候选基因。
不同棉属植物, 包括二倍体雷蒙德氏棉(Gossypium raimondii)、 二 倍 体 亚 洲 棉(G.arboreum)、二倍体草棉(G.herbaceum)、四倍体陆地棉(G.hirsutum)、四倍体海岛棉(G.barbadense)的全基因组测序工作的完成,以及棉花基因组重测序和关联分析工作的展开,从基因组层面系统揭示了棉属植物的进化关系及棉花基因组遗传多样性产生的原因[54]。 对遗传材料的测序和深度挖掘使得GhCIP1、GhUCE、GhXIK、GbPDF1、GbTCP、GhF3H等[55-59]一大批与纤维品质相关的候选基因浮出水面,为进一步解析棉花纤维发育的分子机制及棉纤维品质分子育种提供了重要的参考。
4 植物激素对棉花纤维发育的调控
植物激素在植物生长发育的不同阶段皆起重要的调控作用,对棉纤维发育的调控也不例外(表3)。 生长素(Auxin)被认为与棉纤维的起始、伸长有关。 棉纤维中内源生长素在开花前开始积累,2~3 DPA 达到峰值并在纤维细胞伸长期下降, 而体外培养胚珠时外源施加吲哚乙酸(Indoleacetic acid,IAA)会促进纤维分化,增加纤维数量,且显著增加纤维长度[60]。利用种皮特异启动子FBP7驱动生长素合成途径中的一个重要酶基因iaaM的表达, 在棉花纤维起始期定向且适度地提高胚珠表皮细胞中的生长素浓度,可以明显促进纤维细胞的分化起始,显著增高转基因棉花的衣分, 同时纤维品质也得到了一定的改善[61-62]。 纤维发育所需的生长素主要在胚珠合成,并由GhPIN3a 运输至纤维细胞。PIN 家族基因受到抑制后,纤维的起始和伸长均会受到抑制[63]。在生长素信号方面, 生长素响应基因GhARF2和GhARF18在纤维发育早期高表达[64],通过纤维特异性启动子过量表达GhARF2b基因会抑制纤维细胞的伸长,但促进了纤维细胞起始,纤维数量明显增加;反之,通过RNAi 下调GhARF2b的表达则导致纤维数量减少但长度增加。 GhARF2b可直接与GhHOX3 相互作用抑制GhHOX3 的转录活性[65],这些结果表明GhARF2b基因主要调控纤维细胞的起始[65]。
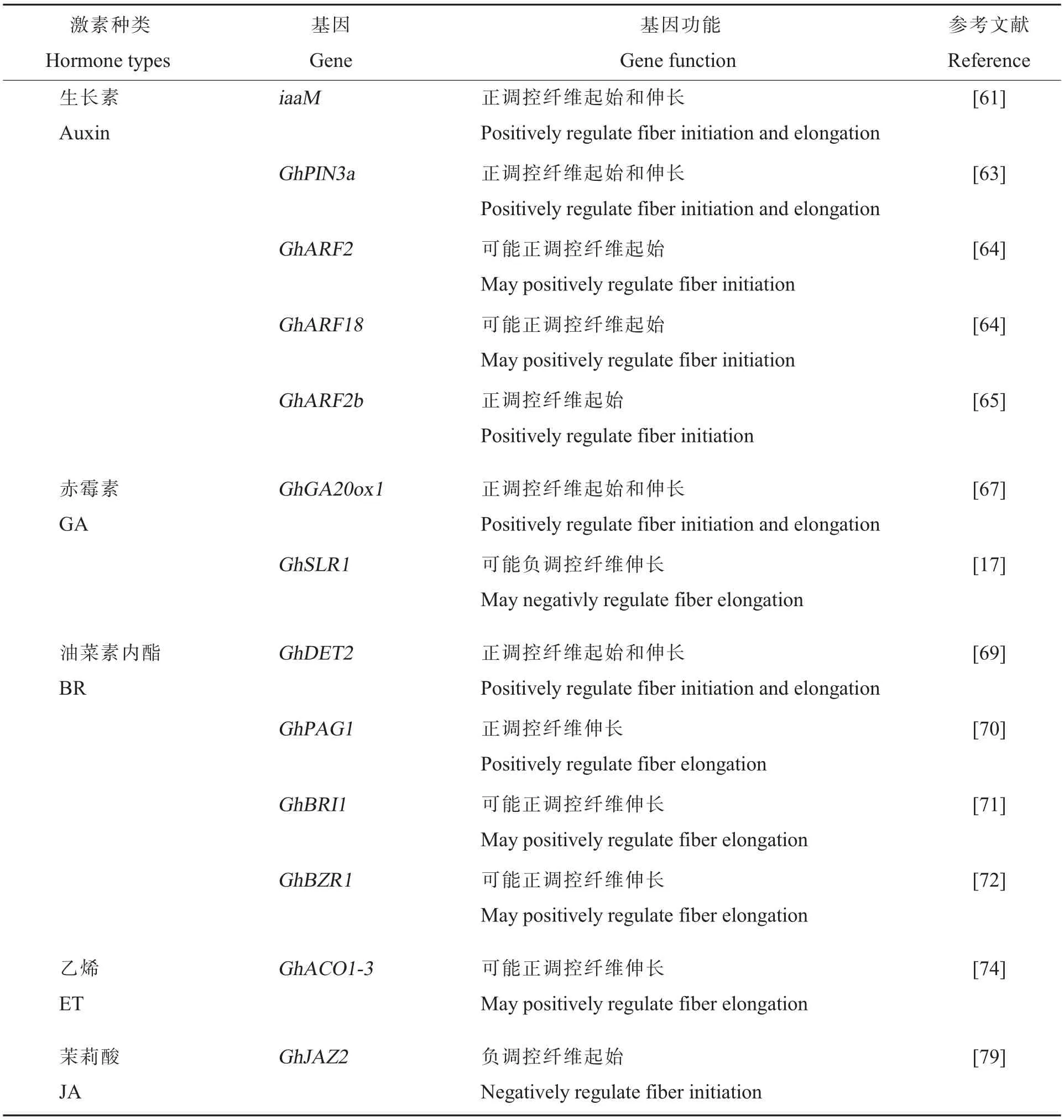
表3 植物激素相关基因在棉纤维发育中的功能Table 3 Functions of plant hormone-related genes in cotton fiber development
GA 在“绿色革命”中起重要的作用,与植物细胞伸长有着密切关系。 外源施加GA 会显著促进棉纤维细胞伸长,而使用GA 合成抑制剂处理体外培养的胚珠后,纤维的起始数量和长度均少于对照[66]。 纤维中的内源GA 含量在其快速生长期(10 DPA)最高,之后快速下降,遗传试验表明过量表达GhGA20ox1会使得棉纤维中GA3 和GA4 积累并产生更多的长纤维[67]。 GA 信号途径调控棉纤维发育的研究已取得重要进展, 当GA含量较低时, 棉纤维伸长的关键因子GhHOX3 与DELLA 蛋白GhSLR1 相互作用; 而当GA 在纤维伸长期积累时,GhSLR1 被泛素化降解,GhHOX3与GhHD1 相互作用激活下游基因GhRDL1和GhEXPA1的表达进而调控纤维伸长[17]。
油菜素内酯(Brassinosteroid, BR)同样正向调控棉花纤维细胞的发育。 体外培养胚珠时施加低浓度的BR 会促进纤维发育, 而施加其生物合成抑制剂芸薹素唑(Brassinazole,BRZ)则会使纤维发育受到抑制[68]。 GhDET2 是BR 生物合成的限速酶,当该基因的表达被抑制时,纤维细胞无法正常起始与伸长,而过表达GhDET2基因则得到相反的表型[69]。 GhPAG1 是与拟南芥CYP734A1同源的BR 合成途径关键酶, 棉花pag突变体会产生短纤维表型, 而外源施加BR 则会恢复其表型[70]。 上述遗传证据表明BR 的生物合成对纤维的起始和伸长均具有调控作用。 在BR 信号传导方面, 棉花中克隆的BR 受体基因GhBRI1也在纤维伸长期高表达, 并且可以完全互补拟南芥bri1-5突变体的表型[68,71]。GhBZR1 被鉴定为棉花中响应BR 信号的关键转录因子,它能和Gh14-3-3L 相互作用并在纤维伸长期结合GhXTH1和GhEXP的启动子进而促进纤维细胞发育。Gh14-3-3L单独过表达也会引起成熟纤维变长,沉默则反之, 而对RNAi 植株外源施加BR 则能够部分恢复短纤维的表型[72]。
对棉花群体进行GWAS 分析表明ET 合成途径与棉花纤维的发育相关联[73]。 体外培养胚珠时施加ET 可以促进纤维伸长, 而施加ET 抑制剂则会抑制纤维发育[50]。 ET 合成的关键基因GhACO1-3在纤维快速伸长期(10 DPA)表达量最高, 同时也造成ET 在该阶段含量较高, 暗示ET 可能是调控细胞伸长的另一种关键激素。 然而,在只有短绒的雷蒙德氏棉中,ACO1和ACO3的表达量也很高, 暗示过量的ET 积累可能造成纤维细胞的提前成熟而无法发育成长纤维[74]。 因此,在纤维细胞内,适量的ET 才能维持纤维的正常发育。 值得注意的是ET 可以互补因芸薹素唑而形成的表型, 而BR 则无法互补因施加乙烯抑制剂而缩短的纤维表型[50]。 这一现象表明ET 除了剂量效应外, 还存在着和其他激素的复杂互作。 胚珠培养体系中外源施加ET 会造成活性氧的积累,表明活性氧诱导的细胞伸长过程可能位于ET 信号转导途径的下游[75]。 外源施加VLCFAs能够促进ET 的合成和纤维发育, 当VLCFAs 的合成被抑制剂阻断时纤维发育受阻,这一效果能够被再次添加ET 所抵消, 以上结果暗示VLCFAs可能位于ET 信号途径的上游[52]。
茉莉酸(Jasmonic acid,JA)一般被认为参与植物对生物和非生物胁迫的响应,但也有报道表明其与植物表皮毛的发育有关[76-77]。 棉花转录组数据分析暗示JA 的代谢途径可能与纤维的起始相关[78]。 进一步的遗传和生化证据表明,JA 信号途径的关键因子GhJAZ2 可以与GhMYB25-like、GhGL1、GhMYC2、GhWD40 等调控纤维发育起始的关键因子相互作用而抑制棉纤维的起始[79]。因此认为JA 的代谢及信号途径可能主要在纤维起始阶段发挥作用。
脱落酸(Abscisic acid, ABA)含量在棉纤维体内有两次峰值, 在纤维发育起始阶段ABA 含量较高并在伸长期下降, 直至细胞脱水成熟阶段,ABA 再次积累。 在纤维发育过程中,短纤维材料的ABA 含量高于长纤维材料, 胚珠中的ABA 含量与短纤维的产量呈正相关, 短绒突变体Li1胚珠中的ABA 含量极高[80]。现有的试验证据暗示ABA 可能与纤维的起始和成熟有关。
综上,在棉纤维生长过程中,IAA、GA、ET、BR、JA 等激素可促进纤维细胞发育,ABA 则抑制棉花纤维的生长发育,棉纤维细胞分化发育的不同阶段皆受到多种激素的协调作用,相关研究结果为研究植物激素对棉花纤维细胞分化和发育的调控构建了基本框架[54]。随着分子生物学、基因组学、 棉纤维生理生化等研究的不断深入,不同植物激素间相互作用调控纤维细胞发育的作用机制将会越来越清晰。
5 非编码RNA 与表观修饰对棉花纤维发育的影响
越来越多的卫星RNA(microRNA,miRNA)被证明在植物发育过程中起关键的调节作用[81]。对野生型陆地棉和无纤维突变体的胚珠在纤维起始过程中的miRNA 组进行分析比较, 发现7个与纤维起始有关的miRNAs 在棉花胚珠中表达,这些miRNAs 参与了不同的细胞反应和代谢过程,包括转录调节、IAA 和GA 信号转导、肌动蛋白束和木质素生物合成等[82]。 深入的测序分析鉴定出78 个在纤维中表达的miRNAs[82]。 对Li-1和Li2突变体及其杂交群体进行测序, 发现20 个差异表达的miRNAs,其中4 个与纤维长度负相关[83]。抑制miR156/157 的表达,成熟纤维的长度会显著变短[84]。 过量表达miR319 可以通过抑制GhTCP4基因的表达而促进纤维伸长并得到长而细的优质纤维[22]。 在拟南芥gl1突变体中过量表达GhMYB2A而非GhMYB2D可以恢复该突变体表皮毛的发育。GhMYB2同源基因之间的功能差异由miR828 引导的反式作用RNA(trans-acting RNA,tasiRNA) 所介导,tasiRNA 调节了拟南芥的叶表皮毛发育,并可能调节棉花的纤维发育[85]。 种间杂交或多倍体化会使四倍体棉花长链非编码RNA(Long non-coding RNAs,lncRNA) 的转录本在基因组上重新排列, 而其DNA 甲基化水平也会发生变化。 种间杂交的DNA 甲基化动态主要与lncRNA 表达的急剧变化有关。 被激活的lncRNA 主要是从去甲基化的转座子区转录, 转座子的分布偏向于lncRNA 位点[86]。 棉花中已有超过35 000 个lncRNAs 被鉴定出来,富含重复序列,并以组织特异性方式优先表达[87]。 通过对Xu142 与其无纤维突变体Xu142fl的对比发现, 在35 000 多个lncRNAs 中,645 个在无纤维突变体Xu142fl中优先表达,651 个在Xu142 中优先表达。 通过VIGS 技术筛选出了3个负调控纤维起始的lncRNAs, 为lncRNA 在纤维发育中的潜在功能提供了证据[88]。
棉花三维基因组的建立表明活跃的染色质修饰及结构变化能够对基因的表达产生影响[89]。全基因组组蛋白修饰决定了异源多倍体棉花中At 和Dt 亚组同源基因的表达偏向, 为多倍体物种的进化和驯化提供了分子基础[90]。 组蛋白去乙酰化酶的活性对棉花纤维的正常起始至关重要。GhHAD5基因编码一个去乙酰化酶,在纤维起始期(-1 DPA 和0 DPA)显著高表达。 在GhHDA5的RNAi 株系中,GhHD1等纤维发育相关基因启动子区的H3K9 乙酰化水平上调,最终导致纤维起始受到抑制、长纤维数量减少[91]。 DNA 甲基化在纤维细胞分化和发育中具有潜在作用,体外培养胚珠时施加DNA 甲基化抑制剂可以显著地减少纤维数量、 缩短纤维长度[92]。 N6- 甲基腺苷(m6A)RNA 甲基化是最丰富和广泛的mRNA 修饰,在拟南芥中一个识别m6A 的ECT2 蛋白被鉴定为与表皮毛的分枝有关,ect2突变体表现为表皮毛分枝增多而畸形。 进一步的测序分析表明m6A 在TTG1等表皮毛发育相关的mRNA 上富集, 通过ECT2 的识别而增强了mRNA 的稳定性,使得表皮毛正常发育[93-94]。 棉花纤维的发育与拟南芥表皮毛的发育具有相似的途径,暗示m6A等RNA 表观修饰也可能参与棉纤维发育过程。
6 展望
棉花是我国重要的经济作物,也是“一带一路”倡议沿线国重要的农作物,是我国农业“走出去”战略的重要组成部分,这对棉花的品质提出了更高的要求。 棉纤维发育机理的研究对纤维品质改良和分子设计育种具有重要意义。
测序技术的发展使得棉属各物种的进化关系、基因组结构相继被揭示[53,95-96],对各栽培品种全基因组的重测序也发现了一系列纤维品质性状驯化的位点[57,59,73,97],极大地促进了棉纤维发育相关基因的鉴定以及基因区间内转录调控单元和活跃表达的转座元件的研究。 棉属拥有丰富的种质资源,基因组学仍是研究棉属植物基因的表达与调控以及功能演化最为有效的方法。 棉花的遗传转化受受体等因素的制约,是分子设计育种的一大障碍。 基因编辑技术的出现为棉花品质改良和基因功能研究提供了良好的工具[98]。 规律间隔成簇短回文重复序列(Clustered regularly interspaced short palindromic repeats,CRISPR)技术[99-100]的发展使基因编辑植物的获得解除了对受体的依赖,在基因靶点通过替换、增强子增强表达等技术[101],防止了无关外源基因的导入,为作物改良提供了新的方法。 新的生物技术在棉花遗传育种和基因功能研究上的应用将会大力推进对棉纤维发育分子机制的研究和棉花生物育种进程。

