陆地棉UDPGP 基因家族的鉴定及抗旱性分析
陈琴,李多露,赵杰银,高文举,陈全家,曲延英
(新疆农业大学农学院/ 教育部棉花工程研究中心/ 新疆作物遗传改良与种质创新重点实验室,乌鲁木齐 830052)
新疆是我国最大的植棉区,相较于国内其他棉区有着气候干燥、昼夜温差大、日照时间长等优势。 截至2020 年,新疆棉花种植面积和总产量已分别占全国的78.9%和87.3%[1]。 然而,水分蒸发量大、水资源匮乏,以及日益加重的土地盐碱化, 致使新疆植棉面积和纤维品质受到影响,严重制约了新疆棉花产业的健康发展[2]。 植物遭受到干旱胁迫时, 往往会发生细胞膜通透性增加、叶绿体减少、 体内活性氧积累量增加等现象,导致植物萎蔫、体内细胞代谢水平紊乱[3-4]。 在长期的干旱胁迫下,植物会改变自身形态结构和体内生理生化水平以更好地适应干旱环境。
蔗糖是植物光合作用的主要产物,是植物生长发育和产量形成中不可或缺的成分[5]。 尿苷二磷酸葡萄糖焦磷酸化酶(Uridine diphosphate glucose pyrophosphorylase, UDPGP) 作为蔗糖代谢过程中次级代谢产物尿苷二磷酸葡萄糖(Uridine diphosphate glucose,UDPG)合成的关键酶之一,在植物的生长、发育、养分储存、信号转导和适应环境胁迫中起着关键作用[6-8]。研究表明,一方面UDPGP 能够催化葡萄糖活化,将1- 磷酸葡萄糖转化为UDPG,再通过蔗糖磷酸合成酶合成6-磷酸蔗糖, 之后6-磷酸蔗糖在蔗糖磷酸酶的作用下合成蔗糖[9-10];另一方面,蔗糖能够在蔗糖合酶或转化酶作用下降解为UDPG,参与植物体内的糖代谢调控[11-12]。
UDPGP 参与代谢调控以及糖原、 淀粉和纤维素等物质的合成,在植物生长发育过程中发挥重要作用。 Flores-Diaz 等[13]研究表明,UDPGP基因的单点突变会导致细胞UDPG 缺乏;Meng 等[14]研究也显示UDPGP 不是蔗糖、 淀粉和细胞壁合成的限速酶, 但它在拟南芥中必不可少,UDPGP缺失的拟南芥突变体种子产量下降高达50%;Long 等[7]利用水稻突变体研究发现,编码UDPGP1的FLOURY ENDOSPERM 8 影响水稻胚乳中淀粉的合成;陈小敏等[15]证明小分子碳源和有机氮源能够提高香菇菌丝胞内UGP基因的转录,从而促进多糖含量的增加;Wang 等[16]发现转棉花UPGPG基因的拟南芥可溶性糖、 淀粉和纤维素含量增加,但木质素含量未增加,表明该基因参与了拟南芥糖代谢和细胞壁的生物合成。 Zhang等[17]预测UPGPG基因的过表达可能增加黄麻的纤维素含量。 UDPGP 也参与了植物对非生物胁迫的响应过程。 郭鑫[18]研究表明,兴安落叶松中的LgUGPase1和LgUGPase2基因主要参与植物生长发育中的代谢调控,对光、逆境胁迫和植物激素有一定的响应。 Deng 等[19]发现大丽轮枝菌(Verticillium dahliae)的UPGPG突变体对十二烷基硫酸钠和高浓度NaCl 敏感, 对棉花和烟草幼苗的毒力降低,突变孢子的萌发显著延迟。 但目前关于陆地棉 (Gossypium hirsutumL.)UPGPG基因的系统鉴定和抗旱相关研究尚未见报道。本研究基于本课题组蛋白双向电泳及质谱分析筛选结果[20],选择棉花抗旱相关的GhUDPGP基因,并对其基因家族进行生物信息学分析,旨在解析UDPGP基因家族在棉花中的进化和扩增, 以及在棉花干旱胁迫应答过程中的表达模式,为深入解析GhUDPGP基因在植物干旱胁迫响应过程中的功能和作用机理奠定基础。
1 材料与方法
1.1 试验材料及处理
本研究所用陆地棉耐旱品种KK1543 和干旱敏感品种新陆早26 号[21]均由新疆作物遗传改良与种质创新重点实验室保存。 采用1/2 Hoagland 营养液水培法将棉花幼苗培养至两叶一心, 用15%(质量分数) 聚乙醇(Polyethylene glycol,PEG)6000 模拟干旱胁迫, 分别于处理后0 h、1 h、3 h、6 h、12 h、24 h、48 h 和72 h 对棉花根、茎、叶进行取样,每个样品3 次生物学重复,置于液氮中冻存备用。
1.2 GhUDPGP 家族基因鉴定与蛋白理化性质分析
从CottonGen 数据库(https://www.cottongen.org/)中下载陆地棉基因组(ZJU,TM-1,2.1)和蛋白质组数据。借助UDPGP 蛋白结构域(PF01704)的隐马尔可夫模型, 基于Hmmsearch 搜索结果,通过本地Blast 获取陆地棉全基因组UDPGP 蛋白序列,进一步利用在线数据库CDD(http://www.ncbi.nlm.nih.gov/cdd)、Pfam(http://pfam.xfam.org/)和SMART(http://smart.embl-heidelberg.de/)鉴定含有完整UDPGP 结构域的蛋白。 利用ExPASy(http://cn.expasy.org/tools)在线工具和ProtComp Version 9.0 软件分析陆地棉UDPGP 蛋白的氨基酸残基数量、分子质量、理论等电点及亚细胞定位等。
1.3 进化树分析
利用MEGA 7 软件中的Clustal W 对陆地棉的UDPGP 蛋白序列进行多序列比对, 采用邻接法构建系统进化树,其中自展值(Bootstrap)设定为1 000[22],利用在线网站Evolview (https://evolgenius.info//evolview-v2/)对结果进行可视化展示。
1.4 染色体定位及基因结构分析
利用TBtools 软件提取GhUDPGP基因在染色体上的位置信息。 通过MEME 程序[23]对UDPGP家族成员进行基序分析(最大发现数设为15)。通过CottonGen 下载基因组注释文件,利用TBtools软件进行数据可视化处理。
1.5 顺式作用元件预测
通过TBtools 提取陆地棉UDPGP基因起始密码子上游2 000 bp 序列作为启动子区, 利用Plant CARE 数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测GhUDPGP基因启动子区可能存在的顺式作用元件。
1.6 RNA-seq 分析
从NCBI SAR 数据库(https://www.ncbi.nlm.nih.gov/sra)下载陆地棉不同器官(根、茎、叶、雌蕊、雄蕊、花萼、花瓣和花托)和干旱胁迫处理后的转录组数据 (基因组测序计划编号:PRJNA248163)。 对原始数据进行标准分析,得到表达量数据。 基于TPM(Transcripts per kilobase of exon model per million mapped reads)对表达量数据进行log2(TPM+1)标准化处理,并利用R 4.0.2 软件进行表达量热图的绘制。
1.7 基因表达分析
根据转录组分析结果, 利用Premier 5.0 和DNAMAN 软件设计GhUDPGP10和GhUDPGP26的特异性引物(表1),通过实时荧光定量聚合酶链式反应(Quantitative real-time polymerase chain reaction,qRT-PCR) 检测1.1 中各材料中2 个基因的表达情况。以GhUbq7基因作为内参基因,在ABI 7500 fast 实时荧光定量PCR 仪上进行qRT-PCR 分析。 反应体系为20.0 μL, 包括Eva Green2×qPCRMasterMix910.0 μL、ddH2O6.8 μL、正反向引物各0.6 μL、cDNA 模板2.0 μL。 PCR扩增条件为94 ℃30 s;94 ℃5 s;60 ℃30 s,40个循环后增加熔解曲线。 每个样品进行3 次重复, 采用2-ΔΔCt法进行基因表达量的相对定量分析。
表1 本研究中所用引物序列Table 1 Primer sequences used in this study
2 结果与分析
2.1 陆地棉UDPGP 基因的鉴定和分析
本研究在陆地棉基因组中共鉴定出31 个GhUDPGP基因。根据GhUDPGP基因在染色体上的位置依次命名为GhUDPGP01~GhUDPGP31。如表2 所示,经预测,UDPGP基因家族成员的开放阅读框 (Open reading frame, ORF) 长度为186~2 628 bp,UDPGP 蛋白质含有61~875 个氨基酸残基,其分子质量为6.88~96.66 ku,等电点为4.91~9.91。 31 个基因不均等地分布在18条染色体上, 其中A 亚组有12 个,D 亚组有19个。亚细胞定位预测显示,陆地棉中UDPGP 家族成员定位于细胞质或细胞间隙。
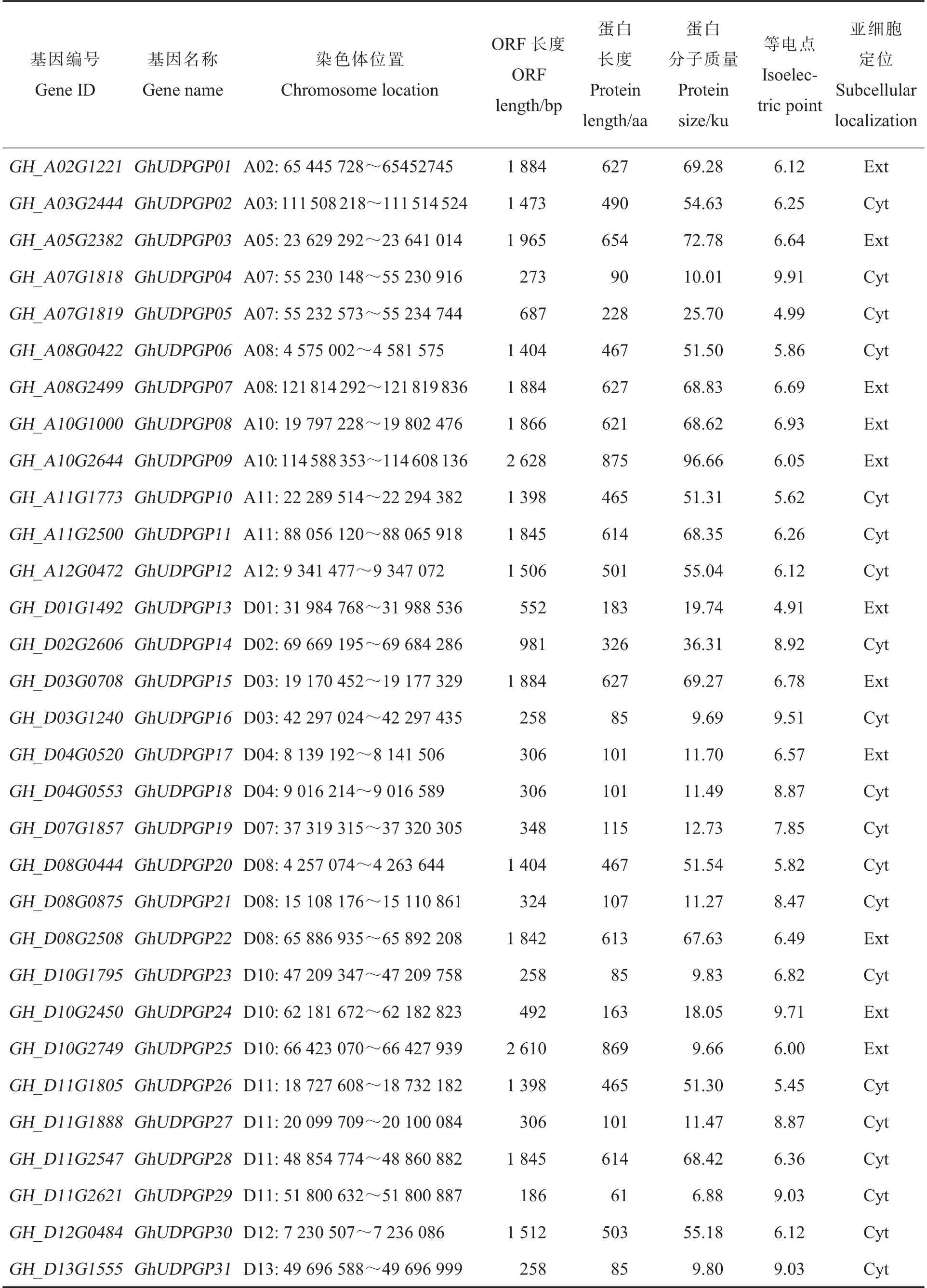
表2 陆地棉UDPGP 基因信息Table 2 Information of UDPGP genes in G. hirsutum
2.2 陆地棉UDPGP 蛋白的进化分析
陆地棉31 个UDPGP 蛋白的系统进化树(图1)显示,陆地棉UDPGP 蛋白可分为5 个亚族Ⅰ~Ⅴ, 其中A 亚组的8 个蛋白与D 亚组的同源蛋白(图1 中☆标记)分别聚在一起,这个结果也证实了约150 万年前棉属A 和D 亚基因组发生的多倍化事件[24]。 此外,来自D 亚组3 对蛋白(图1中△标记)间相似性为81%~99%,推测它们可能在长期的进化过程中发生了分化;还有9 个蛋白(图1 中○标记)没有发现同源蛋白,说明编码这些蛋白的基因可能在进化过程中发生了突变或者其同源基因丢失。
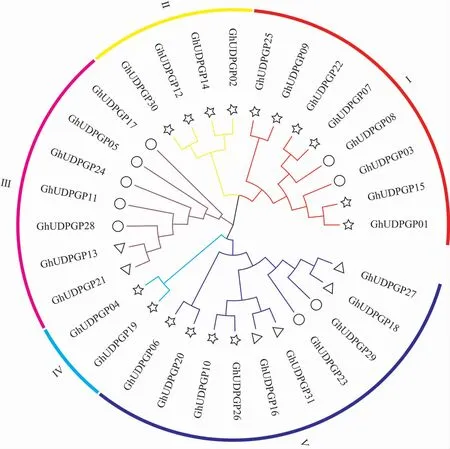
图1 陆地棉31 个UDPGP 蛋白的系统进化树Fig. 1 Phylogenetic tree of 31 UDPGP proteins from G. hirsutum
2.3 陆地棉UDPGP 基因的结构特征分析
利用MEME 分析UDPGP 蛋白保守基序发现,相同亚族的成员含有相同的基序(图2 A),第Ⅰ亚族的基序最多(15 个),而第Ⅳ亚族的2 个蛋白仅有2 个基序。 基因结构分析发现,该家族基因成员含有2~21 个外显子 (图2 B),其中GhUDPGP06、GhUDPGP10、GhUDPGP20和GhUDPGP26基因的外显子数目最多 (21 个),GhUDPGP18、GhUDPGP27和GhUDPGP29基因的外显子数目最少(2 个)。从基因长度来看,不同长度的基因具有相似的编码区序列, 说明UDPGP基因在进化过程中内含子长度存在较大的变异,可能导致其功能多样化。

图2 陆地棉UDPGP 蛋白保守基序(A)及基因结构(B)特征分析Fig. 2 Analysis of conserved motif (A) and gene structure (B) of UDPGP family in G. hirsutum
2.4 陆地棉UDPGP 家族基因的顺式作用元件分析
启动子区顺式作用元件预测发现,在陆地棉UDPGP家族基因启动子序列中,有19 个基因含有响应脱落酸的ABRE 元件、17 个基因含有响应赤霉素的GARE 元件、14 个基因含有响应水杨酸的TCA 顺式作用元件。 此外,还发现11 个基因含有响应生长素的TGA 元件、14 个基因含有响应干旱的MYB 结合位点、14 个基因包含响应茉莉酸甲酯的TGACG 元件。 这些发现暗示陆地棉UDPGP基因除参与植物生长代谢调控外,还与植物的逆境胁迫响应密切相关。
2.5 陆地棉UDPGP 家族基因表达分析
为明确UDPGP基因的组织表达特异性及其在干旱胁迫下的表达模式,基于转录组数据对31个GhUDPGP基因在棉花根、茎、叶、雌蕊、雄蕊、花萼、花瓣和花托及干旱胁迫处理后不同时间点的表达量进行聚类分析。 组织特异性表达分析显示(图3A),正常生长条件下,不同GhUDPGP基因呈现不同的表达模式, 其中GhUDPGP10和GhUDPGP26基因在陆地棉各个器官中均存在不同程度高表达,其余基因则呈现低表达甚至不表达趋势,暗示GhUDPGP10和GhUDPGP26基因可能在陆地棉生长发育过程中扮演重要角色。 同时, 分析干旱胁迫处理下UDPGP基因在棉花根部的表达情况,发现GhUDPGP10和GhUDPGP26基因在受干旱胁迫时上调表达且表达量较高(图3B), 推测GhUDPGP10和GhUDPGP26基因可能参与了棉花干旱胁迫响应过程。
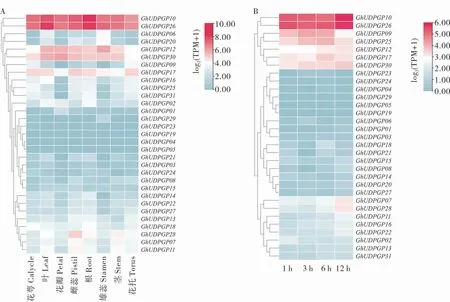
图3 陆地棉UDPGP 基因的表达分析Fig. 3 Expression analysis of UDPGP genes in G. hirsutum
为进一步研究GhUDPGP10和GhUDPGP26基因的功能,对抗旱棉花品种KK1543 和干旱敏感型品种新陆早26 号分别进行了干旱胁迫处理。 利用qRT-PCR 分析发现,抗旱材料KK1543经干旱处理后12 h,GhUDPGP10基因在根中显著高表达,在叶和茎中表达量相对较低(图4A);干旱敏感型材料新陆早26 经干旱胁迫后48 h,GhUDPGP10基因在叶中较高水平表达, 在根和茎中表达相对较低(图4C)。 总体上,GhUDPGP26基因也表现出在抗旱材料根中高表达(图4B),在干旱敏感型品种叶中高表达的模式(图4D),推测GhUDPGP10和GhUDPGP26基因在陆地棉不同部位发挥作用,可能通过不同的调控通路参与棉花抗旱响应过程。
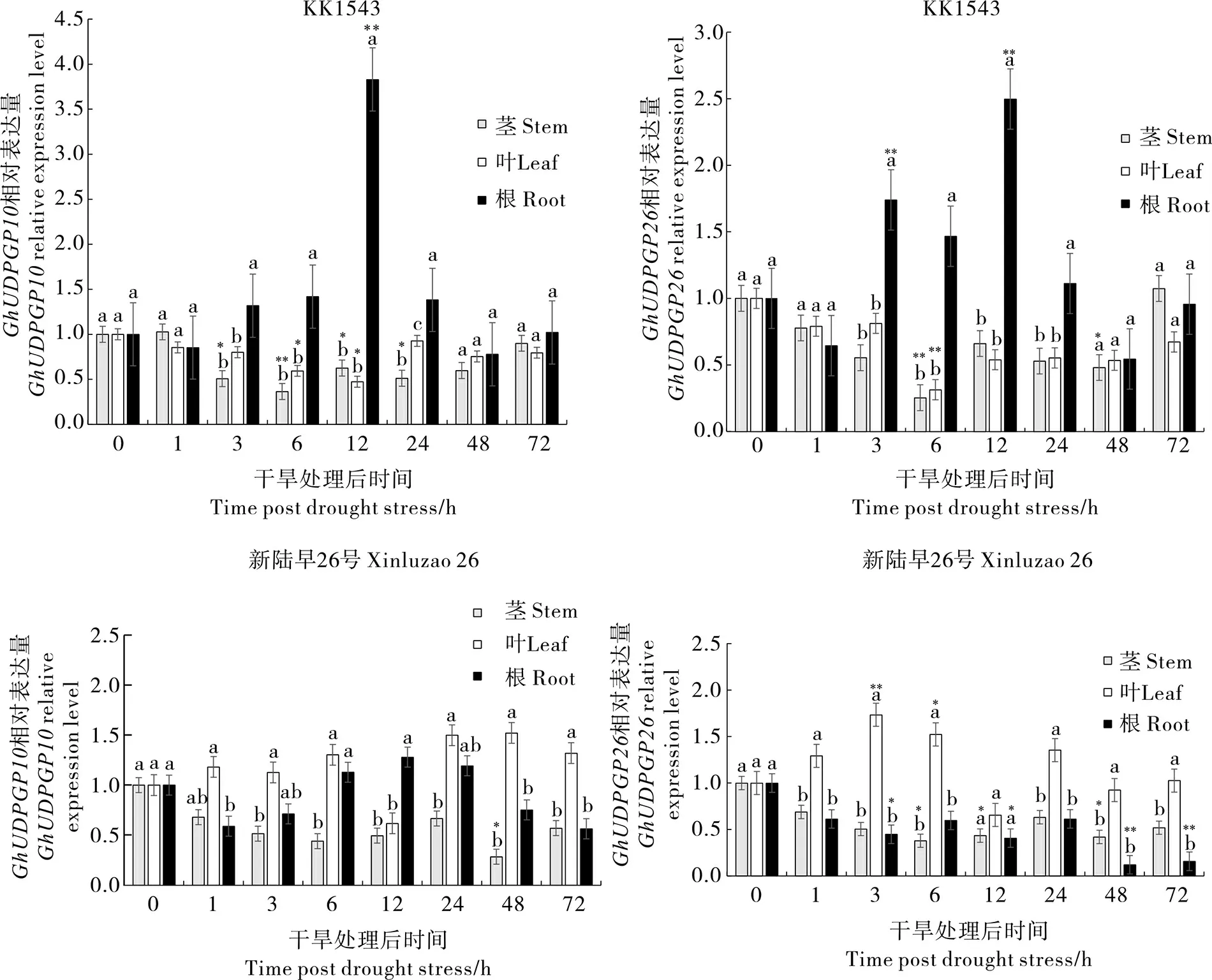
图4 干旱胁迫下不同材料中GhUDPGP10 和GhUDPGP26 的表达分析Fig. 4 Expression analysis of GhUDPGP10 and GhUDPGP26 under drought stress in different cotton materials
3 讨论
亚细胞定位预测显示,陆地棉GhUDPGP 家族蛋白位于细胞质或者细胞间隙, 这与贺望兴等[25]、Muchut 等[26]的研究结果一致。 组织特异性表达分析显示,31 个GhUDPGP基因在陆地棉根、茎、叶、雌蕊、雄蕊、花萼、花瓣和花托中呈现不同的表达模式, 表明UDPGP 作为植物体内蔗糖代谢途径中的关键酶,在植物不同部位发挥着不 同 的 作 用。 Park 等[27]将atugp1/atugp2双 突 变后,花粉发育异常,导致雄性不育。 Chivasa 等[28]明确UGP1 是一种新型植物细胞死亡调节剂。Yi等[29]发现Ugp1 在酿酒酵母中可以调节各种碳水化合物的含量,进而影响蛋白激酶活性,从而参与氧化应激反应,维持菌体长期存活。吕楠等[30]研究表明, 铁皮石斛中DoUGPase1基因的表达水平与植株体内多糖物质的积累成正比,可促进植物的生长发育。
陆地棉UDPGP家族基因启动子区含有多个逆境响应调控元件,推测GhUDPGP基因在植物抵抗逆境胁迫的过程中也发挥重要作用。 自然光条件下,拟南芥受到冷胁迫和蔗糖处理,AtUGPase基因呈现明显的上调表达趋势[31]。 拟南芥中UGPase基因的表达能够维持植物体内营养状态的稳定,增强其对盐胁迫的耐受性[32]。在受到干旱胁迫和盐胁迫时, 青杄USP1基因通过增强植物的活性氧清除能力及抑制膜脂氧化损伤来提高植物对非生物胁迫的耐受性[33]。 胡杨中UGP1/UGP2基因的协同作用有助于促进胡杨的生长发育及提高对盐胁迫的耐受能力[34]。最近,Liu 等[35]从76 个物种中鉴定了454 个UDPGP 蛋白,并通过表达谱数据分析发现, 水稻UDPGP基因受茉莉酸、脱落酸、镉和冷胁迫诱导。 以上研究均暗示UDPGP 可能在植物发育和逆境响应中起重要作用。
本研究分析了GhUDPGP10和GhUDPGP26基因在干旱胁迫条件下的表达特性, 发现GhUDPGP10和GhUDPGP26基因在不同抗旱性棉花材料间的表达存在差异。 在15%PEG 6000胁迫处理条件下,GhUDPGP10基因主要在抗旱棉花材料的根中高表达,显著高于其在茎和叶中的表达(干旱处理后3~24 h),但是在干旱敏感材料中叶中表达量较高;GhUDPGP26基因在抗旱材料的根部高表达,在干旱敏感型材料的叶片中表达上调,推测GhUDPGP10基因作为关键基因在棉花根部发挥重要作用,而GhUDPGP26基因在棉花叶片和根部均能发挥一定的功能,UDPGP基因可能通过不同的途径参与了陆地棉对逆境胁迫的响应, 但GhUDPGP10和GhUDPGP26基因在棉花干旱胁迫响应中的功能和作用机理仍需进一步研究。
4 结论
本研究通过基因家族分析,在陆地棉中鉴定出31 个具有UGPDP 保守结构域的家族成员,系统进化分析将其分为5 个亚族。 启动子区顺式作用元件预测发现, 该家族基因含有响应脱落酸、赤霉素、水杨酸等的顺式作用元件,暗示该家族基因在干旱胁迫应答过程中发挥作用。 RNA-seq和表达分析表明,GhUDPGP10和GhUDPGP26可能作为主要基因参与棉花干旱胁迫响应。 本研究为进一步解析棉花UDPGP基因的抗旱机理奠定基础,为进一步提高棉花的逆境适应性提供了潜在的基因资源。

