基于改进的荧光原位杂交技术定位B 型烟粉虱内共生菌Portiera 和Wolbachia
卢珍华,闫晓会,马亚杰,单永潘,宋贤鹏,刘青梅,王丹,胡红岩*,马艳*
(1.中国农业科学院棉花研究所/ 棉花生物学国家重点实验室,河南 安阳 455000;2.安阳县农业农村局,河南 安阳 455000)
内共生菌是生活在昆虫体内与宿主协同进化的一类共生微生物, 几乎存在于所有昆虫体内。 昆虫内共生菌分为初生共生菌和次生共生菌。 初生共生菌为宿主生长发育所必需的细菌,能为宿主提供营养物质,比如一些氨基酸、类胡萝卜素等,而这些物质是宿主无法通过取食补充的,特别是在宿主生长发育的早期阶段。 共生菌在宿主体内的分布多种多样, 除生殖细胞外,在其他组织中也有分布。 在长期的协同进化过程中,共生菌与宿主形成了互利共生的关系,以多种方式影响宿主生命活动,如参与宿主的营养代谢[1],提高宿主的耐热性及适应性[2],增强宿主对病毒的防御能力[3-4],调节宿主的抗药性[5-6],调控宿主生殖生长[7]等。
烟粉虱Bemisia tabaci属于半翅目Hemiptera粉虱科Aleyrodidae 小粉虱属Bemisia,能够直接取食寄主植物、传播多种植物病毒,给多种作物造成严重的经济损失,特别是对棉花、蔬菜等作物[8]。 烟粉虱寄主范围广泛,在行为、危害习性和传毒能力等方面又分化为多种生物型,再加上化学农药的大量使用, 使烟粉虱的抗药性不断增强,防治十分困难[9]。烟粉虱有30 多个隐种,不同隐种之间共生菌组成存在很大差异,所有烟粉虱种群均含有初生共生菌CandidatusPortiera aleyrodidarum,除此之外,烟粉虱中还含有多种次 生 共 生 菌, 如Hamiltonella、Arsenophonus、Cardinium、Rickettsia、Hemipteriphilus、Wolbachia及Fritschea[10]等。 这些共生菌通常共存于昆虫特化的细胞——含菌细胞(Bacteriocyte),并通过卵巢传递给下一代。Wolbachia作为分布最广的次生菌,能够在宿主中产生胞质不亲和、孤雌生殖、雌性化以及杀雄等多种生殖调控作用[11]。 Li 等[12]研究了Wolbachia在不同烟粉虱种群中的感染情况,认为Wolbachia可能在B 型和Q 型烟粉虱种群扩张及入侵过程中发挥重要作用。
荧光原位杂交(Florescencein situhybridization,FISH)是利用碱基互补配对的原则将荧光探针与组织中靶标序列结合,对序列进行定位、定性或定量分析的一项技术,可以实现对昆虫体内共生菌的定位[13]。Koga 等[14]建立了基于整虫染色的FISH 方法, 对豌豆蚜Acyrthosiphon pisum进行整虫染色后,成功观察到了初生共生菌Buchnera在蚜虫体内的分布。 随后,研究人员应用该技术对烟粉虱内共生菌的分布进行了定位分析。Caspi-Fluger 等[15]研究了Rickettsiasp.在烟粉虱体内的分布, 认为Rickettsia在烟粉虱中呈现分散型及限制型2 种分布模式, 在分散型模式中,Rickettsia在烟粉虱血腔中分布,而不存在于含菌细胞中, 在限制型模式中,Rickettsia仅在含菌细胞中分布。 Gottlieb 等[16]研究了其他共生菌在烟粉虱体内的分布, 结果表明次生共生菌Hamiltonella和Arsenophonus与初生共生菌Portiera共生于含菌细胞中, 而Wolbachia和Cardinium除在含菌细胞中分布外, 在其他组织内也有分布。Skaljac 等[17]的FISH 研究结果表明Wolbachia仅分布于含菌细胞中。 而Shi 等[18]研究认为Wolbachia在亚洲Ⅱ7 烟粉虱隐种个体中呈现2种分布模式,一种是仅在含菌细胞中分布,另一种是在含菌细胞和血腔中均有分布。 上述研究表明不同类型的共生菌在烟粉虱体内的分布不同,在自然感染Wolbachia的烟粉虱种群中, 初生共生菌Portiera的分布位置相对比较固定,而Wolbachia的分布模式存在很大差异。 基于FISH 技术的共生菌定位分析依赖于杂交探针发出的荧光信号,当共生菌的含量比较低时,FISH 探针荧光信号较弱[19],影响观察结果;另外,昆虫的几丁质、脂肪体或其他杂质与探针结合形成假阳性信号,也是影响FISH 结果的因素之一[20]。 因此,优化FISH 方法对提高共生菌定位分析的准确度具有重要意义。
共生菌在宿主体内的作用与它们在宿主体内的分布模式密切相关,研究其在宿主体内的分布,对揭示共生菌与宿主的共生机制具有重要意义。 基于显微注射技术的人工转染可以实现Wolbachia在不同宿主之间的水平转移,Zhong等[21]通过伪蛹注射技术将管氏肿腿蜂Scleroderma guani的Wolbachia wSguBJ 导入烟粉虱体内,首次实现了外源Wolbachia在烟粉虱中的转染,通过生物学杂交实验证实了外源Wolbachia在烟粉虱中能够引起宿主的胞质不亲和现象,但该外源Wolbachia在新宿主烟粉虱体内的分布尚不清楚。 本研究以人工转染Wolbachia的烟粉虱种群为研究对象, 采用FISH 方法对不同虫态烟粉虱中的共生菌进行染色, 以烟粉虱初生共生菌Portiera为对照,分析次生共生菌Wolbachia在新宿主烟粉虱中的分布。 同时,针对烟粉虱成虫腹部组织复杂、探针难以穿透组织内部造成染色效果不佳的问题, 本研究采用一种改进的FISH 方法,对成虫腹部解剖组织进行染色观察,对2 种内共生菌在烟粉虱中的分布进行分析, 拟为Wolbachia与烟粉虱的互作关系研究奠定基础。
1 材料与方法
1.1 试验材料
供试昆虫:以不携带Wolbachia的B 型烟粉虱种群为受体昆虫,在人工气候箱中饲养,条件为温度27 ℃±2 ℃, 相对湿度为60%~80%,光照14 h/黑暗10 h。Wolbachia感染的管氏肿腿蜂为供体昆虫,以黄粉虫Tenebrio molitor为寄主繁殖,饲养条件:25~28 ℃,相对湿度65%,全暗。
供试棉花品种中棉所49 由中国农业科学院棉花研究所提供。 用自配的基质在人工气候箱内培养棉花, 基质由营养土和蛭石以2∶1 的体积比配制而成, 定期添加营养液以促进棉花生长,待棉花长至5~6 片叶时供试。
1.2 人工转染Wolbachia 烟粉虱种群建立
参照Zhong 等[21]的方法从管氏肿腿蜂中提取Wolbachia, 将带有烟粉虱伪蛹的棉花叶片置于含5%(质量分数)琼脂的培养皿上,在体式显微镜下, 使用Nanolitre 2000 显微注射仪,将Wolbachia转入不携带Wolbachia的烟粉虱伪蛹,并置于人工气候箱培养。 伪蛹羽化后,对雌雄成虫进行配对, 交配产卵5 d 后, 对成虫进行Wolbachia分子检测, 舍弃未成功转染的烟粉虱及其后代,构建Wolbachia感染的烟粉虱种群。在转染后第5~6 代烟粉虱仍携带Wolbachia,对转染种群进行FISH 染色观察, 以未转染烟粉虱的伪蛹作为阴性对照。
1.3 探针的合成与试剂配制
探针合成:用于定位初生共生菌Portiera的探针序列为5'-Cy3-TGTCAGTGTCAGCCCAGAAG-3',定位Wolbachia的探针为Cy5 标记的W2 序列5'-Cy5-CTTCTGTGAGTACCGTCATTATC-3',均由生工生物工程(上海)股份有限公司合成。
试剂配制: 组织固定液由质量分数分别为99%、99.7%和99.5%的三氯甲烷、 无水乙醇和冰醋酸以6∶3∶1 的体积比配制而成,脱色液由无水乙醇和质量分数为30%的双氧水以4∶1 的体积比配制而成。 杂交缓冲液和洗脱缓冲液的配制参考周晓飞[22]的方法。 0.01 mol·L-1的磷酸盐缓冲液(Phosphate buffer saline,PBS,pH 7.2~7.6)、抗荧光猝灭封片剂和Kisser’s 封片剂购自上海生工生物工程技术服务有限公司。
1.4 样本收集与组织解剖
烟粉虱整虫样本收集:在光学显微镜下用昆虫针挑取叶片上的烟粉虱各阶段虫态,包括卵、1龄若虫、2 龄若虫、3 龄若虫和4 龄若虫 (伪蛹),用吸虫器分别吸取烟粉虱雌性成虫和雄性成虫。每个虫态各取20 头,置于2.0 mL 离心管中,1 管为1 次重复,共计3 次重复。
烟粉虱成虫腹部组织解剖:在体式显微镜下解剖烟粉虱卵巢。 首先,选择无菌载玻片,在中间位置滴加100 μL PBS 缓冲液, 将待解剖的雌性成虫放入缓冲液中;然后,用昆虫针固定住昆虫的胸部腹板,用解剖针剖开烟粉虱腹部,去除虫体残壳等杂物, 获得烟粉虱卵巢及含菌细胞样本,立即用组织固定液进行固定。 采用同样的方法获得雄虫腹部含菌细胞。
1.5 荧光原位杂交
1.5.1整虫样本FISH。参考Gottieb 等[16]的方法,并稍加改动(样品的脱色时间延长4 h):首先,将收集的样本放入1.5 mL 离心管中,加入1 mL 固定液,在4 ℃条件下固定24 h;用移液器吸出固定液后, 加入1 mL 脱色液冲洗虫体, 去除混合液后,再次加入1 mL 脱色液对样品脱色6 h;吸出脱色液, 加入1 mL 37 ℃预热的杂交缓冲液(20 mmol·L-1Tris-HCl,0.9 mmol·L-1NaCl,质量分数为0.01%的十二烷基硫酸钠, 体积分数为30%的甲酰胺)冲洗;去除杂交缓冲液,在黑暗环境下加入1 μL 含2 种探针(10 nmol·L-1)的杂交缓冲液, 在37 ℃水浴锅中杂交过夜; 杂交完成后,去除杂交缓冲液,用洗脱缓冲液洗脱2 次;洗脱完成后,去除洗脱缓冲液,用去离子水冲洗样本,将样本转移至载玻片。 封片:在样本上滴加抗荧光猝灭封片剂,并用Kisser’s 封片剂封片。
1.5.2组织解剖样本FISH。 采用改进的FISH 方法对样本进行染色,具体步骤如下:用无菌滤纸吸去载玻片上样本周围多余的PBS 缓冲液,并立即加入200 μL 昆虫组织固定液固定5 min;用移液器或滤纸吸除样本周围的PBS 缓冲液和固定液,再次加入200 μL 固定液固定30 min,其间不断加入固定液以避免载玻片干燥;去除固定液,用200 μL 蒸馏水清洗3 次,每次2 min;去除蒸馏水,并立即加入200 μL 脱色液,脱色10 min,重复此步骤3 次;脱色完成后,将载玻片放入37 ℃烘箱中干燥10 min 以固定组织样本;在载玻片中加入200 μL 未加探针的杂交缓冲液,预杂交10~20 min;去除杂交缓冲液,加入200 μL 含2 种探针 (10 nmol·L-1) 的杂交缓冲液, 载玻片置于杂交湿盒中于37 ℃水浴锅中杂交2 h;杂交完成后,去除杂交缓冲液,用48 ℃预热的洗脱缓冲液200 μL 洗脱5 min,吸去洗脱缓冲液,重复洗脱1 次,时间20 min;然后用200 μL蒸馏水冲洗样本去除洗脱缓冲液;在样本上滴加抗荧光猝灭封片剂,并用Kisser’s 封片剂封片。
1.6 荧光染色观察
将上述制好的样本在奥林巴斯FV 1000 激光共聚焦显微镜(奥林巴斯,日本)下观察,拍照后用FV10-ASW 看图软件进行分析。
2 结果与分析
2.1 2 种共生菌在烟粉虱卵中的定位
烟粉虱卵中共生菌Portiera和Wolbachia的定位结果(图1)显示,在所有被检测卵中均能检测出Portiera发出的红色荧光(图1A)和Wolbachia发出的蓝色荧光(图1B)。同时可以看出,Portiera集中分布于含菌细胞内,且与Wolbachia共生于含菌细胞内(图1C~D)。
2.2 2 种共生菌在烟粉虱若虫及伪蛹中的定位
从若虫、 伪蛹中2 种共生菌的定位结果来看, 转染Wolbachia的烟粉虱若虫和伪蛹体内均能检测出Portiera发出的红色荧光(图1E, I, M,Q)和Wolbachia发出的蓝色荧光(图1F, J, N,R),而在不携带Wolbachia的烟粉虱4 龄若虫(图1U~X) 中仅检测出Portiera发出的红色荧光,表明Wolbachia已经成功在烟粉虱中定植。从图1 可以看出,烟粉虱若虫和伪蛹腹部有1 对由含菌细胞组成的“肾状”含菌体,不同龄期的若虫含菌体内含菌细胞的数量和形态不同,与1 龄、2龄的若虫相比,3 龄若虫和4 龄若虫(伪蛹)含菌细胞的数量相对较多;Portiera和Wolbachia共生于这些含菌细胞中。

图1 不同虫态烟粉虱中内生菌Portiera(红色荧光)和Wolbachia(蓝色荧光)的FISH 结果Fig. 1 FISH of Portiera (red) and Wolbachia (blue) at different developmental stages of Bemisia tabaci
2.3 2 种共生菌在烟粉虱成虫中的定位
图2 为2 种内共生菌Portiera和Wolbachia在烟粉虱雌性和雄性成虫中的定位结果。 昆虫共生菌是随卵进行传播的,因此在烟粉虱雌性成虫腹部能检测出Portiera发出的红色荧光 (图2A,D)及Wolbachia发出的蓝色荧光(图2B,E)。 雄性成虫中Portiera与Wolbachia共生于腹部的含菌细胞内(图2G~I)。在试验过程中发现,不同发育阶段的烟粉虱染色效果差异较大,一些发育较为成熟的烟粉虱雌虫,卵巢中的卵粒较多,腹部组织较为复杂,造成染色效果差,从图2 可以看出烟粉虱成虫腹部含有2 种共生菌,但难以辨明共生菌所在的具体位置。 雄性成虫中含菌细胞与其他组织交错重叠,整虫荧光原位杂交也难以达到理想的效果。
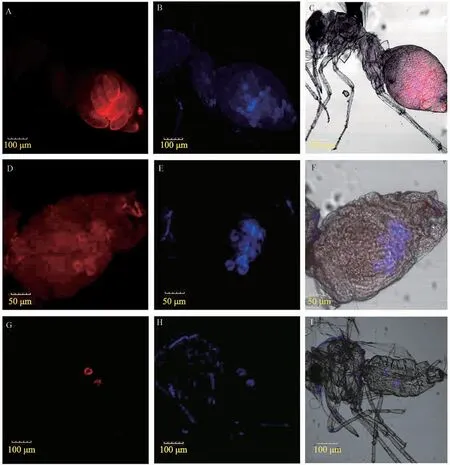
图2 烟粉虱成虫内生菌Portiera(红色荧光)和Wolbachia(蓝色荧光)的FISH 结果Fig. 2 FISH of Portiera (red) and Wolbachia (blue) in different female and male adults of Bemisia tabaci
2.4 烟粉虱成虫腹部组织解剖观察
在光学显微镜下对成虫腹部进行解剖,在PBS 缓冲液中可以获得结构较完整的烟粉虱雌性成虫卵巢(图3A),在卵巢附近及卵子基部可以观察到大量呈暗黄色的球形含菌细胞。 在操作过程中,含菌细胞(图3B 红色箭头所示)与卵巢分离,一些接近成熟的卵(图3B 黑色箭头所示)也容易从卵巢上脱落。 雄性成虫多数内共生菌集中分布于含菌细胞中, 通过解剖获得1~3 个完整的含菌细胞(图3C 红色箭头所示)。
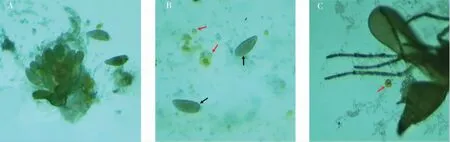
图3 烟粉虱成虫腹部解剖光学显微观察Fig. 3 Optical microscopic observation of abdominal anatomy of adult Bemisia tabaci
2.5 雌虫腹部组织荧光染色观察
在激光共聚焦显微镜下观察发现,经过一系列的染色,雌性成虫卵巢仍能保持相对完整的形态, 在卵巢内可以观察到Portiera发出的红色荧光及Wolbachia发出的蓝色荧光(图4A~B)。 同样,在含菌细胞中也可以清楚地观察到2 种荧光(图4C~D)。 另外,2 种荧光所在的位置重叠,表明Portiera和Wolbachia在烟粉虱雌性成虫腹部组织中的分布一致。
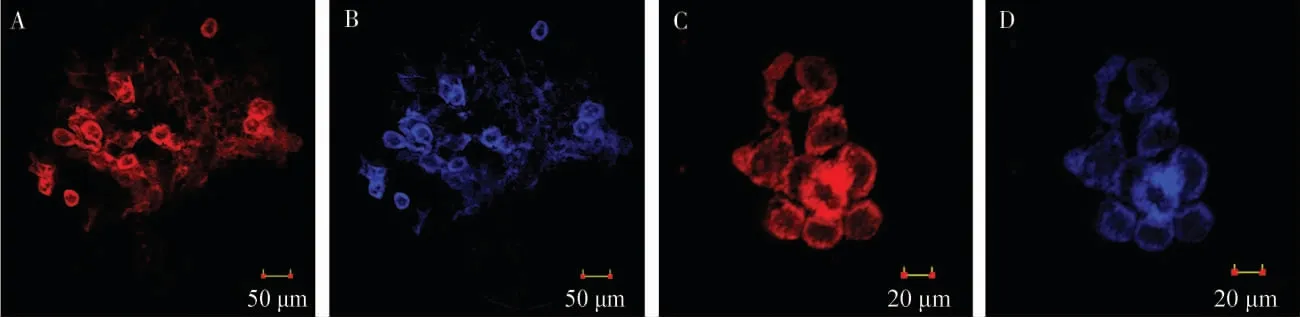
图4 在烟粉虱雌性成虫卵巢和含菌细胞中内共生菌Portiera(红色荧光)和Wolbachia(蓝色荧光)的FISH 结果Fig. 4 FISH of Portiera and Wolbachia in ovary and bacteriocyte of female adults of Bemisia tabaci
2.6 雄虫含菌细胞荧光染色观察
在激光共聚焦显微镜下观察雄虫含菌细胞染色结果,染色后样本中含菌细胞的形态变化不大,仍呈椭圆形。 无论是多个含菌细胞(图5A~B)还是单个含菌细胞(图5C~D)均可以清晰地观察到Portiera发出的红色荧光及Wolbachia发出的蓝色荧光,2 种荧光所在的位置重叠, 表明Portiera和Wolbachia在烟粉虱雄虫含菌细胞中的分布是一致的。
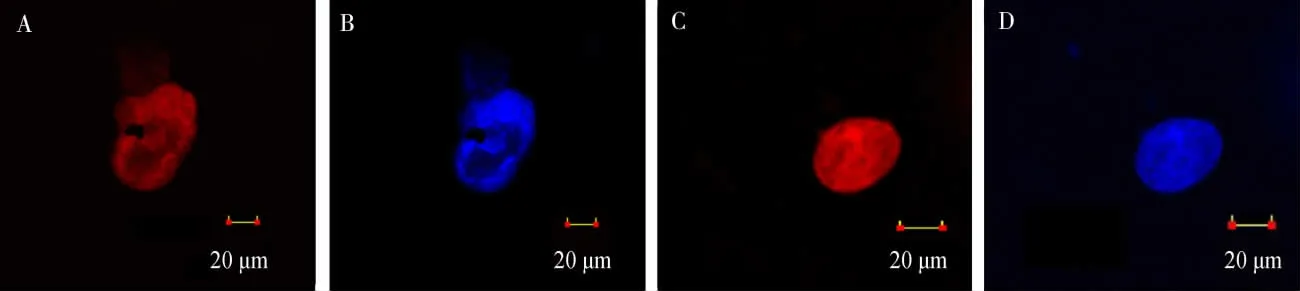
图5 在烟粉虱雄虫含菌细胞中内共生菌Portiera (红色荧光)和Wolbachia(蓝色荧光)的FISH 结果Fig. 5 FISH of Portiera (red) and Wolbachia (blue) in bacteriocyte of male adults of Bemisia tabaci
3 讨论与结论
Portiera是烟粉虱的初生共生菌, 能为烟粉虱提供生存所必需的营养物质。 本研究结果表明, 烟粉虱的初生共生菌Portiera集中分布于含菌细胞中。 这与陈吉强等[23]和Gottlieb 等[16]对烟粉虱中共生菌定位的研究结果一致。 另外,在卵巢发育的卵子中也有Portiera(图1A),表明Portiera可以通过卵进行传播。
次生共生菌Wolbachia广泛存在于节肢动物中,由于其能够引起宿主的胞质不亲和,而引起研究者的广泛关注,Wolbachia在宿主中的分布模式与其发挥的作用有很大关系。 朱路雨等[24]对Wolbachia在皮氏叶螨(Tetranychus piercei)体内的定位发现,Wolbachia在宿主卵母细胞中分布较均匀, 在中肠以及输卵管中也有分布。Skaljac 等[17]对克罗地亚B 型烟粉虱和Gottlieb等[16]对以色列甘薯中Q 型烟粉虱的研究发现Wolbachia主要分布于含菌细胞内。而Marubayashi等[19]研究发现Wolbachia在巴西B 型烟粉虱中有双重的定位模式: 一种是仅分布于含菌细胞内,属于限制型分布;另一种在含菌细胞和其他组织均有分布,属于分散型分布模式。 在一些烟粉虱隐种(如亚洲Ⅱ7 烟粉虱隐种)个体中,限制型分布的概率要显著高于分散型分布[18]。 上述研究结果表明Wolbachia在不同的烟粉虱隐种体内的分布存在差异,即使在同一隐种中的分布也不尽相同。 共生菌的限制型分布模式能很好地解释共生菌呈严格的母系遗传,分散型分布模式的发现引起了人们对共生菌水平传播的广泛关注[15]。本研究对外源Wolbachia在B 型烟粉虱中的分布进行了定位研究, 结果显示Wolbachia分布于含菌细胞内, 还存在于雌性个体的卵巢内, 表明Wolbachia可以随宿主产卵而传播。
FISH 技术的优点在于操作简单、反应灵敏、无非特异性染色,是昆虫共生菌定位研究常用的染色技术。 本研究利用该项技术对烟粉虱不同发育阶段的卵、若虫及成虫的荧光染色观察结果表明, 利用整虫进行FISH 染色能够清晰地观察到2 种共生菌在烟粉虱卵和若虫中的分布位置,而对成虫的染色效果不理想,这可能是由于成虫腹部组织复杂,探针难以穿透造成的。 对这类昆虫组织进行冷冻或石蜡切片后再进行FISH, 是一种可行的染色方法[14,24],但操作比较繁琐,染色过程耗时较长。 本研究提供了一种适合烟粉虱组织内共生菌荧光染色的方法和流程,利用该方法在烟粉虱卵巢和含菌细胞中检测到较强的Portiera和Wolbachia荧光信号。 使用该方法对昆虫组织染色具有以下几个优点:首先,荧光染色前只需在显微镜下解剖昆虫,获得卵巢组织后在载玻片上可直接进行FISH 染色, 整个过程无需冷冻和切片,操作简便,可将所需时间压缩至几小时,极大缩短操作时间;其次,该方法是在载玻片上对昆虫组织进行染色, 固定脱色处理结束后,经37 ℃短时间烘干即可将组织样本固定在载玻片上, 在后续操作过程中未见样品脱落的情况,避免了冷冻切片容易脱片的问题。
了解共生菌在烟粉虱体内的分布以及在宿主不同发育阶段的变化,是研究共生菌与宿主互作的基础。 本研究以Wolbachia感染的烟粉虱种群为研究对象,对不同发育阶段的烟粉虱整虫及成虫解剖组织样本进行了FISH, 明确了外源Wolbachia在烟粉虱宿主中的分布情况, 为进一步研究Wolbachia与烟粉虱互作打下基础。同时,本研究优化得到操作相对简单的烟粉虱组织荧光染色方法,可为其他昆虫组织中共生菌的分布及定位观察提供借鉴。

