新疆石河子及周边地区棉花根际土壤丛枝菌根真菌多样性
陈凯丽,田秋恒,刘志洋,王海,熊杰,雷勇辉,孙燕飞
(石河子大学,新疆 石河子 832003)
新疆维吾尔自治区北疆地区属温带大陆性气候。 其盐碱地面积广阔,被称为世界盐渍土的博物馆。 盐分引起渗透和离子胁迫,抑制气体交换和光合作用,最终损害植物的生长和发育[1]。大部分重度盐碱化土地长期无法利用,严重制约着新疆农业的发展。而棉花(Gossypium)具有较强的耐盐性,是新疆盐碱地上种植最多的经济作物。
丛枝菌根是陆地生态系统中普遍存在的植物根系与丛枝菌根真菌 (Arbuscular mycorrhizal fungi,AMF)的共生体。 AMF 能将它们的网状菌丝延伸到根系外更广阔的位置,从而扩大宿主植物的根系与土壤的接触面积,形成一个大型的功能性有机体。 AMF 的菌丝网络不仅能提供比根毛更大的吸收表面积,而且有助于植物吸收土壤中的矿质营养元素,尤其是磷[2]。 研究发现,当AMF 与棉花共生时, 棉花中磷酸转运蛋白家族基因的表达水平和磷含量显著提高。 AMF 的定植可显著促进棉花生长,提高棉花产量和纤维质量[3]。Chen 等[4]研究发现AMF 能使宿主植物获得耐盐性,减轻盐胁迫下植物的氧化损伤。 Hadian-Deljou 等[5]研究发现AMF 定植后的酸橙幼苗具有更好的渗透物质积累和抗氧化防御系统反应。Zhang 等[6]研究发现AMF 定植棉花根际可明显抑制黄萎病的发生。 Jiang 等[7]发现施用AMF 能显著促进棉花根系生长,增强根系对滴灌杀虫剂的吸收, 在减少杀虫剂施用量和残留量的同时,保持对棉花蚜虫的防控效果。 值得注意的是,土著AMF 能够促进棉花的生长并提高耐盐能力[8],探究与挖掘AMF 资源有利于提高棉花抗逆性以应对盐碱环境。
本研究以新疆棉花根际土壤为研究对象,对新疆棉花根系AMF 侵染情况进行调查研究,并从根际土壤中分离AMF 孢子, 通过形态学特征和巢式聚合酶链式反应(Polymerase chain reaction,PCR)分子鉴定对新疆棉花AMF 进行种类鉴定,探明与新疆棉花共生的AMF 种类及多样性,为AMF 种质资源在新疆棉花上的应用提供依据。
1 材料与方法
1.1 样本采集
1.1.1土样的采集。2019 年9 月至10 月,在棉花结铃吐絮期, 从新疆维吾尔自治区3 个市/ 县5个镇(表1)采集棉花根际土壤。 按照镇的分布区域进行采样,每个镇确定10 个采样点,采样点间隔约为2 km,每个采样点均采用五点随机取样法采集土壤并混匀,共采集50 份土样。 其中,由于棉田分布所限,钟家庄镇为8 个采样点和十一连2 个采样点(同属于144 团)。取样时,去除杂草和表层土壤, 采集10~20 cm 土层距棉花主根数毫米范围内的土壤(称为根际土),每份土样采集2 kg,阴凉风干后过筛,保存备用。

表1 采样地信息Table 1 Information on sampling sites
1.1.2根样采集及处理。 采样时,随机采集一定数量带有根尖的棉花侧根及须根, 剪成2~3 cm小段, 清洗后放入甲醛- 乙酸- 乙醇(Formaldehydeacetic acid-ethanol fixative, FAA) 固定液中置于室温保存1 d 以上。 每个土样采集点取3 个根段,共计150 个根段。
1.2 分离鉴定
1.2.1根样染色。 为观察新疆棉花根系丛枝菌根侵染状况, 采用碱解离-曲利苯蓝染色法对棉花根系染色。 方法: 取出FAA 固定液中固定的根段,用蒸馏水冲洗3~5 次;剪成1.0~1.5 cm 小段,在10%(质量分数,下同)KOH 中90 ℃水浴20 min 进行根段透明处理, 用蒸馏水冲洗3~5次;在10%H2O2中脱色3 h 20 min,用蒸馏水冲洗3~5 次;用2%盐酸于室温酸化20 min,再用0.05%曲利苯蓝染剂于90 ℃水浴染色20 min,蒸馏水冲洗3~5 次;置于乳酸甘油溶液中脱色1 h。 取 出 根 段, 用 聚 乙 烯 醇- 乳 酸- 甘 油(Polyvinyl alcohol-lactate glycerol,PVLG)制片。置于Olympus(CX21)光学显微镜下观察每条根段的侵染情况,分级记录为0、10%、20%…,满级为100%,即该条根段全部被侵染[9]。 观察并记录根段各种菌根结构的侵染情况并计算侵染率(rI)。

式中,i为根段侵染等级(0,10%,…,100%),N为总根段数,Ni为i级根段数。
1.2.2丛枝菌根真菌的分离鉴定。称取50 g 风干土样, 采用湿筛倾析- 蔗糖离心的方法筛选出AMF 孢子。 在Nikon(SMZ800N)体式显微镜下挑取形态相对完整的成熟孢子, 在Olympus(CX21)光学显微镜下(400 倍)观察其颜色、形状、大小、连孢菌丝,孢子壁的层数、类型和厚度,以及在Melzer’s 试剂下的颜色变化等特征。根据国际AMF 保藏中心(http://invam.wvu.edu)和波兰农业大学(http://www.zor.zut.edu.pl/Glomeromycota)等网站的描述,并参考近年来发表的中国新记录种进行形态学鉴定。
1.2.3物种多样性分析。 按上述孢子筛选分离方法,根据刘润进[9]的方法进行AMF 多样性各指标(表2)的测定和计算,每份土样重复3 次。

表2 评价丛枝菌根真菌群落结构多样性的生态学参数Table 2 Ecological parameters of diversity for evaluating AMF community structure
1.2.4丛枝菌根真菌单孢DNA 分子鉴定。 利用湿筛倾析-蔗糖离心法从棉花根际土壤中筛选出27 个形态各不相同的AMF 孢子,进行PCR 分子鉴定。 将PCR 产物纯化回收后进行测序。 单孢DNA 的提取参考龙良鲲等[10]的方法,在体视镜下把湿筛倾析- 蔗糖离心后的单个AMF 孢子吸取出来, 用无菌水漂洗5 次, 放入盛有10 μL TE(Tris+EDTA)缓冲液的1.5 mL 离心管中,其中TE 含有20%Chelex 100 sodium(Solarbio),然后用无菌枪头把孢子充分捣碎, 沸水浴10 min,再置于冰上3~5 min,10 000 r·min-1下离心2 min,吸取上清液到新的离心管中即可。 提取的DNA于-20 ℃条件下保存备用。
目标DNA 片段的巢式PCR 扩增,引物序列详见表3。 用上述提取的AMF 单孢DNA 进行第1 次PCR 扩增, 反应体系如下:10×PCR 缓冲液2 μL,0.1 mmol·L-1(终浓度)dNTPs,5 U·μL-1TaqDNA 聚合酶0.1 μL,10 μmol·L-1的NS1 和NS4 引物各1 μL,DNA 模板1 μL(质量浓度10 mg·L-1),补双蒸水ddH2O 至20 μL。 反应程序为94 ℃预变性3 min,94 ℃变性30 s,40 ℃退火1 min,72 ℃延伸1 min,共30 个循环,72 ℃延伸10 min。

表3 巢式PCR 所用AMF 引物Table 3 Arbuscular mycorrhizal fungi primers used for nested PCR
第2 次PCR 扩增时, 将第1 次PCR 产物稀释100 倍后作为模板(稀释倍数可根据条带亮度大小做出调整, 下同), 引物替换为AML1 和AML2,反应体系同第1 次。 反应程序为94 ℃预变性3 min,94 ℃变性1 min,50 ℃退火1 min,72 ℃延伸1 min,共30 个循环,72 ℃延伸10 min。
第3 次PCR 扩增时, 将第2 次PCR 产物稀释100 倍后作为模板,引物替换为AMV4.5NF 和AMDGR。 反 应 体 系 同 第1 次,AMV4.5NF 和AMDGR 引物各为0.8 μL,DNA 模板1 μL,补ddH2O 至20 μL。 反应程序为95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,一共30 个循环,72 ℃延伸10 min。 将PCR 产物进行测序 (生工生物工程公司), 所得序列与Maarj AM 数据库(https://maarjambo-tany.ut.ee/)数据进行比对。
2 结果与分析
2.1 棉花根系丛枝菌根真菌侵染结构
镜检棉花根段,可见清晰的菌丝、泡囊和孢子结构,大多数根段都有AMF 侵染情况,侵染率为11.2%,表明棉花根系确实存在丛枝菌根真菌的定植(图1)。

图1 棉花根系丛枝菌根真菌的菌丝(A)、重楼型丛枝结构(A)、泡囊(A)和孢子(B)Fig.1 Hyphae (A), paris-type arbuscule structure (A), vesicle (A) and spore (B) of cotton root AMF
2.2 棉花根际土壤丛枝菌根真菌多样性
所有AMF 物种收录于球囊菌门(Glomeromycota)下,本研究从50 份棉花根际土样中共分离出4 属6 种AMF 孢子(表4)。 包括:球囊霉 目(Glomerales)球 囊 霉 科(Glomaerceae)球 囊霉属(Glomus)3 种,分别为单孢球囊霉(G.monosporum)、明球囊霉(G.clarum)、卷曲球囊霉(G.convolutum);多样孢囊霉目(Diversisporales)无梗囊霉科 (Acaulosporaceae) 无 梗囊霉属(Acaulospora)1 种,为凹坑无梗囊霉(A.excavata);类球囊霉目(Paraglomerales)类球囊霉科(Paraglomeraceae)类球囊霉属(Paraglomus)1 种,为巴西类球囊霉(P.brasilianum);原囊霉目(Archaeosporales)双型囊霉科(Ambisporaceae)双型囊 霉 属(Ambispora)1 种, 为 薄 壁 双 型 囊 霉(A.leptoticha)(图2)。 其中,凹坑无梗囊霉为最常见种,单孢球囊霉、明球囊霉、薄壁双型囊霉为常见种,巴西类球囊霉为少见种,卷曲球囊霉为偶见种(表4)。
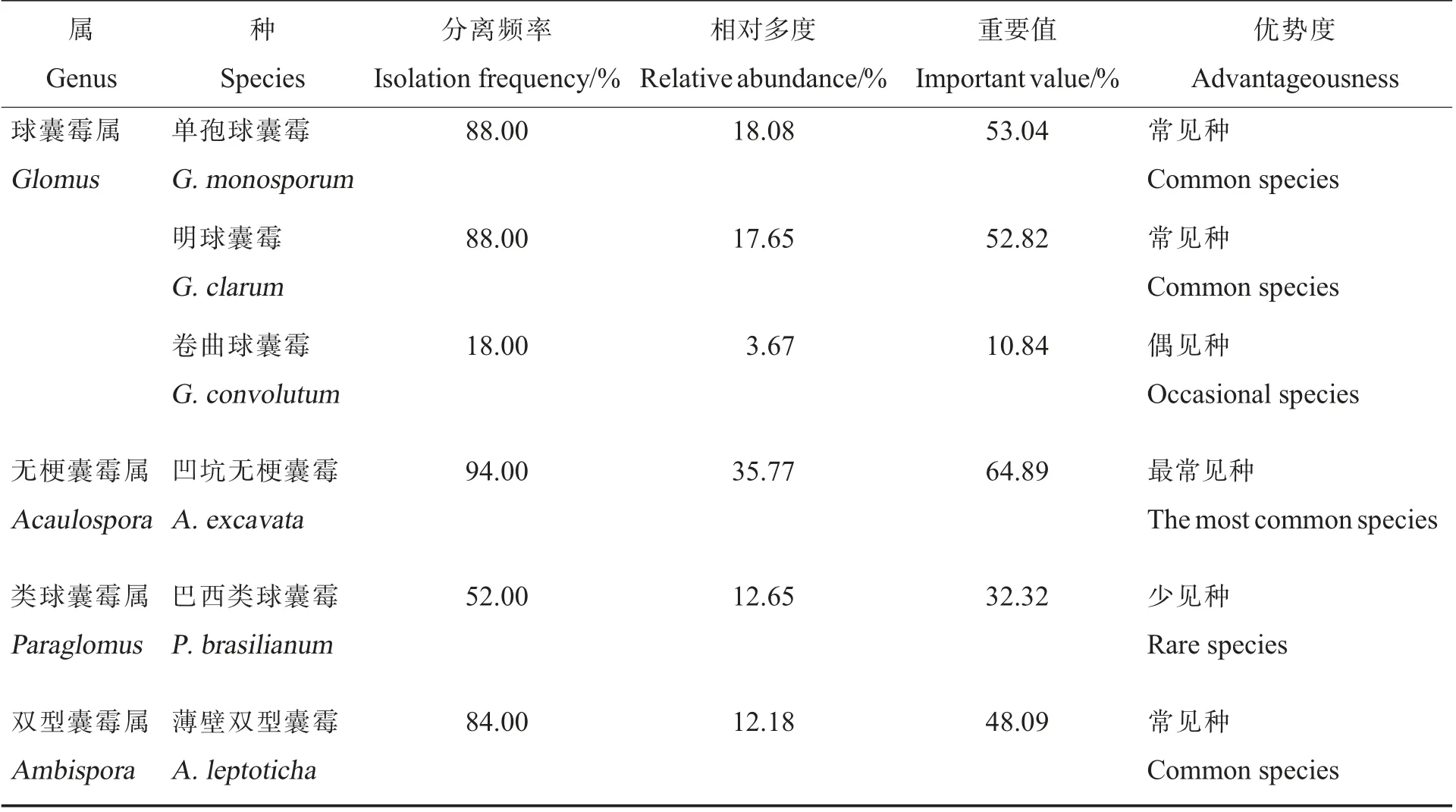
表4 新疆石河子及周边地区棉花根际土壤丛枝菌根真菌种类Table 4 AMF species in the cotton rhizosphere soil in Shihezi and surrounding areas in Xinjiang
单孢球囊霉孢子壁有2 层,L1 为透明的薄壁, 厚度为0.5~1.2 μm;L2 为黄棕色, 厚度为4~10 μm(图2A)。有些孢子L2 上还存在稀疏的小刺突,基部大小为0.5~2.0 μm,高1.2~3.6 μm。连孢菌丝沿孢子壁弯曲,基部为漏斗形,不缢缩。
明球囊霉也有2 层孢子壁,L1 厚度为5~20μm,透明至淡黄色;L2 为透明的膜状壁,厚度为1.0~1.5 μm(图2B~C)。 连孢菌丝单根呈漏斗形或圆柱形,有的表面形成一些多皱或多疣状突起。

图2 新疆石河子及周边地区棉花根际丛枝菌根真菌种类Fig. 2 AMF in the cotton rhizosphere soil in Shihezi and surrounding areas in Xinjiang
卷曲球囊霉孢子呈不规则形, 大小为2.5~7.0 μm,质地较硬且易碎(图2D)。 湿润时为浅橘色或橘黄色,孢子被紧紧裹在大小为15~35 μm的菌丝套中。 内含物为小油滴。
凹坑无梗囊霉孢子呈圆形或近圆形且为浅黄棕色,大小为120~165 μm。 孢子壁1 层,萌发壁2 层,均为无色透明。 在Melzer’s 试剂中反应并呈现红色(图2E~F),表面有圆形或近圆形大凹坑状纹。
巴西类球囊霉孢子为透明至浅灰色,球形或近球形,大小为70~130 μm(图2G~H)。 它有3层孢子壁:L1 为无色透明的易逝壁,厚度为0.5~1.5 μm, 常在孢子成熟时消解或者脱落;L2 为无色透明至浅灰色,厚度为1.0~1.5 μm,在Melzer’s试剂中反应并呈深黄色(图2H);L3 为层状壁,透明且厚度为1.0~2.5 μm。 表面常附有土壤碎片或微粒。
薄壁双型囊霉孢子的形态学分类鉴定待进一步完善(http://fungi.invam.wvu.edu),孢子为圆形或近圆形,黄棕色,孢子壁1 层,连孢菌丝呈圆柱状,表面有凸起纹(图2I)。
依据6 个地区AMF 群落结构多样性的生态学参数统计分析结果(表5),总体而言,多个样本间生态学差异较小。 同一地区不同样本间孢子密度有一定波动性,而柳毛湾镇和钟家庄镇的种类组成和结构相似。

表5 新疆石河子及周边地区棉花根际土壤丛枝菌根真菌多样性Table 5 Diversity of AMF in the cotton rhizosphere soil in Shihezi and surrounding areas in Xinjiang
依据巢式PCR 结果,挑取的27 个AMF孢子归为4 个属,分别是类球囊霉属(Paraglomus)、球囊霉属(Glomus)、双型囊霉属(Ambispora)和盾巨孢囊霉属(Scutellospora)。 其中:类球囊霉属的22 个孢子归类为3 个虚拟种 (Virtual taxa,VT)ParaglomusVTX00444、ParaglomusVTX00348、Paraglomussp. VTX00308, 孢子数占比分别是44.4%、14.8%和22.2%; 球囊霉属的1 个孢子归类为虚拟种Glomussp.VTX00154; 双型囊霉属的2 个孢子归类2 个虚拟种,分别是Ambisporasp. VTX00283 和Ambisporasp.VTX00242;盾巨孢囊霉属的2 个孢子未归类到种。 由此可知,这些地区棉花根际土壤中优势种为ParaglomusVTX00444,优势属为类球囊霉属。
3 讨论与结论
本研究在新疆棉花根系中观察到泡囊、菌丝和重楼型丛枝等结构, 说明AMF 能够侵染新疆棉花根系并能与棉花建立较好的共生关系。 但是与其他植物如甘蔗[13]、玉米[14]、柑橘[15]、胡杨[16]和骆驼刺[17]相比,侵染率并不高。这可能是由于棉花须根较少,且秋季采集的发育后期的棉花样本须根木质化较为严重不易观察。 此外,不同地理环境的海拔、土壤理化性质、温度、季节及土地管理方式等均会导致AMF 多样性的差异[18-19],不同种属的AMF 对不同宿主植物的侵染也存在一定差异性[20]。 现在已有利用AMF 菌剂提高植物生长和抗逆性的报道,如毛树春等[21]研究发现,对棉花接种地表球囊霉菌剂侵染率最高可达79.1%。因此,通过接种AMF 提高新疆棉花产量、品质、移栽苗成活率等具有广阔的前景。
本研究中形态学鉴定和分子鉴定均分出4属6 种AMF 孢子,二者结果相似,但种属分类存在一定差异。 巴西类球囊霉在形态学鉴定中的相对多度明显低于凹坑无梗囊霉,初步判定为少见种,而在分子鉴定中占比升高。 这可能是因为分子鉴定时挑取AMF 孢子时受主观因素影响,选取巴西类球囊霉孢子略多。
经形态学鉴定可以快速、高效地观察出不同样品中AMF 的种类与数量差异。但是,同一物种孢子在不同生长发育时期个体存在结构差异,比如厚皮双型囊霉(A.callosa)最外层孢子壁会随着时间推移而脱落,有的种属间孢子壁层数差异不明显,增加了形态学鉴定的难度。国际AMF 保藏中心记录16 属82 种AMF, 而截至2011 年,我国已发现10 个属131 种AMF[22]。由此可见,有一些AMF 物种未被鉴定归类。对比之下,分子水平鉴定准确度和可靠性较高。 Maarj AM 数据库以孢子种的核糖体小亚基rDNA 序列为参考,将分子水平的鉴定结果归类至属甚至种的水平,称之为虚拟种[23]。 本研究通过测序及序列比对将AMF 分为4 个属,6 个虚拟种。序列比对时,部分样本序列与已知序列的相似性未达到97%及以上。可见,还有一些AMF 物种序列没有被纳入该数据库,也可能存在未知物种未被鉴定。 设计出能覆盖大多数AMF 的特异性引物是分子鉴定亟待解决的技术瓶颈[24],因为巢式PCR 扩增技术的关键在于特异性引物[25],常用的有AML1/AML2、AMV4.5NF/AMDGR、NS31/AM1,但每种引物对于不同属AMF 的覆盖率均有差异。 而且目前AMF 类群的鉴定也没有确定一致的DNA 条形码区域[26]。 此外,目前有关我国AMF 分子多样性数据的样本量不足,且存在不同生态系统、不同气候区域等的不平衡。 因此,要反映我国AMF分子多样性的整体状况,还需要进行大量研究[27]。从长远来看,采取形态学与分子技术相结合的办法进行AMF 群落研究有助于完善AMF 分类系统和增强AMF 研究的可持续性[28]。
综合两者鉴定结果,以分子鉴定为主,本研究区域的AMF 主要优势属为类球囊霉属,优势种为巴西类球囊霉。 在自然环境中,新疆棉花根系AMF 种质资源丰富。其中球囊霉属、无梗囊霉属、双型囊霉属和类球囊霉属的孢子种类和数量较多,与西伯利亚云杉[29]、沙蒿[30]的AMF 组成具有一定的相似性,说明这4 个属能适应不同的环境,具有适应性强、分布较广泛的特点。 AMF 的多样性受到环境因素影响,适应生境的菌种大量繁殖并随之成为优势种,相反则会被慢慢淘汰至消失[31]。 出现频度较高、重要值较高的AMF 物种可能是由于自身的生物学特性比较适应该生境,这是其与地理环境条件和宿主植物共同进化的结果。
完善植物丛枝菌根真菌的种质资源调查,对筛选高效菌种、开发菌根真菌资源并在农林业上的应用具有重要意义。 在生物利用技术上,可通过接种AMF, 提高植物的抗旱性和耐受盐碱胁迫能力,增强植物对氮、磷等元素的吸收能力[30]。本研究对新疆石河子及周边地区棉花根际AMF的侵染状况进行了调查, 并对根际AMF 种类进行了鉴定,确定了部分棉花根际AMF 种质资源,补充了新疆AMF 菌种资源, 可为丛枝菌根的研究与应用提供参考;在生产上,可为AMF 菌剂筛选提供基础数据,为新疆棉花菌根化育苗、栽培和丰产提供理论依据[22]。

