不同培养条件对林可链霉菌种子液代谢影响
白茹玉,石彥鹏,张 萍
(宁夏泰瑞制药股份有限公司,银川 750100)
林可霉素(Lincomycin)又称洁霉素,林可霉素属于林可糖胺类抗生素,最初于1962年由美国普强公司的D.J.manson等从美国尼布拉斯加州林肯市附近地区的土壤中分离得到的链霉菌属林可链霉菌林肯变种(StreptomycesLincolnensisvar.lincolnensis)发酵所产生的次级代谢产物[1]。林可霉素由4-丙基脯氨酸(PPL) 和ɑ-甲硫基林可酰胺(MTL) 通过缩合反应生成去甲基林可霉素,进一步甲基化而生成。主要用于冶疗革兰氏阳性菌引起的感染性疾病[2]。在兽药方面,林可霉素作为猪场的常用药物,主要用于革兰氏阳性菌(链球菌,葡萄球菌),对部分革兰氏阴性菌也有效果(预防大肠杆菌,密螺旋体,霉形体)[3],如霉形体引起的家禽慢性呼吸道病、猪喘气病、厌氧病等,也用于治疗猪密螺旋体痢疾、弓形体病和狗、猫的放线菌病。林可霉素生物合成及代谢调节机制是极为复杂交错的生理生化现象[4],目前许多企业进行工业化生产林可霉素,都是以好氧发酵为主进行提取[5]。目前国内对于林可霉素的工艺改良多数通常选用紫外线,快中子等物理诱变手段和硫酸二乙酯(DMS)、甲基磺酸乙酯(EMS)和亚硝酸盐等化学诱变手段[6],或者通过对发酵摇瓶进行分批补料,提高菌种生产能力,但是通过诱变手段通常会有突变率高,须大量处理材料的缺点,分批补料可能会增加成本。在林可霉素的发酵过程中,种子液的质量对于后续发酵能力高低有至关重要的作用,种瓶经过摇瓶培养后,种子液检测出高的菌浓和状态优良的菌丝活力,再转接发酵瓶,以此来提高林可霉素发酵效价。本文通过实验探究林可霉素种子液最佳的培养条件进行工艺改良,以达到提高林可霉素发酵能力,降低林可霉素生产成本的目的,这对林可霉素在猪病治疗方面也将具有极其重要的意义。
1 材料与方法
1.1 材 料
1.1.1 菌种 原始菌种为冻干管粉末,菌种号CGMCC4.1024,由中科院普通微生物菌种保藏管理中心提供。
1.1.2 培养基 分离/斜面培养基:可溶性淀粉,黄豆饼粉,KNO3,NaCl,MgSO4·7H2O,K2HPO4。种瓶培养基:玉米淀粉,黄豆饼粉,葡萄糖,(NH4)2SO4,CaCO3。发酵培养基:玉米淀粉,黄豆饼粉,葡萄糖,玉米浆,(NH4)2SO4,NaNO3,KCl,CaCO3。
1.1.3 设备 BSA2202S电子天平,赛多利斯科学仪器;XDW25/96型旋转摇瓶机,乐山长征制药机械有限公司;LDZH-150L立式高压蒸汽灭菌器,上海申安医疗器械厂;BSC-1500IIA2-X净化工作台,济南鑫贝西生物科技有限公司;TDL-5-A台式离心机,上海安亭科学仪器;PHS-3C酸度计,上海仪电科学仪器股份有限公司;CX31显微镜,奥林巴斯;LC-20AT型高效液相色谱仪,日本岛津公司。
1.2 方法
1.2.1 林可链霉菌斜面的制备 取林可链霉菌原始菌种CGMCC4.1024,加入1 mL无菌水制备成菌悬液,滴加100 μL菌悬液至斜面培养基上,用灭菌玻璃棒划线接种,将斜面置于26 ℃培养间培养7 d,待用。
1.2.2 林可霉素种瓶培养温度验证 取培养好的林可链霉菌斜面挖块,接种量约1 cm2,接入种瓶培养基后摇匀,将种瓶分别置于26、30、34 ℃的培养间进行发酵培养,摇床转速设置为220 r/min,培养时间为48 h,待培养结束后,对种瓶的各项指标进行比较,确定最佳培养温度。
1.2.3 林可霉素种瓶转速验证 取培养好的林可链霉菌斜面挖块,接种量约1 cm2,接入种瓶培养基后摇匀,将摇瓶机转速分别设置为190、220、250 r/min,放置种瓶,进行发酵培养,培养间温度设置为30 ℃,培养时间为48 h,待培养结束后,对种瓶的各项指标进行比较,确定最佳摇瓶转速。
1.2.4 林可霉素种瓶培养时间验证 取培养好的林可链霉菌斜面挖块,接种量约1 cm2,接入种瓶培养基后摇匀,进行摇瓶培养,种瓶摇床转速设置为220 r/min,培养温度设置为30 ℃,种瓶培养时间分别按45、48、51 h发酵培养,待培养结束后,对种瓶的各项指标进行比较,确定最佳培养时间。
1.2.5 设计正交实验 正交实验依据 Galois理论从全面试验中挑选出部分具有代表性的水平组合进行实验,通过挑选部分有代表性的水平组合进行实验并对结果进行分析找出最优的水平组合,以培养时间、培养温度和摇床转速作为因素,设计三因素三水平实验,利用SPSS软件设计正交表,须进行9种组合的实验,根据每种组合培养条件将斜面挖块,接入种瓶,待培养结束后转入发酵瓶,发酵瓶培养温度设置为30 ℃,摇床转速设置为220 r/min,摇瓶培养7 d,待发酵瓶培养结束后分析实验结果。正交实验因素水平表和设计表见表1和表2。利用正交表中的方案设计进行摇瓶种子液培养和发酵培养,检测结果。
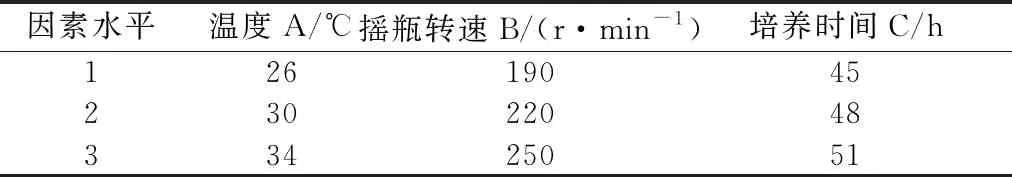
表1 因素水平表

表2 L9(3)3正交实验设计表
1.2.6 各指标检测方法 种子液pH值的检测,用已校准过的酸度计进行测定;菌体浓度检测,先称量10 mL空离心管重量M1,吸取10 mL菌液后,称量离心管和菌液的总质量M2,然后以3000 r/min离心10 min,倒掉上清,称量菌体与离心管总质量M3,根据M3-M1/M2求得种子液菌浓;菌丝形态:滴加一滴菌液于载玻片,自然晾干,用美兰染色3 min,洗去染色液,晾干,滴加香柏油,用显微镜在100倍高倍显微镜下观察菌丝状态;氨氮:甲醛测定法[7];还原糖:斐林氏滴定法[8];发酵效价:利用高效液相色谱法[9]检测发酵液效价。
2 结果与分析
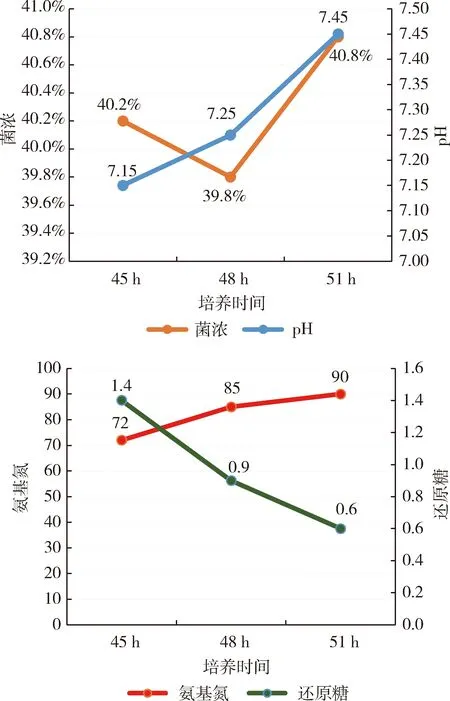
2.1 培养温度对种瓶菌丝生长的影响 如图1所示,当温度为26 ℃时,pH和菌浓均是最低,菌种生长缓慢,菌丝较年轻;还原糖和氨基氮的消耗量较低;当温度为34 ℃时,pH较高,菌浓与28 ℃相比,变化不大,营养物质消耗过快,菌丝已衰老,而当温度为30 ℃时,pH处于中间值,菌浓最高,菌丝活力较高,还原糖和氨基氮的利用率高,所以根据以上分析,确定摇瓶种子液的最适培养温度为30 ℃。不同温度下种瓶菌丝生长镜检情况如图2所示,具体描述如下:26 ℃培养,菌丝着色较蓝,较分散,较细长,菌液红褐色,挂瓶度一般;30 ℃培养,菌丝着色很深,较粗长,菌丝抱团,菌液黄绿色,挂瓶度高,粘稠;34 ℃培养,菌丝呈网状,中空,模糊,菌丝偏老,菌液红褐色,挂瓶度一般。由菌丝形态得出,30 ℃较为适合。
菌浓:% 还原糖:g/100 mL 氨基氮:mg/100 mL

图2 不同培养温度下菌丝显微照片(菌丝用美兰染色,显微镜放大倍数为100倍)
2.2 摇瓶转速对种瓶菌丝生长的影响 如图3所示,不同转速pH值较为接近,220 r/min菌浓最高。当转速过高时,耗氧加快,待培养结束后发现菌丝生长缓慢,菌丝较衰老;而当转速较慢时,通氧量减少,不利于菌种生长,当转速为220 r/min时,菌丝生长状态优良,所以根据以上分析,确定摇瓶种子液的最适摇瓶转速为220 r/min。不同摇瓶转速下种瓶菌丝生长镜检情况如图4所示,具体描述如下:当摇床转速190 r/min时,菌丝较细长,着色较蓝,菌丝较分散,菌液挂瓶度一般,红褐色,当摇床转速为220 r/min时,菌丝粗壮,抱团着色很深,菌液挂瓶度高,粘稠,黄绿色。当转速为250 r/min时,菌丝着色较深,网状中空,较为散乱、细长,挂瓶度较为适中。由菌丝形态得出,220 r/min较为适合。

菌浓:% 还原糖:g/100 mL 氨基氮:mg/100 mL

图4 不同摇床转速下菌丝显微照片(菌丝用美兰染色,显微镜放大倍数为100倍)
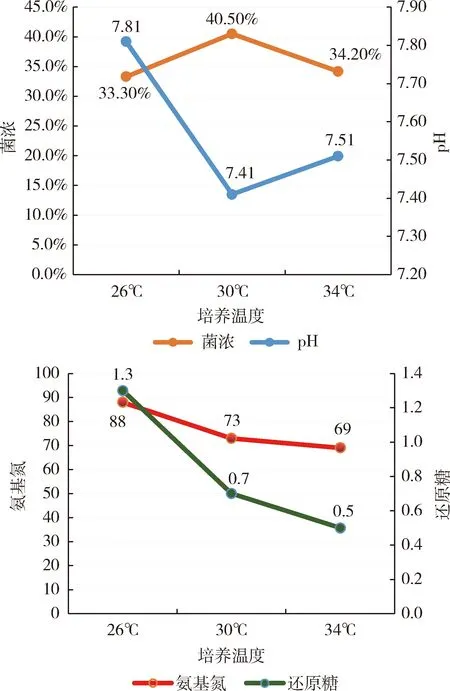
2.3 培养时间对种瓶菌丝生长的影响 如图5可知,随培养时间延长,pH逐渐升高,但升高幅度较小,51 h菌浓最高,48 h还原糖和氨基氮的利用率最佳。不同培养时间下种瓶菌丝生长镜检情况如图6所示,具体描述如下:当培养时间为45 h,菌丝较细长,着色较蓝,菌丝部分成团,部分较松散,菌液挂瓶度一般,红褐色,当培养时间为48 h,菌丝粗壮,抱团,密集缠绕,着色很深,菌液挂瓶度高,粘稠,黄绿色。当培养时间为51 h,菌丝着色较深,菌丝散乱排列,稍有断裂,挂瓶度适中,所以48 h菌丝形态最佳,48 h较为适合。
菌浓:% 还原糖:g/100 mL 氨基氮:mg/100 mL
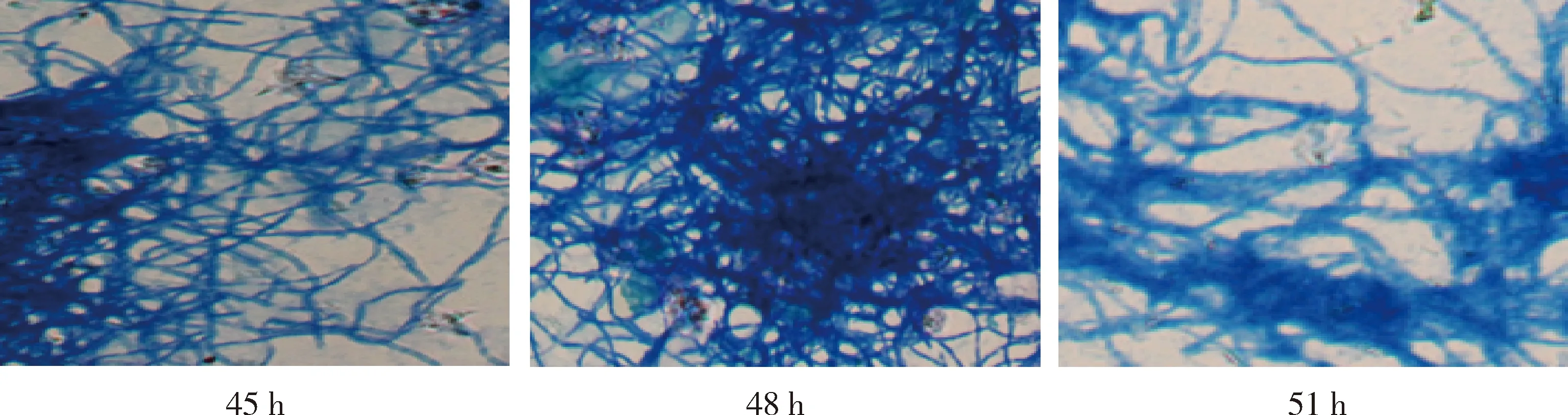
图6 不同培养时间下菌丝显微照片(菌丝用美兰染色,显微镜放大倍数为100倍)
2.4 发酵效价对种瓶培养条件影响 如表3所示,根据正交实验极差结果,对林可霉素发酵效价影响程度按高到低排列分别为C>A>B,根据正交实验方差结果,种瓶最佳组合为A2B2C1,对应表3中第7组。

表3 正交实验发酵效价结果记录
3 结 论
由种瓶pH、菌浓、菌丝形态、还原糖和氨基氮利用率、发酵效价五个方面对种瓶代谢影响进行分析。从图1分析出不同培养温度,对每个指标的影响均比较大,这是因为温度较低时,菌体生长缓慢,待培养结束后,明显看到菌液外观颜色较浅,温度较高时,种子液代谢加快,营养成分消耗过快,菌体衰老,影响后期发酵生产能力,所以当培养温度为30 ℃时,各项指标均能达到较为合适的状态。从图2和图3分析出不同转速、培养时间对林可霉素种子液还原糖和氨基氮的影响较大,这是因为转速对林可霉素溶氧有较大的影响,林可霉素是好氧发酵,转速的适当提高可以加大通气量,提高溶氧溶度,但转速过高会加快代谢速率,加速菌体衰老,转速过慢,会导致供氧不足,影响种子液生长速率。种子液培养时间不足,菌丝偏年轻,培养时间较长,菌体生长较老,转入发酵后,均会影响中后期发酵水平,所以当摇床转速为220 r/min时,培养时间为48 h时,菌丝达到最佳状态。pH是一个重要的参数,因为它对细胞生长速率、活性以及产物合成有着显著的作用。对林可链霉菌谷氨酞胺合成酶有影响。实验证明弱碱性的pH有利于林可霉素的生物合成[10],所以由表4种子液pH,再结合菌丝形态分析出,第7组结果最好,种子液检测结果与发酵效价结果一致。正交实验结果与单因素实验结果基本吻合。

表4 正交实验种瓶菌丝生长结果记录
综合对比单因素实验和正交实验,单因素实验以固定另外两个因素不变,改变其中一个因素对种子液培养条件进行考察,根据pH、菌浓、菌丝形态、还原糖和氨基氮利用率等检测指标分析出种子液最佳的培养条件为:培养时间48 h,培养温度30 ℃,摇瓶转速220 r/min。在此培养条件下,菌丝状态均达到最佳,菌浓较高,还原糖和氨基氮利用率高。正交实验以三因素三水平设计正交表,利用SPSS软件设计出9种组合实验,根据每组培养条件发酵培养,通过检测种瓶pH、菌浓、菌丝形态、还原糖和氨基氮利用率和发酵效价,分析出种子液最佳的培养条件为:培养时间45 h,培养温度30 ℃,摇瓶转速220 r/min。单因素与正交实验结果基本吻合,但培养时间有所出入,之所以有所出入,其主要原因在于正交实验和单因素实验各自的条件和目的不一样,单因素实验只是考虑单一变量对结果的影响,而正交实验是在不同的因素水平下,综合对比,选取出最佳的培养条件,所以种瓶的培养时间有所出入亦是正常,并且在这两种实验设计方案中,得出的培养时间差距较小,说明45~48 h这个范围内,均比较适合种瓶生长,所以确定种瓶培养时间为45~48 h。按照单因素实验和正交实验确定的培养条件,将种子液接入小罐,结果显示,种子有更强的生命力,发酵产量更高。

