杆菌肽在动物可食性组织和禽蛋中残留的HPLC-MS/MS检测方法
高嫣珺,聂 贞,聂 雅,王 震,卜仕金
(扬州大学兽医学院,江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州 225009)
杆菌肽是一种由芽孢杆菌分泌产生的多肽类抗生素,对肠道内多数革兰氏阳性菌有较强的抗菌作用,对部分革兰氏阴性菌、放线菌、螺旋体亦有抑制作用[1]。杆菌肽特殊的抗菌谱与其无残留、不产生耐药性和无毒副作用等优良特性,使其广泛应用于畜禽养殖、兽医和人医临床等多个领域[2]。在畜禽养殖业中,杆菌肽主要作为饲料添加剂用于促进动物生长和提高饲料利用率[3-7],同时也用于防治坏死性肠炎等肠道疾病、提高氮元素利用率以减少动物粪便对环境的污染等[8]。2013年,亚甲基水杨酸杆菌肽在我国获得农业部药物添加剂批准文号;2019年,亚甲基水杨酸杆菌肽可溶性粉制剂列入第三批兽用处方药目录[9],随着畜禽养殖业的发展,高效、安全的杆菌肽产品具有越来越广阔的应用前景。但动物性食品生产过程中仍存在兽药过度使用或滥用现象,兽药残留经食物链进入人体后易导致蓄积毒性、耐药性等一系列连锁危害,同时食品基质的复杂性和兽药残留的痕量存在性使得食品中兽药残留的准确定量检测存在一定困难[10]。本研究建立的动物可食性组织和禽蛋中杆菌肽残留的HPLC-MS/MS检测方法满足动物可食性组织中杆菌肽残留限量的检测要求,为动物性食品中杆菌肽的残留监控提供技术支撑,对保障我国动物源性食品安全、促进动物性食品进出口贸易具有重要意义。
1 材料与方法
1.1 仪器和试剂 仪器:AB SCIEX Qtrap 6500plus三重四极杆串联质谱仪;AB SCIEX ExionLCTMAC高效液相色谱仪;XBridge©BEH C18色谱柱(2.1 mm×100 mm,3.5 μm);QUINTIX124-1CN电子天平;Eppendorf Centrifuge 5810 R台式高速冷冻离心机;Eppendorf可调微量移液器(10 μL、100 μL、1000 μL、5000 μL);Nylon 0.22 μm有机相针式滤器;Agilent Bond Elut Plexa PCX(3 mL, 60 mg)固相萃取柱;WATERS OASIS©MCX(3 mL, 60 mg)固相萃取柱。
试剂:杆菌肽标准品(杆菌肽A、B1、B2和B3总含量84.8%,杆菌肽A含量53.2%。规格:100 mg;批号:C10418000;购自德国Dr.Ehrenstorfer GmbH公司);甲醇、乙腈(色谱纯,美国TEDIA公司);甲酸、浓氨水(色谱纯,上海阿拉丁公司);乙酸乙酯、正己烷(分析纯,国药集团化学试剂有限公司);三氯乙酸(分析纯,上海MACKLIN公司);水为符合GB/T 6682标准的超纯水。
1.2 标准工作液配置 准确称取约7.37 mg杆菌肽标准品粉末于25 mL的容量瓶中,加入适量的0.1%甲酸甲醇溶解并定容至刻度,即配置浓度为0.25 mg/mL(以杆菌肽计)的标准储备液,于-20 ℃冰箱中保存。准确量取适量标准储备液,用0.1%甲酸甲醇稀释制备浓度为1000、10000 ng/mL的标准工作液,现配现用。
1.3 方法
1.3.1 样品前处理 动物可食性组织包括猪、鸡和鸭的肌肉、肝脏、肾脏和脂肪组织,空白动物可食性组织以洁净手术剪适当剪碎,用匀浆机搅碎;禽蛋包括鸡蛋和鸭蛋,去除蛋壳,取全部蛋清和蛋黄,用匀浆机搅匀。称取(2.0 ±0.01)g匀浆后空白动物可食性组织和禽蛋样品于50 mL离心管A中,加入4.0 mL 4%三氯乙酸乙腈溶液,涡旋2 min,加入4.0 mL 0.1%甲酸水溶液涡旋提取5 min,随后12000 r/min离心6 min(4 ℃),转移上清液至于50 mL离心管B中。残渣按前述步骤重复提取一次,合并上清于离心管B中备用。离心管B中加入经0.1%甲酸水溶液饱和的正己烷3.0 mL,涡旋混合1 min,随后8000 r/min离心5 min,弃去上层有机相及中间乳化层,保留下层溶液待净化。
动物可食性组织使用Agilent Bond Elut Plexa PCX(3 mL, 60 mg)固相萃取柱净化,禽蛋使用OASIS©MCX(3 mL, 60 mg)固相萃取柱净化。依次用3.0 mL甲醇和3.0 mL 0.1%甲酸水溶液活化固相萃取柱,取前述步骤处理得到的样品液过柱,随后依次用3.0 mL 1%甲酸乙酸乙酯和3.0 mL甲醇淋洗,淋洗完毕后抽干萃取柱,用3.0 mL 0.5%氨水甲醇溶液洗脱,收集全部洗脱液于10 mL具塞离心管中,离心管中加入1.0 mL 0.1%甲酸水溶液,涡旋混匀后经孔径0.22 μm滤膜过滤,滤液收集至1.5 mL进样瓶中,待检测。
1.3.2 液相色谱条件优化 XBridge©BEH C18色谱柱(2.1 mm×100 mm,3.5 μm);流速:0.4 mL/min;柱温:35 ℃;进样量:5 μL;流动相:A为0.1%甲酸水,B为乙腈;液相色谱梯度洗脱条件见表1。

表1 液相色谱梯度洗脱条件
1.3.3 质谱条件优化 电喷雾离子源(Turbo ion Spray),正离子扫描,多反应监测(MRM);气帘气压力:40.0 psi;碰撞气压力:Medium;电离电压:5500 V;离子源温度:550 ℃。根据杆菌肽离子扫描结果,相关质谱参数见表2。

表2 杆菌肽质谱参数
1.4 定性方法 通过待测物色谱图的保留时间与对照品保留时间、待测物色谱峰特征离子与相应浓度对照品色谱峰的特征离子相对照进行定性。
定性测试需要满足以下条件:①与受试药物相同的离子峰在空白样品图谱中不出现;②定性离子色谱峰的信噪比≥3;③待测样品与标准液中目标峰的保留时间偏差不超出±2.5%;④样品中特征离子对的相对丰度与浓度相当的标准液的相对丰度一致,偏差满足2002/657/EC[11]中的要求。
1.5 定量方法
1.5.1 基质标准曲线的绘制 分别称取各动物的肌肉、肝脏、肾脏和脂肪组织及禽蛋的空白样品,经前处理后得到空白基质液并加入适量的标准工作液配制浓度为50、100、250、500、750、1000 ng/g的基质匹配标准溶液,在本试验建立的色谱和质谱条件下,按照浓度从低到高的顺序依次进样检测。以测得的杆菌肽特征离子峰面积为纵坐标,对应的标准溶液浓度为横坐标,拟合标准曲线。
1.5.2 检测限和定量限的确定 分别称取各动物的肌肉、肝脏、肾脏和脂肪组织及禽蛋的空白样品,经前处理得到空白基质液并加入适量标准工作液制备不同浓度的空白基质添加样品,每个浓度5个平行,在本试验建立的色谱和质谱条件下依次进样检测,取信噪比(S/N)≥3时的杆菌肽添加浓度为方法的检测限(LOD),信噪比(S/N)≥10时的杆菌肽添加浓度为方法的定量限(LOQ)。
1.5.3 准确度和精密度的测定 本方法以组织添加样品的回收率考察准确度,回收率的批内变异系数考察精密度,批间变异系数考察重复性,选定添加浓度50、100、500和750 ng/g作为添加回收试验的四个浓度。分别准确称取(2.0±0.01)g各动物的肌肉、肝脏、肾脏和脂肪组织及禽蛋的空白样品,加入适量的标准工作液。按1.3项下的条件处理、分析。测定结果代入各组织的基质标准曲线,样品实测值与标准曲线中对应浓度峰面积比值,记为本方法的回收率。每批次每个浓度制备5个平行样品,共测定三个分析批次分三天完成。
2 结果与分析
2.1 色谱行为 在本试验的优化的质谱和色谱条件下,杆菌肽出峰时间约为3.19 min,目标峰与基质杂质峰分离良好,杆菌肽目标峰峰型尖锐,可用于定量分析(图1)。

图1 杆菌肽标准品总离子流色谱图(杆菌肽50 ng/g)
对比各动物可食性组织(肌肉、肝脏、肾脏、脂肪)及禽蛋(鸡蛋、鸭蛋)空白基质图谱与空白基质添加杆菌肽标准品图谱,显示杆菌肽标准品与空白基质杂质分离良好且互不干扰,可用于定量分析。扫描空白基质与空白基质添加药物(50 ng/g)样品中杆菌肽定量离子对(712.2>199.0)的离子流图见图2~图9。

图2 添加杆菌肽的猪可食性组织总离子流色谱图
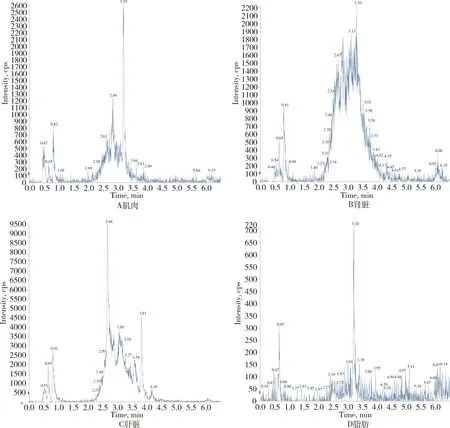
图3 空白猪可食性组织总离子流色谱图

图4 添加杆菌肽的鸡可食性组织总离子流色谱图
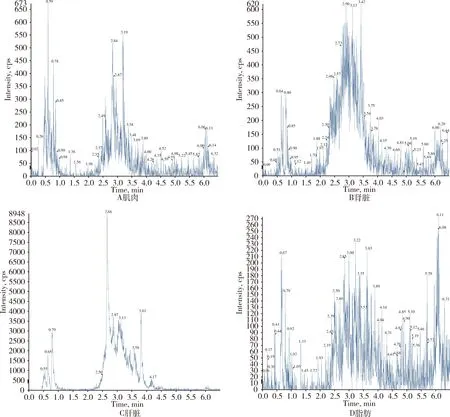
图5 空白鸡可食性组织总离子流色谱图
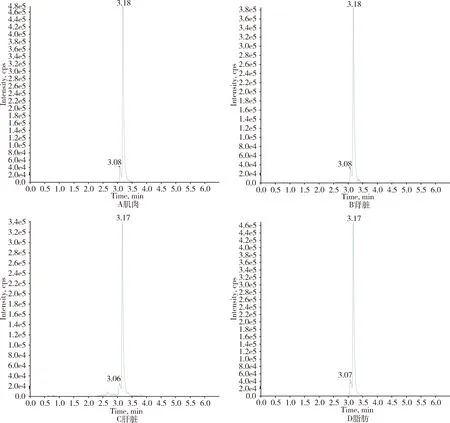
图6 添加杆菌肽的鸭可食性组织总离子流色谱图
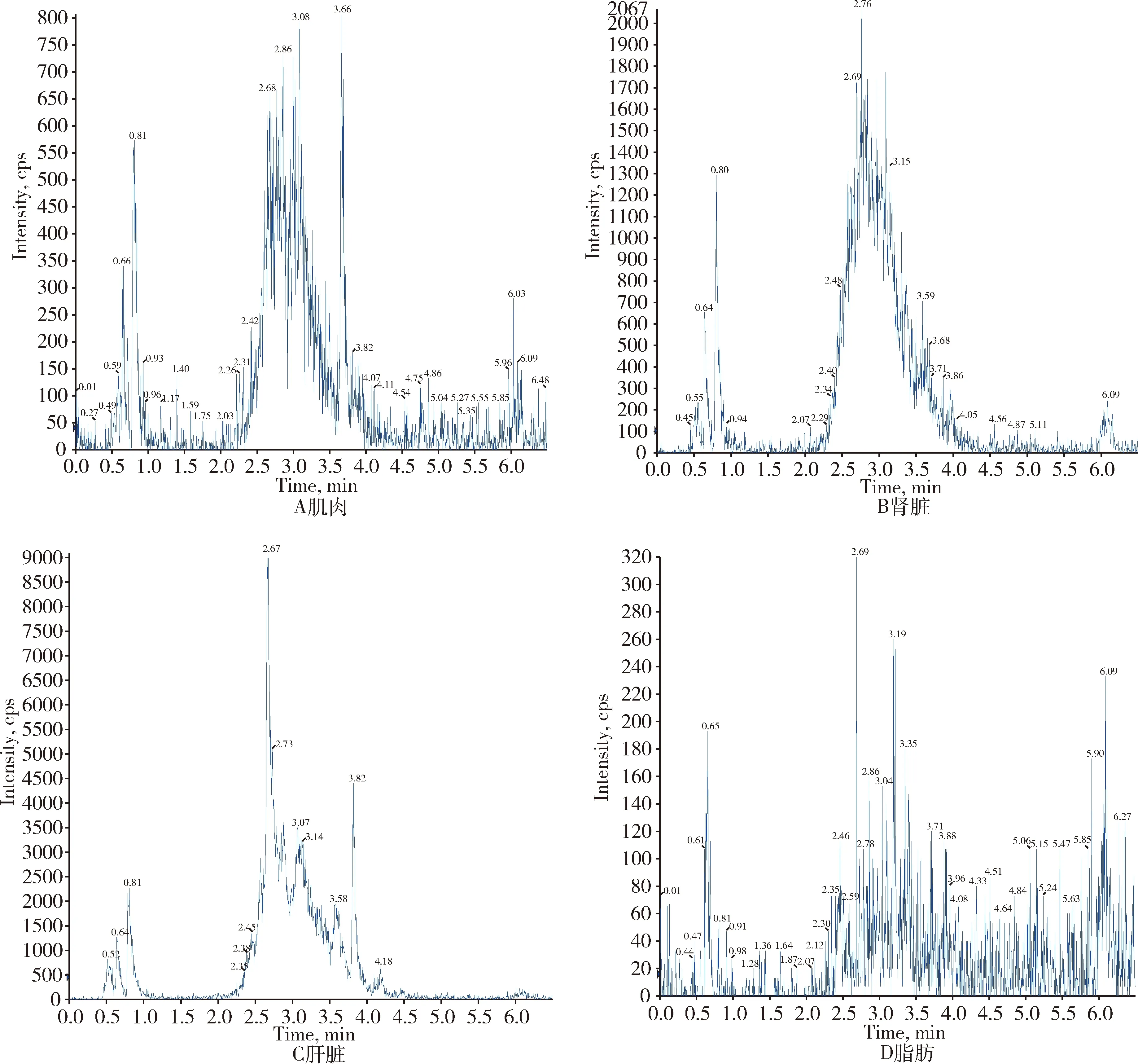
图7 空白鸭可食性组织总离子流色谱图

图8 添加杆菌肽的禽蛋组织总离子流色谱图
图9 空白禽蛋组织总离子流色谱图
2.2 基质匹配标准曲线 杆菌肽在空白基质中添加50~1000 ng/g范围内,添加浓度和目标峰面积的线性关系良好,相关系数r>0.999(表3)。

表3 各动物组织和禽蛋中的杆菌肽含量的标准曲线方程
2.3 检测限和定量限 取S/N≥3时浓度为检测限,本方法检测限为30 ng/g;根据精密度和准确度试验结果,取S/N≥10时浓度为定量限,本方法定量限为50 ng/g。
2.4 准确度和精密度 制备各动物组织和禽蛋在50、100、500、750 ng/g四个添加浓度下的组织添加样品,进行添加回收试验,批内、批间平均回收率及变异系数结果见表4、表5,杆菌肽在各组织中的平均回收率为66.2%~84.7%,批内、批间变异系数均小于15%。
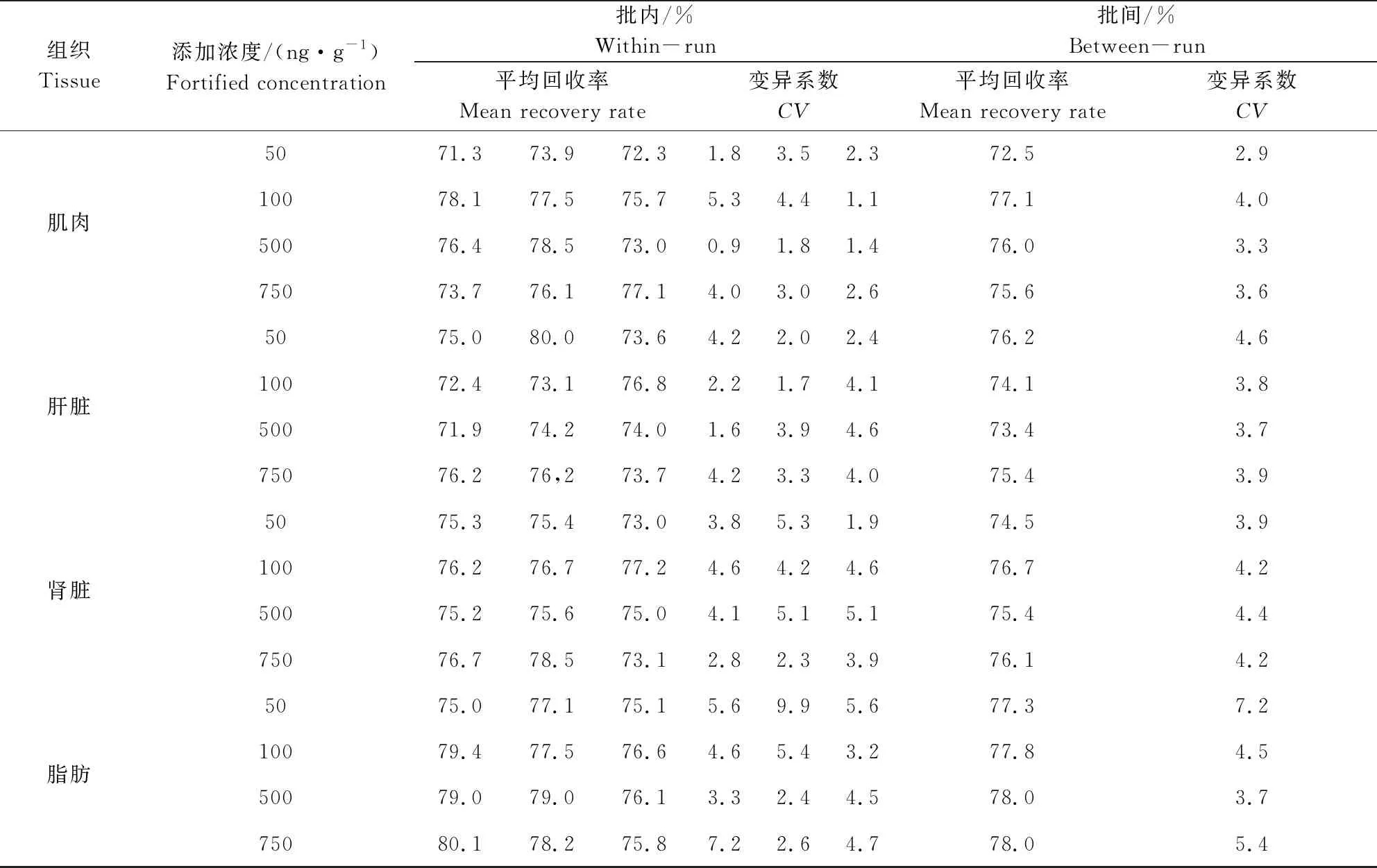
表4 猪可食性组织中杆菌肽添加回收率及变异系数(n=5)
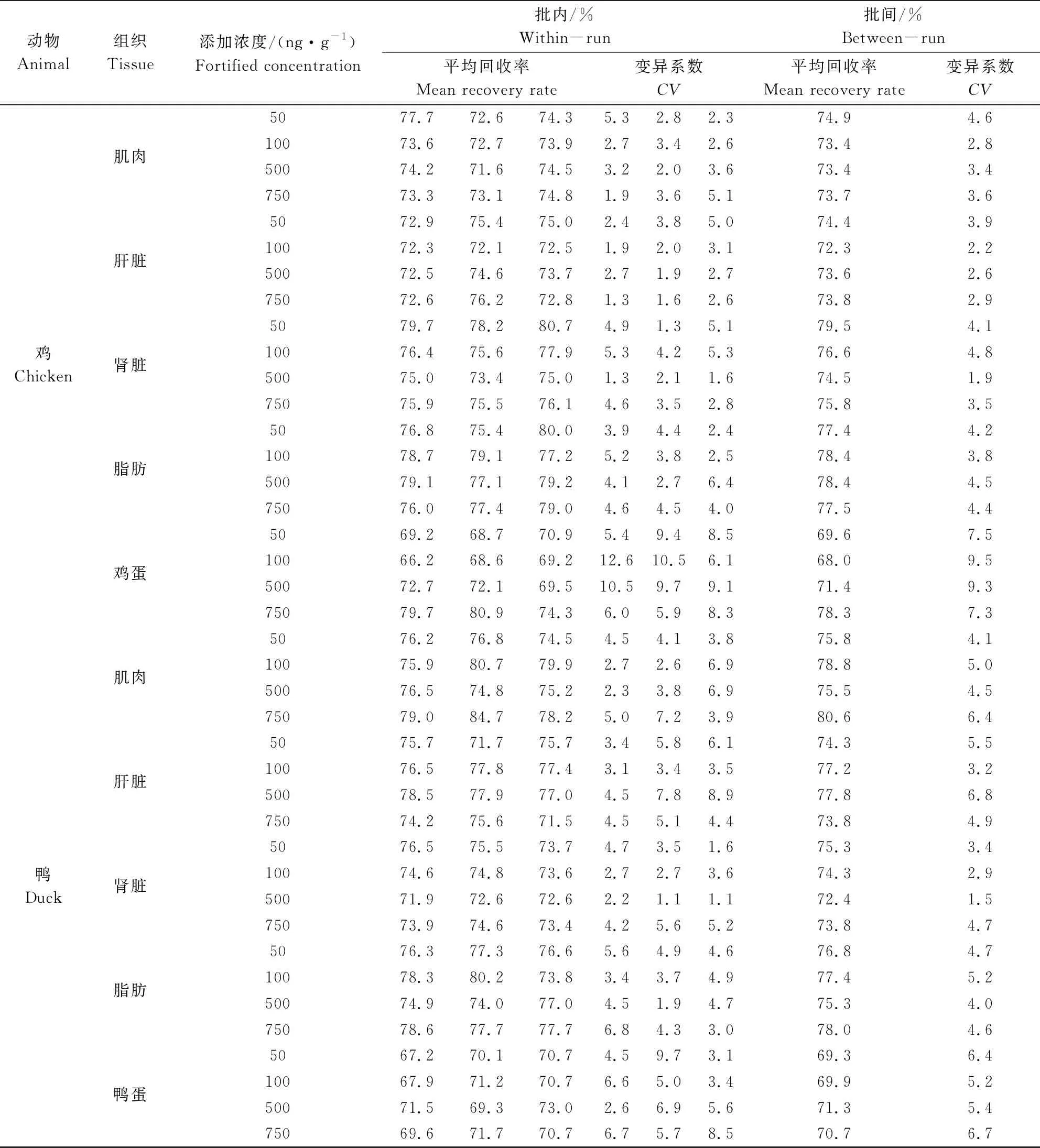
表5 鸡、鸭可食性组织及禽蛋中杆菌肽添加回收率及变异系数(n=5)
2.5 定性试验 定性试验结果显示,本试验中各动物可食性组织和禽蛋中内源性杂质不影响目标物质的定量。在本试验建立的色谱条件下,目标峰分离良好且峰型尖锐,利于定量分析,基质添加样品中杆菌肽相对离子丰度符合定性测试要求。
3 讨 论
3.1 前处理方法的优化 试验比较了多种沉淀蛋白的方法,结果显示,使用甲醇沉淀蛋白后提取液澄清,但易堵塞萃取柱;使用乙腈沉淀蛋白,个别组织提取液不澄清,难以除去悬浮残渣;使用4%~10%不同浓度的三氯乙酸乙腈溶液,在4%和10%浓度下,动物组织样品和禽蛋样品可以获得澄清的提取液,且不会堵塞萃取柱。故本试验选定4%和10%三氯乙酸乙腈作为蛋白沉淀剂。同时比较了先提取后沉淀蛋白和先沉淀蛋白后提取两种不同顺序,结果显示,先提取后沉淀蛋白,色谱图中会出较大干扰峰,干扰定量测定。沉淀蛋白后的提取液使用0.5%三氟乙酸水溶液进一步提取样品,并且两次重复提取以确保样品中的杆菌肽提取完全。
试验比较了多种固相萃取柱的净化效果,参考全家兴[12]的报道选用HLB萃取柱净化样品,并使用含TFA的提取液以增加目标物保留度,结果显示HLB萃取柱对样品净化能力较强,但加样回收率不稳定。已知杆菌肽在酸性溶液中溶解度更好,故尝试用于碱性物质分析的混合型阳离子交换柱,洗脱液为5%氨水∶甲醇(V/V∶10/90)的偏碱性溶液。分别以甲醇/乙腈作为蛋白沉淀剂,0.1%甲酸水/0.5%三氟乙酸水为提取液,对HLB和MCX的柱保留效果进行比较,对比结果中除HLB萃取柱在用乙腈沉蛋白时柱回收率较低外,其他结果基本处在同一水平,并且MCX萃取柱在以上几种条件下结果均保持稳定。PCX与MCX属于同类型的阳离子交换柱,但PCX过柱流速更快,且柱回收良好,可缩短样品处理时间。使用酸性水溶液取代纯水对阳离子交换柱进行活化,可以提高对目标物的保留度,MCX萃取柱由70.27%提升为85.86%,PCX萃取柱由84.2%提升为104.31%。但禽蛋样品使用PCX萃取柱回收率较低,尝试更换不同萃取柱进行试验,结果显示MCX萃取柱可得到更好的结果。由于上述结果中使用含离子对试剂(TFA)提取液与甲酸水溶液提取的结果差异不显著,故选用0.1%甲酸水作为提取液,以简化试验中使用的试剂。使用经提取液饱和的正己烷除脂,防止样品提取液与正己烷互溶。参照萃取柱说明书上的净化程序,选用中性淋洗液(甲醇)和酸性淋洗液(1%甲酸乙酸乙酯)除去杂质。
3.2 液相色谱条件的优化 本试验选用XBridge®BEH C18130A色谱柱,亚乙基桥杂化(BEH)颗粒技术对碱性化合物有很好的保留,且pH耐受范围大,是肽类化合物专用色谱柱。流动相为乙腈-0.1%甲酸水体系,该体系下杆菌肽峰型良好,利于定量分析。为进一步提高检测效率,适当缩短梯度洗脱时间,缩短后的洗脱程序为乙腈:0~0.5 min 15%,5.0~5.5 min 85%,5.6~6.5 min 15%,杆菌肽出峰时间约为3.19 min,峰型良好,与大部分杂质可以分离,可用于定量分析。
3.3 质谱条件的优化 杆菌肽在质谱扫描中一般为加氢离子,并且可观察到三种电荷态,其中荷2个质子的杆菌肽丰度最高[13],结合实际离子扫描结果选取了[M+2H]2+作为质谱扫描中的母离子。最初选取712.2(杆菌肽A)和704.8(杆菌肽B)作为母离子进行离子扫描,进一步轰击母离子产生子离子后,选取712.2>199.0、712.2>226.9和704.8>199.0、704.8>227.0分别作为定量、定性监测离子对。确定检测离子对后需要先后优化其碰撞能(CE)和去簇电压(DP)。碰撞能使母离子裂解产生子离子,去簇电压可防止击碎的子离子再次聚合。优化结果分别为56、48、54、47、130、140 V(同一母离子的子离子有相同的DP值)。在后续HPLC-MS/MS检测中发现杆菌肽B的检测离子对704.8>199.0、704.8>227.0,因同分异构体的存在,在色谱行为中分裂为三个峰,分裂后的峰响应值较低,不利于定量分析。且按照药品说明书的标识杆菌肽B总含量应为31.6%,但三个同分异构体的含量并不明确,考虑到这种不确定性,选取含量明确且稳定的杆菌肽A的离子对:712.0>199.0、712.0>227.0,作为本试验中的定量、定性离子对进行检测。
4 结 论
本研究摸索和优化了样品前处理方法及仪器条件,建立了猪、鸡、鸭的可食性组织及禽蛋中杆菌肽残留的HPLC-MS/MS检测方法,样品经0.1%甲酸水提取,三氯乙酸乙腈沉淀蛋白,正己烷除脂,固相萃取柱净化后,进HPLC-MS/MS检测。以0.1%甲酸水和乙腈作为流动相梯度洗脱,质谱采用电喷雾离子源,正离子扫描模式,多反应监测(MRM)模式进行检测。结果表明,在50~1000 ng/g添加浓度范围内,浓度与目标峰面积线性关系良好,r>0.999,LOD≥30 ng/g,LOQ≥50 ng/g。平均回收率66.2%~84.7%,批内、批间变异系数均小于15%。本试验建立的动物可食性组织和禽蛋中杆菌肽残留的HPLC-MS/MS检测方法符合生物样品定量分析验证指导原则的规定,满足动物可食性组织中杆菌肽残留限量的检测要求。

