CT检测非酒精性脂肪性肝病合并高危冠状动脉斑块患者冠状动脉指标临床意义探讨*
蔡冬梅,吴文娟,姜亦伦,居敏昊
冠心病是非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)患者的主要死亡原因。NAFLD容易促进高危冠状动脉斑块(high-risk coronary plaques,HRP)的形成,而存在HRP提示斑块的易损性[1-3]。在所有致命性心肌梗死和心源性猝死病例,超过70%是源于易损斑块的破裂,严重影响冠心病患者的长期。异位脂肪沉积在NAFLD的发生发展过程中也发挥着重要的作用。NAFLD发展可能导致代谢紊乱和内脏脂肪增加,特别是心外膜脂肪组织(epicardical adipose tissue,EAT)和血管周围脂肪组织增加。脂肪细胞因子通过直接融合释放炎症因子到达血管壁,加速冠状动脉粥样硬化的进程[4-8]。MRI是目前评估肝脏脂肪变性最准确的非侵入性检查,但它并不适合某些存在MRI检查禁忌证的患者,因此其临床适用性受到了限制,并不能被广泛推广应用。CT可以规避MRI检查所带来的弊端,不过肝脏CT衰减容易受管电压的影响,传统单能CT检测轻度肝脏脂肪浸润的敏感度较低,其检查价值有限。随着双能CT技术的迅速发展,其特有的双能CT基质分解算法衍生出新的成像指标,即肝脏脂肪分数(hepatic fat fraction,HFF)有助于克服这个困难[9,10]。研究报道称HFF可以通过分解肝脏组织、脂肪和碘,评估实际的肝脏脂肪含量。最近的研究表明HFF定量测定肝脏脂肪具有与磁共振波谱相媲美的诊断表现,临床应用的可行性强且可重复性好[11]。本研究检测了NAFLD合并冠状动脉HRP患者HFF水平变化,现报道如下。
1 资料与方法
1.1 研究对象 2015年1月~2021年1月我院诊治的NAFLD患者168例,男性114例,女性54例;平均年龄为(63.2±8.5)岁。NAFLD诊断符合《非酒精性脂肪性肝病诊疗指南(2010年修订版)》,超声检查至少符合以下两项:肝脏近场回声弥漫性增强(“明亮肝”),回声强于肾脏;肝内管道结构显示不清;肝脏远场回声逐渐衰减[11,12]。纳入患者碘过敏试验阴性,心率<100次/分,无心律不齐,既往无严重的肝肾心脑血管疾病。排除标准:既往接受过冠状动脉支架植入术或搭桥手术、因屏气差或其他原因造成图像质量不清、梗阻性黄疸、自身免疫性肝病、存在肝脏恶性肿瘤。本研究经我院医学伦理委员会批准,患者及其家属签署知情同意书。
1.2 CT冠状动脉成像检查 使用SOMATOM Force双源CT(Siemens公司,德国)进行冠状动脉成像扫描。扫描前,嘱患者舌下含服硝酸甘油片以扩张冠状动脉。通过扫描定位像,确定扫描范围。使用高压注射器经外周静脉注射对比剂优维显(370 mgI/ml,Bayer公司,德国)60 ml,注射速率为4.5~5.0 ml/s。CT扫描参数:管电压120 kV,管电流280 mA,准直器宽度为64 mm×2 mm×0.6 mm,厚度为0.75 mm,旋转时间为0.28 s,球管旋转时间为0.33 s/r。应用Frontier Version软件(Siemens公司,德国)分析冠状动脉斑块。根据既往研究报道的HRP定义,至少符合以下几项中的两项:低密度斑块(CT值<30 HU)、点状钙化斑块(最大直径<3 mm)、重构指数(冠状动脉最狭窄处管腔面积/近远端参考血管面积平均值)>1.1和餐巾环征(即冠状动脉非钙化斑块周围环状高密度影)[13]。采用测量工具计算预先设定的CT阈值范围内脂肪组织体积,包括心外膜脂肪组织体积(epicardical adipose tissue volume,EATV)和冠状动脉周围脂肪组织(pericoronary adipose tissue volume,PATV)。应用Syngo.via工作站(Siemens公司,德国),采用手动标定出冠状动脉各分支钙化灶,应用钙化积分软件计算冠状动脉钙化积分(coronary artery calcification score,CACS)。避开肝脏重要血管和胆管结构,在门静脉水平(分别为左肝、右前叶和右后叶)随机绘制3个感兴趣区(ROI),约为2.0~2.5 cm2。在Syngo.via工作站基于双能CT基物质分解算法自动计算HFF,取3个ROI的平均值。
1.3 检测与评估 使用日本Sysmex公司提供的XE 5000型血细胞分析仪检测血常规,计算中性粒细胞/淋巴细胞比率(NLR);使用美国Abbott Laboratories公司生产的全自动生物化学分析仪检测血生化指标;采用Framingham危险评分评价患者冠心病事件风险[14]。

2 结果
2.1 NAFLD患者冠状动脉CT成像表现 见图1。

图1 NAFLD患者冠状动脉CT成像表现a:男,69岁。胸闷1月,CACS 为316.7。在肝脏门静脉水平,肝实质平均CT值为30 Hu;b:右冠状动脉中段混合斑块;c:回旋支近段非钙化斑块,管腔重度狭窄,中远段多发钙化斑块; d:男,62岁。胸部不适2月,CACS为971.3。肝实质密度降低,平均CT值为38 Hu;e:左冠状动脉前降支近段多发体积较大钙化斑块和混合斑块;f:回旋支近段钙化斑块和软斑块,局部管腔重度狭窄;g:女,47岁。反复胸闷心悸不适3年。肝实质平均CT值为54 Hu;h/i:左冠状动脉前降支近段软斑块,其内见斑点钙化,管腔轻度狭窄
2.2 三组心脏CT检测指标比较 在168例NAFLD患者中,发现无冠状动脉斑块76例,存在冠状动脉斑块但不符合HRP者48例和HRP 44例。三组EATV、EAT CT值、PATV、PAT CT值、HFF和肝脏CT值等差异具有统计学意义(P<0.05,表1)。
2.3 三组临床指标比较 三组吸烟史、合并高血压、糖尿病、HDL、TG、TC、NLR和Framingham危险评分等差异具有统计学意义(P<0.05,表2)。
2.4 两组冠状动脉斑块资料比较 HRP阴性组与HRP组冠状动脉狭窄、低密度斑块、点状钙化斑块、重构指数和餐巾环征等差异具有统计学意义(P<0.05,表3)。

表1 三组心脏CT检测指标比较
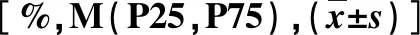
表2 三组临床指标比较
3 讨论
一般认为,HRP的存在预示着急性冠脉综合征的发生。准确识别HRP高危人群有利于早期临床干预,降低重大心脏不良事件的发生。多种心血管危险因素与HRP独立相关,如吸烟、糖尿病和血管炎症等。肝脏脂肪沉积可能参与了EAT的蓄积。
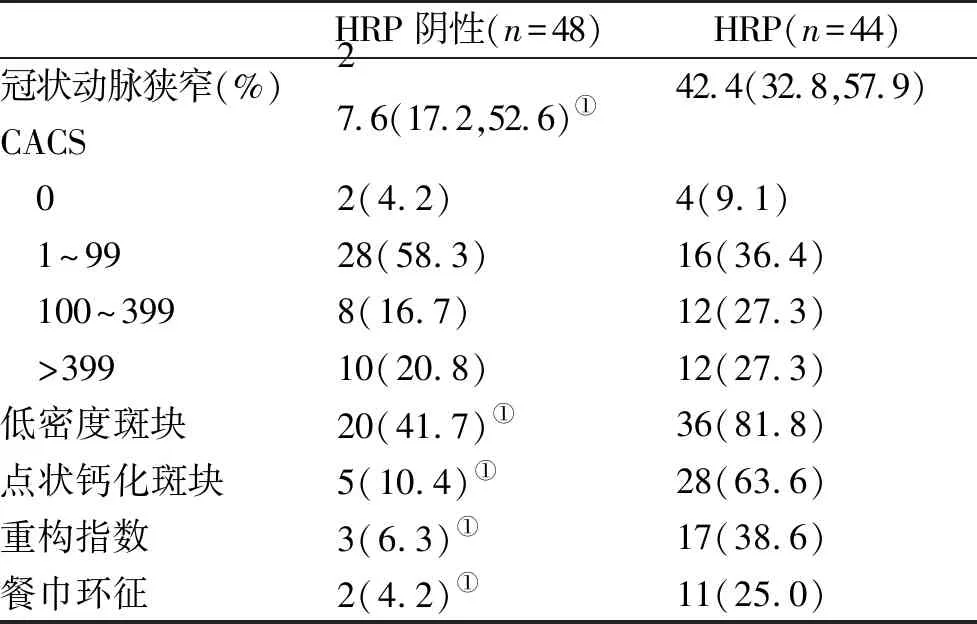
表3 两组冠状动脉斑块资料【%,M(P25,P75)】比较
PAT是EAT的一部分,与冠状动脉直接接触,通过血管分泌和旁分泌作用,释放多种炎性细胞因子和血管活性介质,如肿瘤坏死因子α、白细胞介素6、白细胞介素7和血管紧张素,引起冠状动脉内皮细胞功能障碍,影响动脉粥样硬化的脂质代谢。这些变化可能会增加NAFLD患者动脉粥样硬化易感性,并推动斑块不稳定性的进展[15]。HRP患者冠状动脉更易发生严重钙化和梗阻性病变,HRP患者冠状动脉狭窄更为严重[16]。
超声或传统CT检查对轻中度脂肪变性的NAFLD患者诊断敏感性差[17]。本研究在Syngo.via工作站基于双能CT基物质分解算法自动计算NAFLD患者HFF,从而实现CT增强检查对肝脏脂肪的定量测定。双能CT测定对肝脏脂肪具有较好的诊断价值[18-19]。

