乙型肝炎病毒全x蛋白体外诱导肝星状细胞炎症反应并促进肝细胞凋亡*
何亚娟,王 飞,姚耐娟,吴宇超,田 臻
乙型肝炎病毒相关性慢加急性肝衰竭(HBV-related acute-on-chronic liver failure, HBV-ACLF)是肝衰竭的主要类型[1,2]。慢性乙型肝炎(CHB)患者HBV再激活是HBV-ACLF的主要诱因[3]。在多种肝脏疾病发病过程中,肝星状细胞(hepatic stellate cells,HSCs)被激活促进了疾病进展。特异性清除小鼠HSCs能有效抑制肝癌和自身免疫性肝病疾病进程[4, 5]。本课题组研究发现应用脂多糖(lipopolysaccharide,LPS)能抑制线粒体自噬,同时激活HSCs的核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎症小体,诱发炎症反应,参与肝衰竭的发病过程[6]。HBV DNA和HBx能够诱导HSCs活化,活化的HSCs分泌多种细胞外基质,参与肝纤维化发病过程[7, 8]。本课题组在前期对HBV基因组进行系统性研究时发现,在HBx 基因序列前存在一段序列(AY455709),被称为HBV的前x(pre-x)序列。Pre-x全长为168 bp,编码56个氨基酸(AAR20696.1)。Pre-x基因与经典x基因共同表达全x蛋白(hepatitis B whole x,HBwx)[9, 10]。HBwx是否参与、如何参与了HBV-ACLF的发病过程并无相关研究。本研究向LX2细胞转染HBwx质粒,检测LX2细胞自噬和炎症反应,同时检测HSCs炎症对HL-7702细胞凋亡的影响,旨在探究HBwx和HSCs在HBV-ACLF发病过程中的作用,为HBV-ACLF的治疗研究提供新的思路和实验依据。
1 材料与方法
1.1 材料 LPS购于美国Sigma公司,Annexin V-PI凋亡试剂盒购于美国BD公司,抗-p62、抗-LC3、抗-NLRP3和抗-pro-IL抗体购自美国Cell Signaling Technology公司,抗-HBwx多克隆抗体由本课题组构建[8, 9],检测IL-1β的 ELISA试剂盒购于美国R&D SYSTERM公司。
1.2 LX2细胞和HL7702细胞培养 取人肝星状细胞系LX2细胞和人肝细胞系HL7702细胞,接种于含10%胎牛血清和抗生素的DMEM培养基,置于37℃、5% CO2、95%湿度的孵育箱中传代培养。取生长状态良好的对数生长期细胞接种于6孔板。将LX2细胞分为对照组、LPS处理组、转染HBwx组和LPS联合转染HBwx组。在HBwx组和LPS联合HBwx组,转染HBwx质粒。在LPS处理组和LPS联合HBwx组细胞,用1 μg/mL LPS作用4 h。采用Western blot法检测各组细胞p62、LC3、NLRP3和pro-IL1表达,采用ELISA法检测培养上清IL-1β。重复上述实验,LPS作用LX2细胞4 h,用PBS洗涤细胞3次,更换培养基继续培养24 h,收取培养基备用;将HL7702细胞分为对照组、LPS组、HBwx组和LPS联合HBwx组,各组分别加入收取的培养基作用12 h,收集HL7702细胞,使用流式细胞仪检测细胞凋亡。
1.3 HBwx质粒转染LX2细胞 HBwx质粒由本课题组构建[9, 10]。利用X-tremeGENE HP DNA Transfection Reagent将重组质粒转染入LX2细胞,按2×104cells/每孔密度将生长良好的LX2细胞接种于6孔板,待其生长密度达到 50%~70%融合度时,进行转染。将X-tremeGENE HP DNA Transfection Reagent、HBwx质粒和DMEM培养基室温放置10 min,平衡至15℃~25℃,向200 μL无血清DMEM培养基中加入1.5 μL X-tremeGENE HP DNA Transfection Reagent和0.5 μg HBwx质粒,混合均匀,室温孵育20 min。向每孔加入450 μL无血清DMEM培养基,将上面的混合物50 μL加入孔中,置于37℃、5% CO2培养箱中培养6 h,更换为含10% FBS的DMEM培养基继续培养48 h,继续后续实验。
1.4 细胞凋亡检测 用0.25%胰蛋白酶消化HL7702细胞,制成单细胞悬液,用PBS漂洗,重悬在1×结合缓冲液中,调细胞密度为1×106个/mL,用5 μL Annexin V-FITC和1×结合缓冲液室温孵育15 min。加入400 μL 1×结合缓冲液和5 μL PI工作液,置于冰上,上流式细胞仪检测细胞凋亡。
1.5 细胞HBwx表达检测 将已爬好LX2细胞(转染HBwx)的玻片用PBS浸洗3次,每次3 min,用4%多聚甲醛固定15 min;PBS浸洗3次,每次3 min,用0.5% TritonX-100室温通透20 min;PBS浸洗3次,每次3 min,用吸水纸吸干PBS,在玻片上滴加正常山羊血清,室温封闭30 min;用吸水纸吸干封闭液,滴加足量的抗-HBwx(1: 50)并放入湿盒,4 ℃孵育过夜;PBST 浸洗3次,每次3 min,用吸水纸吸干PBST,滴加稀释好的荧光二抗,湿盒中37 ℃孵育1 h;PBST浸洗3次,每次3 min,滴加DAPI避光孵育5 min;PBST 浸洗3次,每次5 min,用吸水纸吸干PBST,用含抗荧光淬灭剂的封片液封片。然后,在荧光显微镜下观察和采集图像。
1.6 细胞蛋白检测 采用Western blot 法,用蛋白质抽提剂按步骤提取LX2细胞总蛋白,行SDS凝胶电泳,采用半干法转膜50 min转至PVDF膜,分别加入兔抗大鼠p62、LC3、NLRP3和pro-IL1单克隆抗体或抗HBwx多克隆抗体,4℃孵育过夜,应用羊抗兔IgG孵育1.5 h,用ECL发光液孵育1 min后压X光片,显影。

2 结果
2.1 LX2细胞转染并表达HBwx 用HBwx质粒转染LX2细胞,在转染48 h后分别以免疫荧光和Western Blot法检测HBwx表达,结果发现HBwx定位于LX2细胞细胞质,如图中绿色荧光所示(图1A);Western blot检测结果发现,与对照组比,HBwx质粒转染LX2细胞表达HBwx蛋白(图1B)。

图1 LX2细胞表达HBwxA:免疫荧光检测LX2细胞HBwx表达,经HBwx质粒转染LX2细胞48 h,结果HBwx定位于细胞质,表现为绿色荧光;B:经HBwx质粒转染细胞48 h,Western blot检测发现LX2细胞表达HBwx蛋白
2.2 HBwx抑制LX2细胞自噬和促进细胞NLRP3炎症小体活化情况 与正常组比,LPS组、HBwx组和LPS联合HBwx组自噬相关蛋白LC3表达显著减低,而p62表达显著增强(P<0.05);与LPS组或HBwx组比,LPS联合HBwx组自噬相关蛋白LC3表达进一步减低,而p62表达进一步增强(P<0.05,图2A、图2B);与正常组比,LPS组、HBwx组和LPS联合HBwx组炎症相关蛋白NLRP3和pro-IL1表达显著增强(P<0.05);与LPS组或HBwx组比,LPS联合HBwx组炎症相关蛋白NLRP3和pro-IL表达进一步增强(P<0.05,图2A、图2C);与正常组比,LPS组、HBwx组和LPS联合HBwx组IL-1β分泌显著增多(P<0.05);与LPS组或HBwx组比,LPS联合HBwx组IL-1β分泌进一步增多(P<0.05,图2D)。
2.3 HBwx促进HSCs炎症反应和促进HL-7702细胞凋亡 与正常组比,LPS、HBwx和LPS联合HBwx处理HL-7702细胞凋亡水平显著增强(P<0.05);与LPS组或HBwx组比,LPS联合HBwx处理HL-7702细胞凋亡水平进一步增强(P<0.05,图3A、图3 B)。
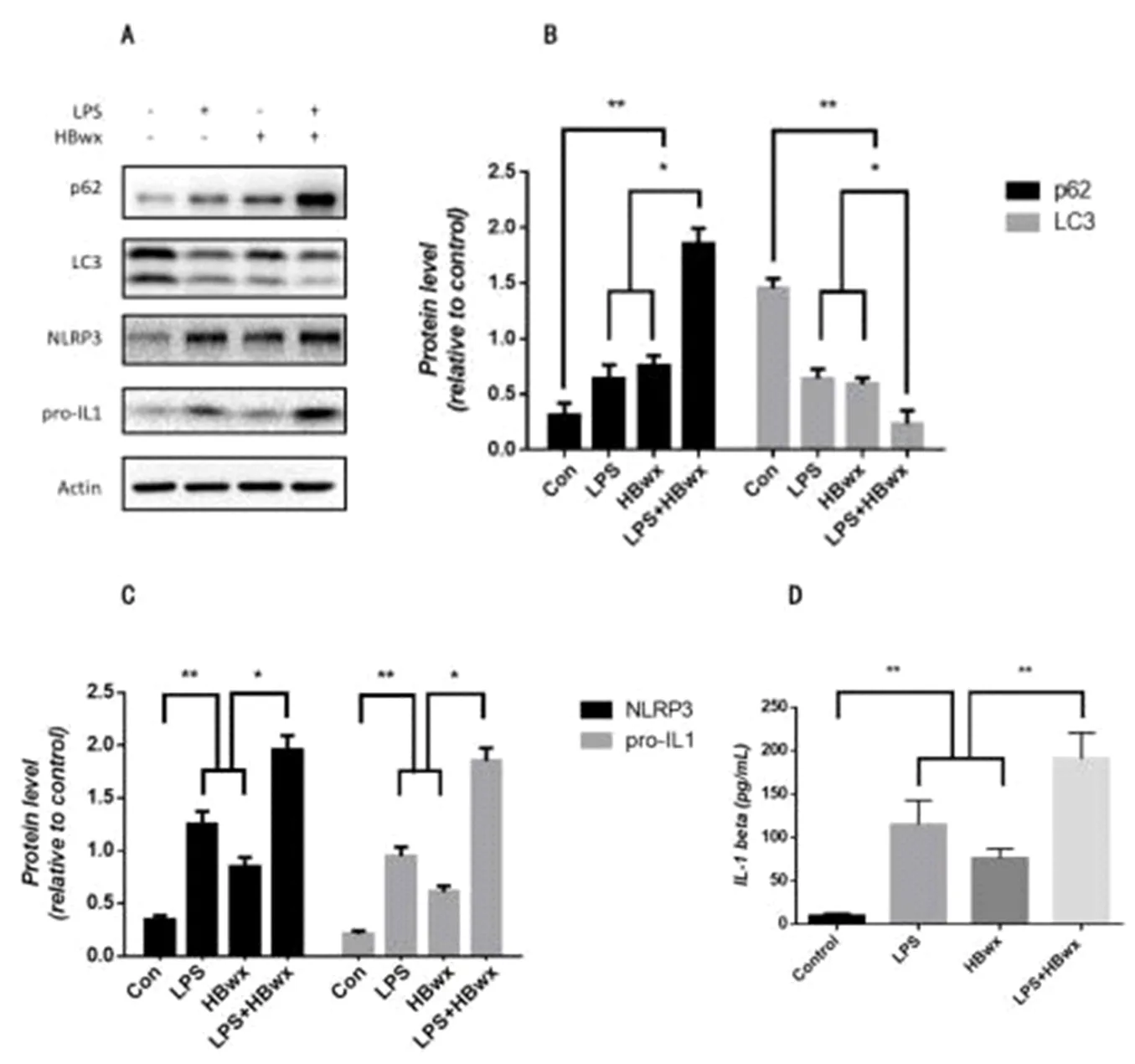
图2 HBwx抑制LX2细胞自噬和促进NLRP3炎症小体活化与正常组比,**P<0.01;与LPS联合HBwx组比,*P<0.05A、B:与正常组比,LPS组、HBwx组和LPS联合HBwx组LC3表达显著减低,而p62表达显著增强;与LPS组和HBwx组比,LPS联合HBwx组LC3表达进一步减低,而p62表达进一步增强;A、C:与正常组比,LPS组、HBwx组和LPS联合HBwx组NLRP3和pro-IL1表达显著增强;与LPS组和HBwx组比,LPS联合HBwx组NLRP3和pro-IL表达进一步增强;D:与正常组比,LPS组、HBwx组和LPS联合HBwx组IL-1β分泌显著增高;与LPS组和HBwx组比,LPS联合HBwx组IL-1β分泌进一步增高
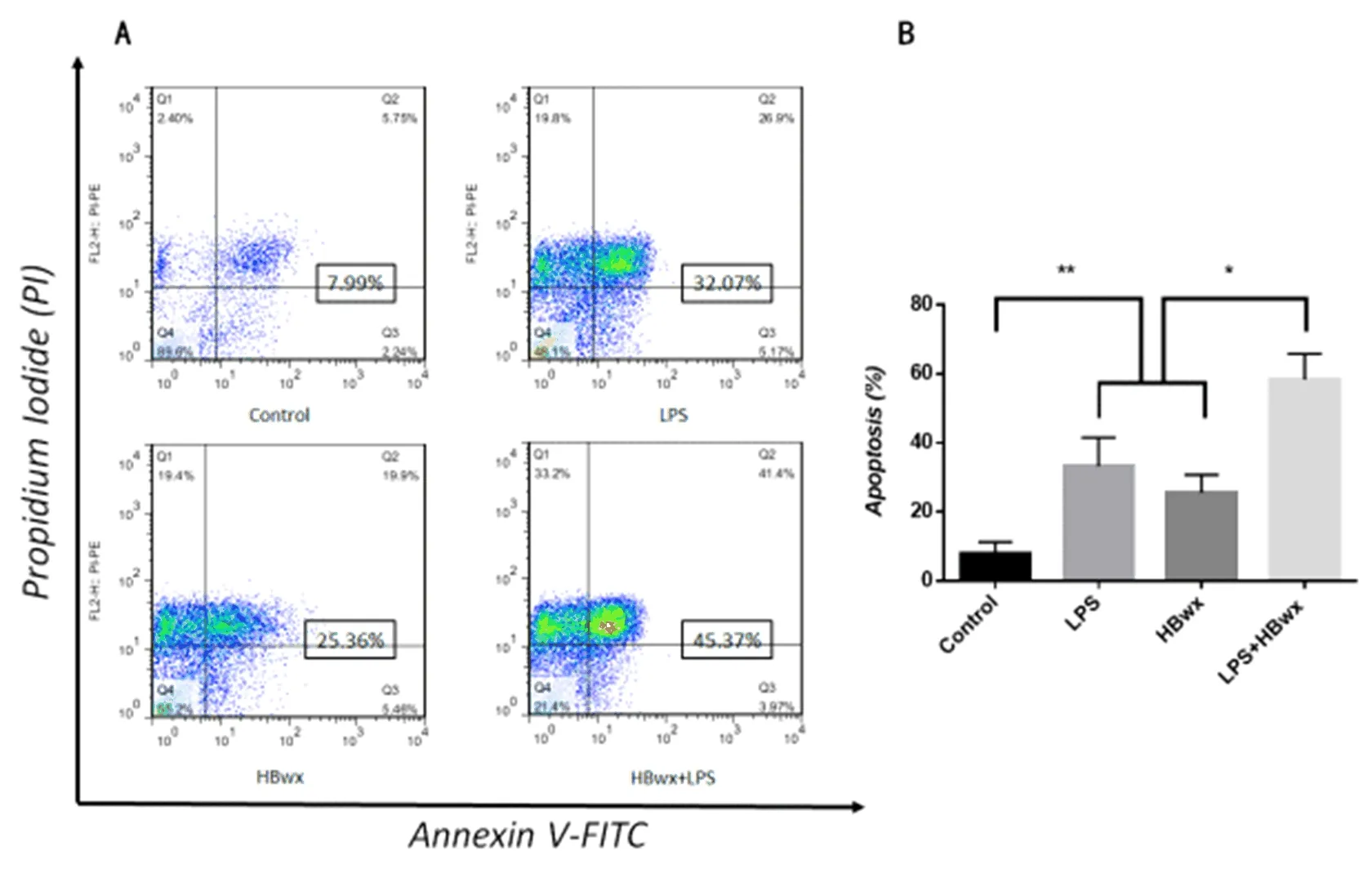
图3 四组HL-7702细胞凋亡水平比较与对照组比,**P<0.01;与LPS联合HBwx组比,*P<0.05
3 讨论
HBV-ACLF是肝衰竭的主要类型。肝衰竭患者病死率仍然较高,探究肝衰竭发病机制对制定治疗方案、提高患者生存率具有重要的意义[11, 12]。HBV可通过多种途径参与HBV-ACLF的发病过程,如HBV能够激活患者体内细胞免疫和体液免疫反应,诱导肝细胞损伤[13];HBV能够直接激活肝细胞程序性死亡,诱导细胞凋亡[14];HBx抑制肝细胞自噬,使细胞对损伤的耐受性降低,参与肝衰竭的发病进程[15]。HBwx是我们新近发现的HBV病毒蛋白, HBwx作为HBV病毒蛋白如何调节HSCs功能?本研究发现将LX2细胞转染HBwx质粒能激活NLRP3炎症小体,同时HBwx能增强LPS诱导LX2细胞炎症反应的作用,即HBwx能够增强LPS激活HSCs的NLRP3炎症小体,促进HSCs炎症反应。
既往研究发现HBx通过激活PI3K-Akt-mTOR途径诱导细胞自噬,研究同时证实自噬能够有效抑制细胞的炎症反应进程[16-18]。Pre-x基因与经典x基因共同表达HBwx,HBwx是否同样经由自噬调节HSCs炎症反应?本研究我们发现将LX2细胞转染HBwx后能抑制LC3表达,而促进p62表达,表明HBwx能够抑制LX2细胞自噬。研究同时发现HBwx能有效增强LPS抑制LC3表达和促进p62表达作用,表明HBwx增强了LPS抑制LX2细胞自噬,促进了细胞炎症反应。
HBwx作为新近发现的HBV病毒蛋白,如何通过HSCs参与肝衰竭发病过程?炎症反应在多种疾病的发病过程中发挥着重要的作用。研究证实炎症反应参与肝衰竭发病过程中的肝细胞损伤过程,并贯穿肝衰竭的始终[19, 20]。本课题组之前的研究发现HSCs炎症反应参与肝衰竭的疾病进程,本研究发现LPS和HBwx处理组HL-7702细胞凋亡水平显著高于对照组,而以LPS联合HBwx处理组细胞凋亡水平最高,炎症因子IL-1β促进HL-7702细胞凋亡可能参与了肝衰竭疾病进程。
本研究发现炎症介质LPS能够诱发HSCs炎症反应,分泌炎症因子IL-1β,诱导肝细胞凋亡。HBV病毒蛋白HBwx抑制细胞自噬、增强HSCs炎症反应,进而促进肝细胞凋亡,参与细胞凋亡过程。本研究丰富了肝损伤的发病机制,但还存在一些局限性。本研究只是发现HBwx抑制自噬、促进HSCs炎症反应,并未深入探究HBwx抑制自噬和促进HSCs炎症反应的分子学机制,后续实验将着重深入探究其内在的机制。
——一道江苏高考题的奥秘解读和拓展

