远红光补光对辣椒幼苗生长和非生物胁迫抗性的影响
董桑婕,姜小春,王羚羽,林锐,齐振宇,喻景权,周艳虹
远红光补光对辣椒幼苗生长和非生物胁迫抗性的影响
董桑婕1,姜小春1,王羚羽1,林锐1,齐振宇2,喻景权1,周艳虹1*
1浙江大学农业与生物技术学院/农业部园艺植物生长发育重点实验室,杭州 310058;2浙江大学农业试验站,杭州 310058
【目的】研究补照适量远红光(FR)对辣椒幼苗生长发育和非生物胁迫抗性的调控作用,旨在为实际生产过程中利用精确的光环境调控手段培育壮苗提供理论依据。【方法】以辣椒‘博辣红帅’品种为研究材料,将苗龄7 d的辣椒幼苗置于LED光源对照光谱(NL;红R/蓝B=3/1,光量子通量密度PPFD为150 μmol·m-2·s-1)及在此基础上分别补充10 μmol·m-2·s-1远红光(6% FR)、20 μmol·m-2·s-1远红光(13% FR)和30 μmol·m-2·s-1远红光(20% FR)的处理组光谱环境条件下培养,并于苗龄21 d时进行低温和干旱处理。通过测定生物量、抗性相关基因表达、抗氧化酶活性、激素含量、叶绿素荧光参数以及叶片相对电导率等,探究补充6% FR对辣椒幼苗生长和非生物胁迫抗性的影响。【结果】与对照光谱相比,补充6% FR显著提高了辣椒幼苗株高、茎粗、干鲜重以及壮苗指数(<0.05)。低温胁迫下,相比于对照光谱组,补充6% FR显著提高了辣椒叶片冷响应基因和抗氧化酶相关基因、、的表达水平,超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、脱氢抗坏血酸还原酶(DHAR)、过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)活性比对照分别增加25.2%、53.6%、55.8%、72.7%和33.4%,抗逆相关激素脱落酸(ABA)的含量提高69.5%。同时,低温胁迫下补充6% FR后辣椒叶片PSII最大光化学效率(Fv/Fm)较对照光谱组显著升高,而相对电导率(REL)显著降低,表明补充6% FR缓解了低温下PSII光抑制和叶片细胞的损伤,提高了辣椒幼苗的耐冷性。此外,干旱胁迫下,相比于对照光谱组,补充6% FR使辣椒幼苗的抗氧化酶SOD、GR、APX、CAT、DHAR活性分别增加13.7%、38.0%、37.2%、27.6%和23.7%,ABA含量和PSII实际光化学效率(ΦPSII)也显著升高,而REL则明显降低,表明补充6% FR减轻了干旱胁迫引起的PSII光抑制和膜脂过氧化,提高了辣椒幼苗的耐旱性。【结论】补充6% FR不仅可促使辣椒壮苗的形成,还可通过增加抗氧化酶活性和ABA含量提高辣椒幼苗对低温胁迫和干旱胁迫的抗性。
辣椒;远红光;壮苗指数;低温胁迫;干旱胁迫
0 引言
【研究意义】光是维持植物生长所必须的环境因子,它既能为植物提供光合作用所需能量,也能作为一种环境信号调控植物的生长发育,其中,光质作为光环境的重要特性对植物的生长发育至关重要[1-3]。近年来,利用全人工光照的植物工厂育苗技术实现了作物的大规模、标准化优质育苗生产,极大地提高了作物的产量、品质以及生产力[4]。其中,发光二极管(LED)作为补光光源不仅具有寿命长、耗能低的特点,还可实现对特定的功能光谱进行组合,以满足作物生长发育对光的需求[5-7]。因此,基于植物需求的LED光源光谱构成的优化对于提高蔬菜作物生产效率具有重要意义。【前人研究进展】植物通过光受体光敏色素感知生长环境中动态变化的红光(R)和远红光(FR)光质信号,从而调控植物形态建成、逆境抗性等生理过程。在番茄中已发现有5种光敏色素(PHYA、PHYB1、PHYB2、PHYE和PHYF)参与光质信号调控生长发育进程,其中,FR受体PHYA和R受体PHYB1/B2最为重要[8]。目前,利用光谱成分中R和FR比值(R/FR)的变化来调节设施作物生长发育的研究备受关注。研究表明,高比例R/FR会导致植株节间距变小、植株矮化;低比例R/FR会导致植物节间伸长、株高增加、叶面积增加、叶绿素含量降低[9-11]。此外,光质对植物的抗逆生理也起到调控作用[12]。张晓梅等[13]的研究结果显示,与其他单色光处理相比,R可以显著降低干旱条件下黄瓜的失水率,同时增加SOD、CAT以及G-POD的活性,从而提高黄瓜的干旱抗性。在低温胁迫响应过程中,R可以提高草莓叶片可溶性糖含量,抑制丙二醛的积累,蓝光(B)有助于脯氨酸和可溶性蛋白的增加,因此,适当的补充R、B有利于草莓植株抗寒性的提高[14]。而在番茄中,低比例R/FR会促进ABA和JA的生物合成,并激活CBF信号通路,从而提高番茄的低温抗性[15]。辣椒是我国设施栽培的主要蔬菜种类,与番茄同属于茄科,不耐低温和旱涝,尤其对苗期的温度和水分管理的要求较高,然而光质对其生长和逆境适应性的调控作用尚不清晰。【本研究切入点】尽管已有大量研究揭示红蓝光对植株生物量、产量以及品质的调控作用[16-17],但关于光质信号调控植物非生物逆境抗性方面的研究却较少。光质调控作物生长-抗性平衡的作用机制是目前亟待解决的重要科学问题,这对于保障作物优质高产具有重要意义。【拟解决的关键问题】本研究旨在探讨辣椒苗期适宜的LED光谱构成,以期利用光质调控的方法提高辣椒幼苗的壮苗指数,并增强其对低温和干旱胁迫的抗性,为保障辣椒的优质高产奠定基础。
1 材料与方法
试验于2019—2020年在浙江大学蔬菜研究所进行。
1.1 试验材料与处理
供试辣椒品种为‘博辣红帅’(L.Bola Hongshuai)。将辣椒种子置于150 mL锥形瓶,55℃温水浸泡20 min,然后放在200 r/min的摇床上28℃催芽4 d左右,其间每天更换2次水。催芽结束后选取出芽长度基本一致的种子,播种于50孔穴盘中,每周浇3次Hoagland营养液。
光质处理:待辣椒子叶伸展,将7 d苗龄幼苗置于光质生长室进行不同光质处理,调节光源和幼苗之间的距离使光量子通量密度(PPFD)保持在150 μmol∙m-2∙s-1,设置如下:对照,不补光(NL;R﹕B=3﹕1),具体光谱图见图1;补充10 μmol∙m-2∙s-1远红光(6% FR);补充20 μmol∙m-2∙s-1远红光(13% FR);补充30 μmol∙m-2∙s-1远红光(20% FR)。其中,R、B和FR的主波长分别为660、450和730 nm。幼苗生长光周期为8:00—20:00,温度为25℃,相对湿度为70%。试验共3个处理组,每个处理组设3次重复,每50株为一个重复,共150株。
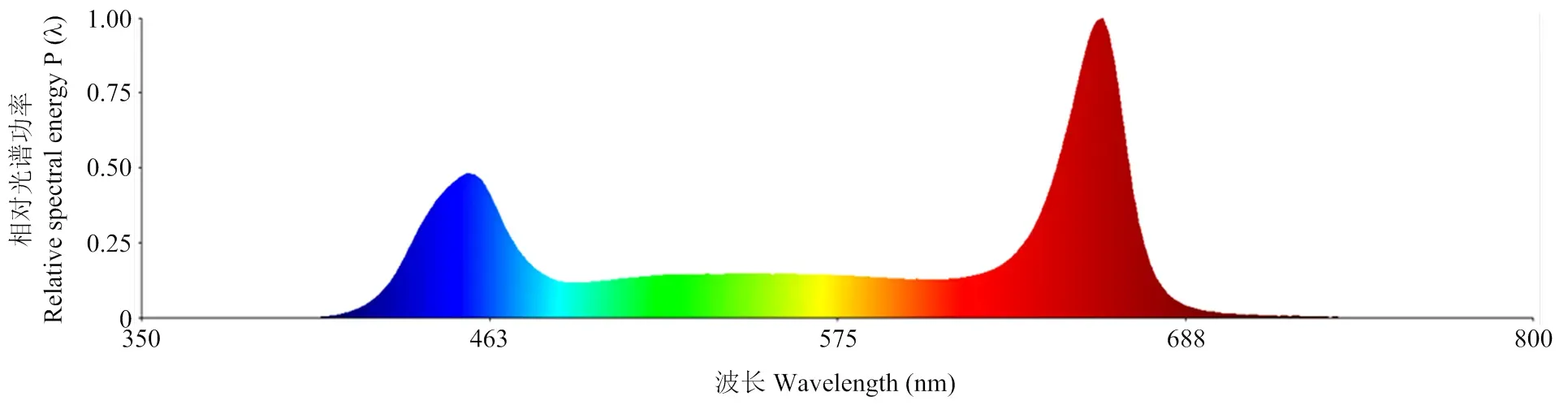
图1 试验所用LED灯的相对光谱曲线
低温处理:将苗龄为21 d的辣椒幼苗移至12孔穴盘(3×4)中,缓苗3 d后于人工气候箱(浙江求是)内进行低温和光质共处理。温度处理分别为25℃和6℃,光环境条件分别为自然光(NL)和补充6% FR。光周期为12 h,环境湿度为85%。低温处理至幼苗出现明显的胁迫表型(7 d)。试验共3个处理组,每个处理组设3次重复,每12株为一个重复,共36株。
干旱处理:在光环境条件分别为NL和补充6% FR的情况下,将苗龄为21 d的辣椒幼苗移至12孔穴盘(3×4)中,缓苗3 d后对每组光质处理的辣椒幼苗进行平均分组,分为正常浇水(Control)和干旱胁迫(Drought)。于干旱胁迫处理前浇透水,之后正常浇水的处理组每2—3 d浇水一次,干旱胁迫的处理组不再浇水,直至幼苗出现明显的胁迫表型(7 d)。处理7 d后,对照组和处理组的基质绝对含水量分别为35%和10%。干旱处理试验共3个处理组,每个处理组设3次重复,每12株为一个重复,共36株。
1.2 测量项目及方法
1.2.1 生物量测定 幼苗期不同光质处理21 d后测
定各项生长指标,包括株高、茎粗、第一节间距、下胚轴长度、叶片数、鲜重、干重。对每个处理称量鲜重后,用105℃杀青30 min,然后在65℃下烘干至恒重。计算幼苗壮苗指数,计算公式为:
壮苗指数=(茎粗/株高+地下部干重/地上部干重)×全株干重
1.2.2 叶绿素荧光参数分析 低温和干旱处理7 d后,将辣椒植株进行30 min暗处理,选取相同叶位的功能叶,使用Imaging-PAM叶绿素荧光仪(IMAGMAX1,Heinz Walz,Effeltrich,Germay)测定PSII最大光化学效率(Fv/Fm)和PSII实际光化学效率(ΦPSII),具体方法参考Jiang等[18]。
1.2.3 相对电导率(REL)测定 低温和干旱处理7 d后,测定辣椒叶片的相对电导率,具体方法参考ZHANG等[19]。
1.2.4 抗氧化酶活性测定 低温处理1 d和干旱处理3 d后,精确称取0.5 g叶样,测定根据XIA等[20]的具体方法。
1.2.5 ABA含量的测定 低温处理1 d和干旱处理3 d后,精确称取0.1 g的叶片于液氮中冷冻,具体测定参考王峰[21]的方法。
1.2.6 总RNA提取和实时荧光定量PCR(RT-qPCR)分析 低温处理6 h后,取RNA样存于-80℃中待用,具体参考JIANG等[18]的方法,使用辣椒泛素连接蛋白基因作为内参基因,基因相对表达量的计算采用LIVAK等[22]的方法,引物见表1。
1.3 统计分析
试验采取随机区组设计,随机取样,进行3次重复。试验数据采用SPSS20进行ANOVA分析,不同处理之间差异采用Tukey检测,不同的字母表示显著性差异(<0.05)。

表1 实时荧光定量PCR引物
2 结果
2.1 补充不同比例FR对辣椒幼苗生长及生物量的影响
由图2和表2可发现,与对照光谱相比,补充6% FR显著提高了辣椒幼苗的株高、茎粗、干/鲜重以及壮苗指数(<0.05),且对辣椒幼苗的第一节间距和下胚轴长度没有显著影响;其中,总鲜重和总干重分别较对照组增加了26.2%和20.7%,壮苗指数较对照组增加41.5%。而补充13% FR以及20% FR则易造成幼苗的株高、节间距、下胚轴增长,产生幼苗徒长现象,对于辣椒壮苗的形成具有抑制作用。因此,在辣椒幼苗期补充6% FR能够在不影响辣椒幼苗下胚轴长度的情况提高幼苗的生物量和壮苗指数,有利于壮苗的培育。

图2 补充6% FR对辣椒幼苗表型的影响
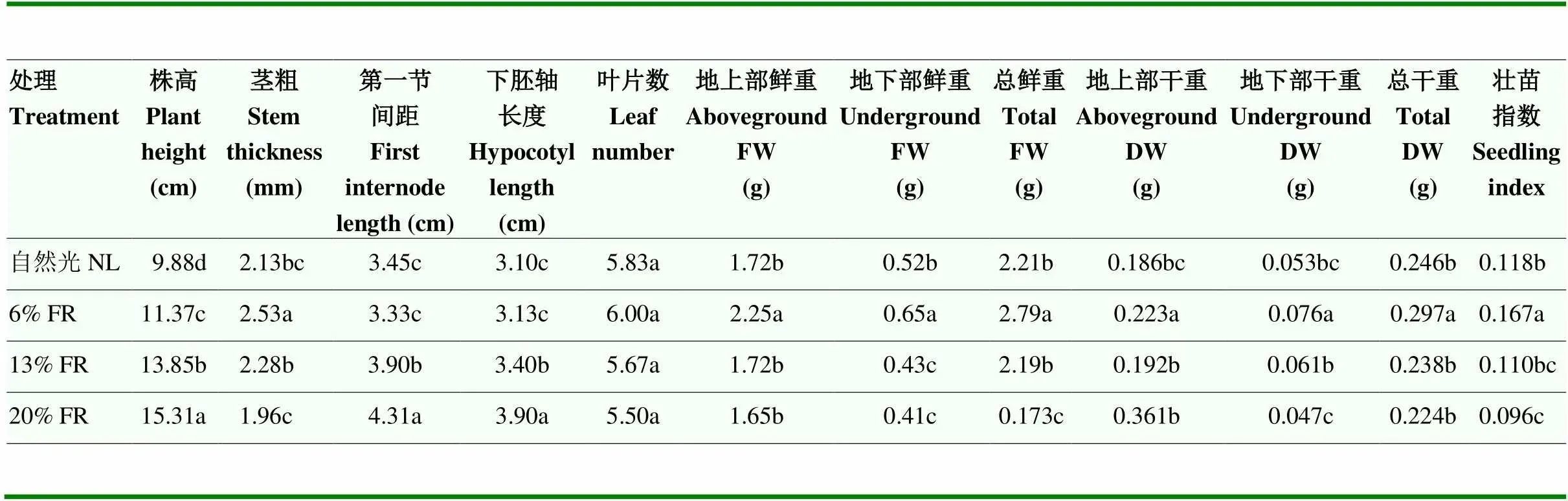
表2 补充FR对辣椒幼苗生长和生物量的影响
不同小写字母代表显著性差异(<0.05)。下同 Different lowercase letters indicate significant differences (<0.05).The same as below
2.2 补充6% FR对辣椒幼苗低温抗性的影响
2.2.1 对辣椒幼苗低温胁迫相关基因表达的影响 研究表明,冷响应基因显著受低温胁迫诱导表达,从而在提高植物的低温胁迫抗性中发挥重要作用[23]。本试验结果显示,低温处理6 h后,在对照光谱条件下低温显著诱导了冷响应基因及抗氧化酶相关基因、、、、的表达,而在补充6% FR条件下低温对这些基因表达
水平的诱导效果更加显著(图3)。
2.2.2 对低温胁迫下辣椒幼苗抗氧化酶活性及ABA含量的影响 与低温胁迫相关基因表达结果相一致,补充6% FR能显著提高抗氧化酶SOD、APX、DHAR、CAT和GR的活性,与低温对照光谱组相比,它们的活性分别增加约25.2%、53.6%、55.8%、72.7%和33.4%(图4)(<0.05)。此外,与植物抗逆密切相关的内源激素ABA也在低温伴随补充6% FR条件下被诱导出更高的积累水平(图4),比低温对照光谱组高69.5%;而在常温条件下,补充6% FR则不能引起这些参数的显著变化。
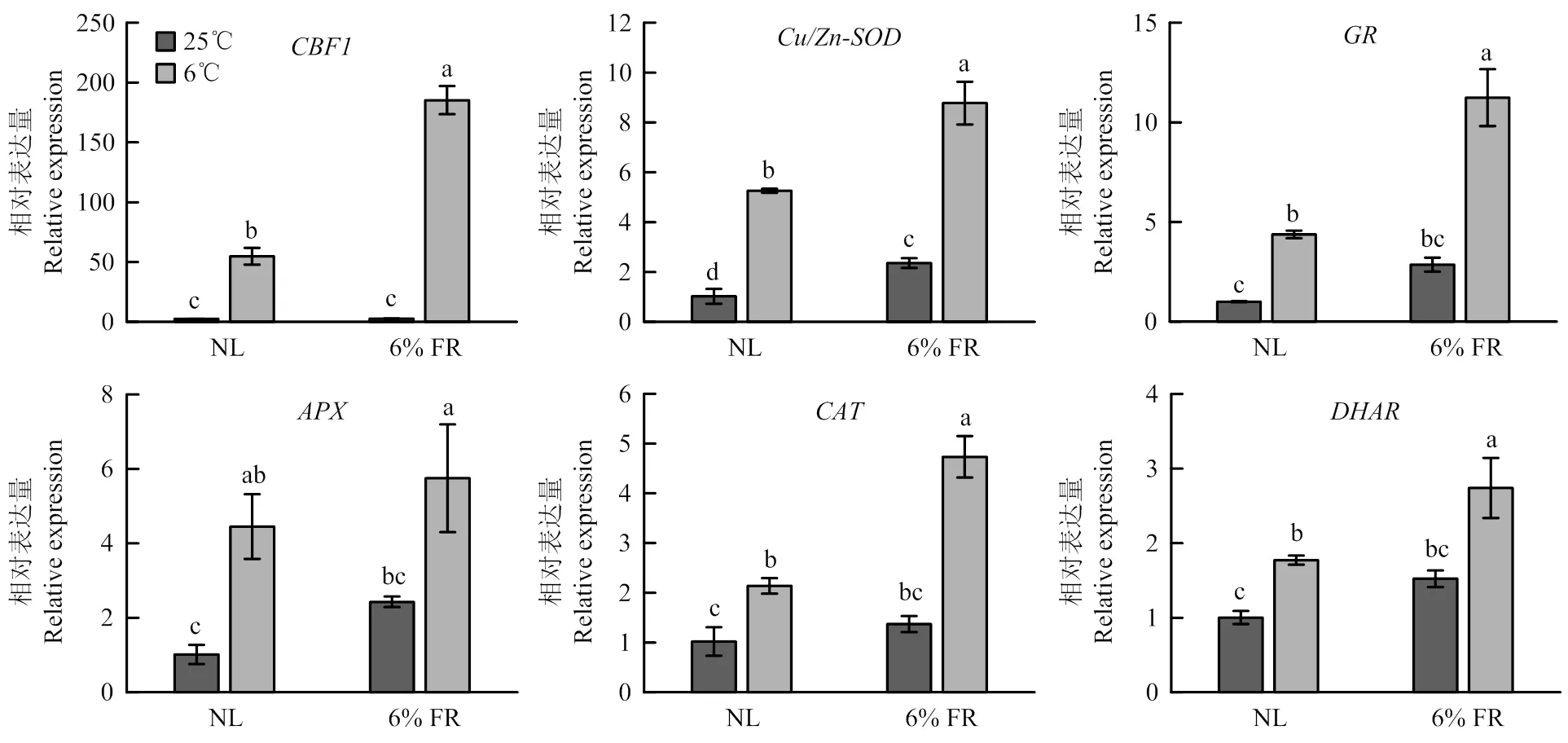
图3 补充6% FR对低温胁迫下辣椒幼苗CBF1及抗氧化酶相关基因表达的影响
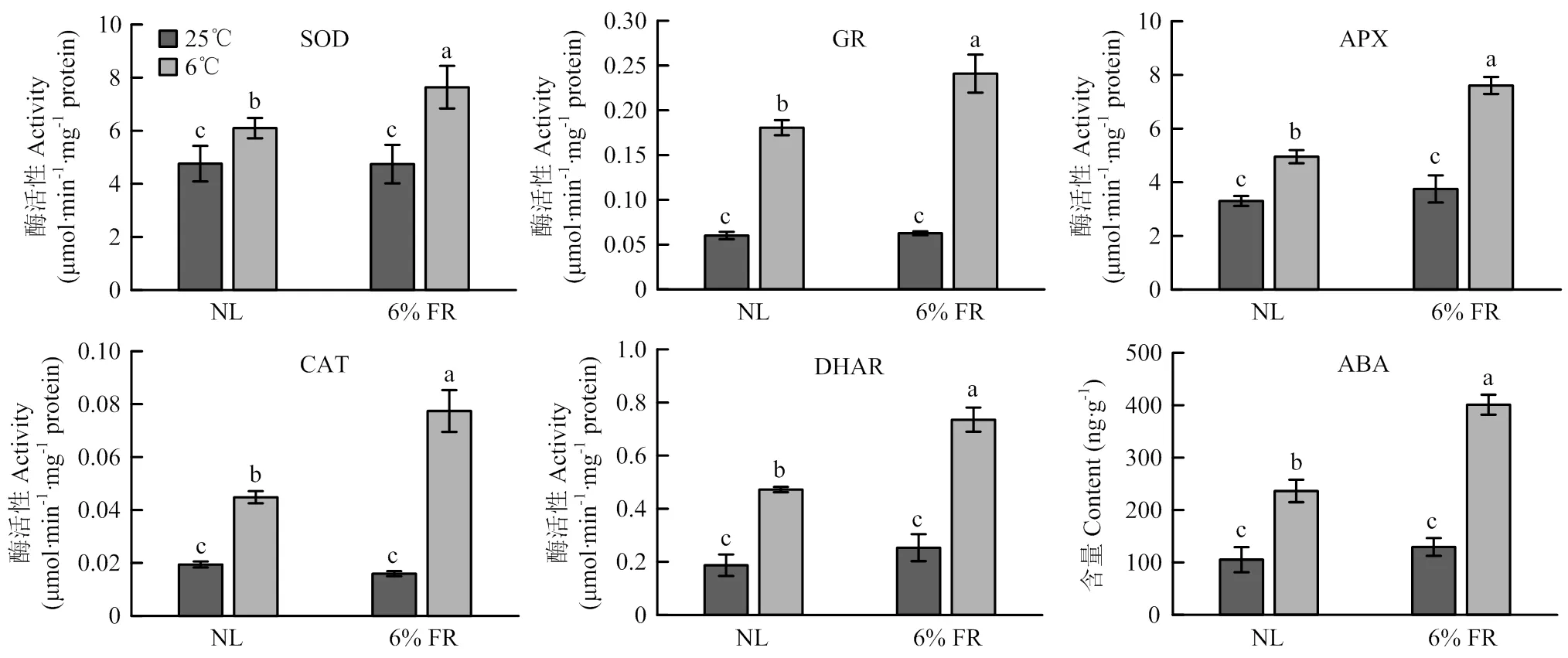
图4 补充6% FR对低温胁迫下辣椒幼苗抗氧化酶活性和ABA含量的影响
2.2.3 对低温胁迫下辣椒幼苗表型、Fv/Fm和REL的影响 低温耦合正常光谱下生长的辣椒幼苗叶片萎焉且边缘卷曲,表现出明显的冷害症状,而补充6% FR的辣椒幼苗的冷害症状则明显得到缓解(图5-A、B)。进一步分析辣椒植株叶片的Fv/Fm与REL发现,补充6% FR不仅能有效抑制低温胁迫引起的辣椒叶片Fv/Fm的下降,还能显著抑制低温胁迫引起REL的升高(图5-C、D)。以上结果表明,适当补充FR能有效提高辣椒幼苗对低温胁迫的耐受性。

图5 补充6% FR对低温胁迫下辣椒幼苗表型、Fv/Fm及REL的影响
2.3 补充6% FR对辣椒幼苗干旱抗性的影响
2.3.1 对干旱胁迫下辣椒幼苗抗氧化酶活性和ABA含量的影响 为了探明补充6% FR对辣椒幼苗干旱胁迫抗性的调控作用,本试验对辣椒幼苗进行了干旱和光质共同处理7 d。由图6可见,在正常供水条件下,补充6% FR对辣椒幼苗的抗氧化酶活性没有显著影响,但在干旱条件下,与正常光谱组相比,补照6% FR后辣椒叶片中SOD、GR、APX、CAT和DHAR的活性分别增加约13.7%、38.0%、37.2%、27.6%和23.7%,表明补充6% FR显著增强了辣椒叶片中抗氧化酶的活性(图6)(<0.05)。此外,ABA作为参与调控植物干旱胁迫抗性的重要激素,在干旱条件下,补照6% FR也能显著增加其在辣椒叶片中的积累(图6)。
2.3.2 对干旱胁迫下辣椒幼苗表型、ΦPSII及REL的影响 进一步分析干旱胁迫7 d后植株的抗性,与正常光谱组相比,补照6% FR能显著缓解干旱胁迫引起的辣椒叶片干枯卷曲等干旱症状,表现出更强的干旱胁迫抗性(图7-A、B)。同时,干旱胁迫下,补充6% FR的辣椒叶片ΦPSII显著高于正常光谱组对照,而REL则显著低于正常光谱组对照(图7-C、D)。因此,适当补充FR能有效提高辣椒植株耐旱性。
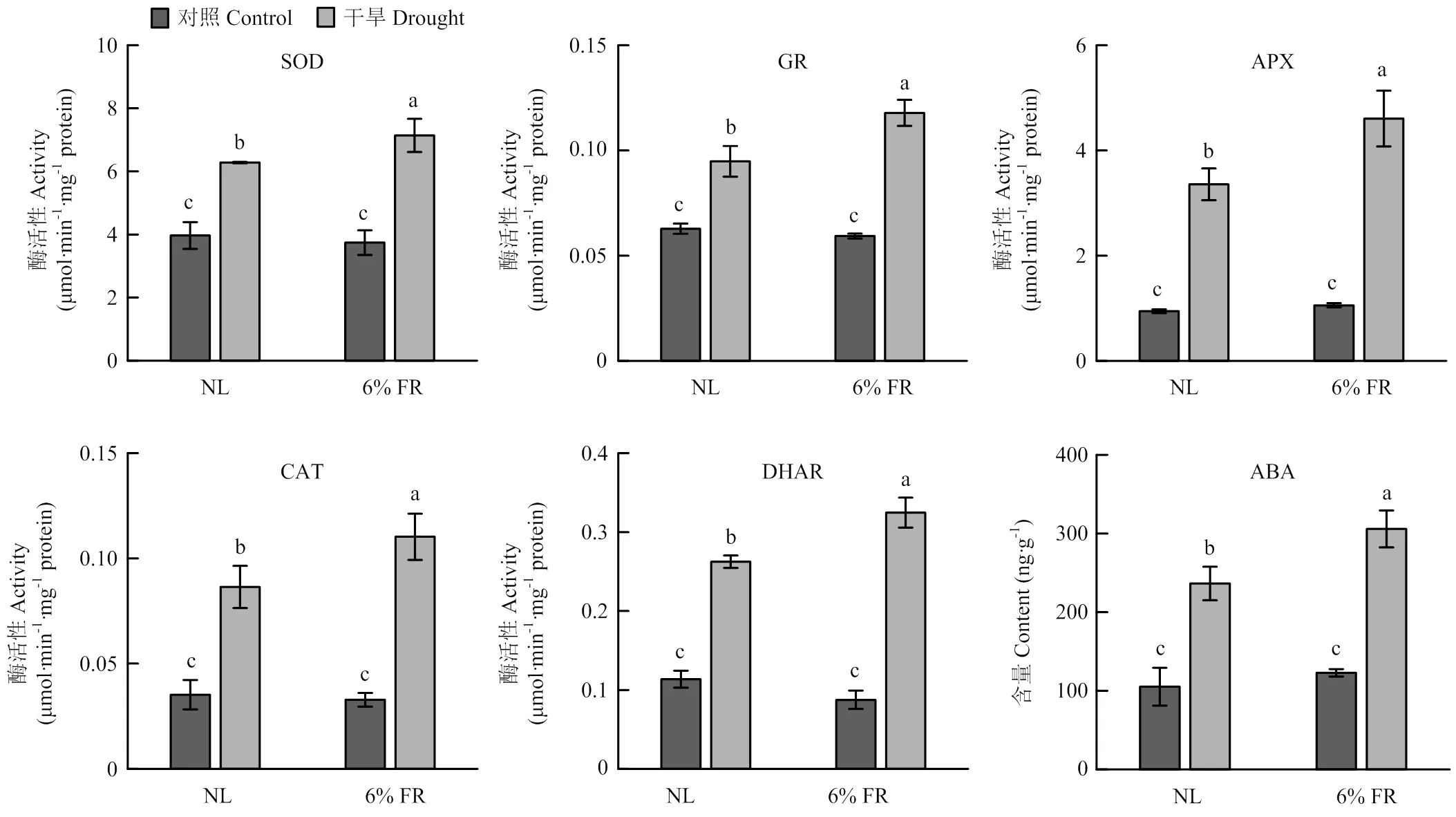
图6 补充6% FR对干旱胁迫下辣椒幼苗抗氧化酶活性和ABA含量的影响
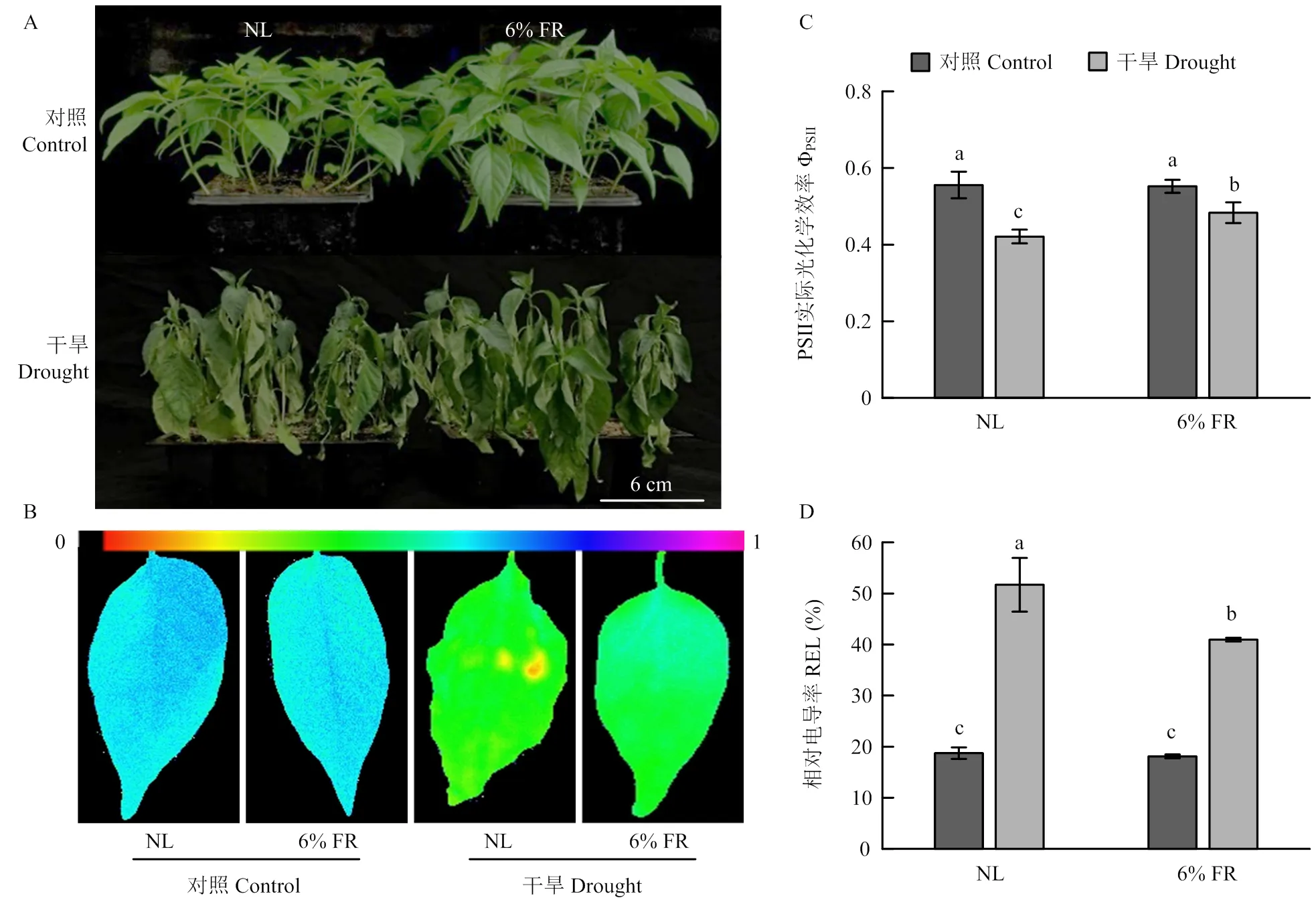
图7 补充6% FR对干旱胁迫下辣椒幼苗表型、ΦPSII及REL的影响
3 讨论
3.1 FR补光影响辣椒生长
近年来,随着光生物学的不断发展,不可见光中FR对植物生长发育的调节作用逐渐被揭示,它已被证明可以参与调控植物去黄化、伸长生长、光周期和开花等光形态建成,还能调节植物株高、节间长度、冠层幅度等植株形态建成[24-26]。此外,在自然界环境中,由于冠层树木的相互遮挡,冠层下层的R/FR比例较低,低R/FR通过调节避荫植物体内激素水平来诱导茎和叶快速伸长,以获得更好的可利用光[27]。FR诱导的这些生理效应部分或全部依赖于细胞扩张,是包括赤霉素、生长素、油菜素内酯和乙烯在内的多种植物激素的共同作用[28]。辣椒是我国设施生产中最为重要的蔬菜作物之一,光源波长组成中FR比例的变化对其生长发育和抗逆性的影响尚不清晰。本研究发现,在150 μmol∙m-2∙s-1红蓝光基础上补充10 μmol∙m-2∙s-1远红光(R/FR=3),能在不显著改变下胚轴长度的情况下增加辣椒幼苗的干鲜重,提高壮苗指数,促进壮苗的形成,这与LI等[17]研究认为补充FR可以显著促进作物干/鲜重、叶长和叶宽增加的结论基本一致。另外,在本试验中补充13% FR和20% FR会导致幼苗第一节间距显著增加,茎粗降低,壮苗指数显著减小,不利于其生长,这表明在苗期进行过量的FR处理会导致植株徒长,在实际生产中利用补照适量FR的方式提高辣椒幼苗质量是一种具有一定可行性的环境调控手段。已有研究表明,在菊花生殖生长阶段,低比例的FR(R/FR=2.5)处理显著促进菊花株高、茎粗、叶面积、叶片数、总干重、花干物质分配指数等的增加;而增加FR成分使R/FR降至0.5时,则显著增加植株的节间长度,且不利于花干物质分配[29]。该结论与本试验研究结果相似,但本研究主要集中于辣椒幼苗期的生物量以及形态指标等方面,考虑到不同发育阶段植株对于光调控的响应可能存在差异[30],可以进一步研究补充FR对辣椒整个发育进程的影响变化。
3.2 FR补光影响辣椒抗逆性
FR不仅对植物的生长发育具有调控作用,在植物的逆境抗性中也发挥着重要作用。在低温胁迫中,FR激活光受体PHYA,从而诱导ABA依赖的JA信号转导,进而激活番茄CBF途径,提高番茄植株的低温抗性[15]。干旱胁迫下,在棉花进入黑暗前补照30 min远红光,会导致其气孔阻力增大,蒸腾速率降低,进而促进植株抗旱性[31]。在对病原菌抗性的调控中,FR激活PHYA参与植物昼夜节律的调节,进而调控病原相关分子模式诱导的免疫反应[32]。与番茄中的研究结果一致,本研究发现,补充6% FR也可以激活辣椒中的CBF抗冷途径,提高辣椒叶片的ABA含量以及抗氧化酶的活性,从而缓解光系统中光抑制的发生以及叶片细胞的损伤,增强辣椒幼苗的低温胁迫抗性。前人研究表明,在番茄中,FR借助HY5和PIF4等光信号转录因子转录激活下游激素信号相关基因,从而调节番茄体内激素水平,增强低温胁迫抗性[21],这一调控机制是否也存在于辣椒中还有待进一步探究。此外,本研究还发现,与低温胁迫相似,在干旱胁迫中,补充6% FR也能有效增强辣椒叶片抗氧化酶的活性以及ABA的含量,从而缓解光抑制的发生以及叶片细胞的损伤,增强辣椒幼苗对干旱胁迫的抗性,这表明在不同的逆境胁迫中,FR对于加强有害活性氧的清除以及ABA的积累可能具有普适性。
4 结论
在红蓝组合光基础上补充6%远红光(FR),可以有效提高辣椒幼苗的生物量及壮苗指数,促进壮苗的形成;另外,补充6% FR可通过增强抗氧化酶活性和ABA的含量提高辣椒幼苗的低温胁迫和干旱胁迫抗性。
[1] JIAO Y L, LAU O S, DENG X W.Light-regulated transcriptional networks in higher plants.Nature Reviews Genetics, 2007, 8(3): 217-230.doi:10.1038/nrg2049.
[2] YAVARI N, TRIPATHI R, WU B S, MACPHERSON S, SINGH J, LEFSRUD M.The effect of light quality on plant physiology, photosynthetic, and stress response inleaves.PLoS ONE, 2021, 16(3): e0247380.doi: 10.1371/journal.pone.0247380.
[3] MUNEER S, KIM E J, PARK J S, LEE J H.Influence of green, red and blue light emitting diodes on multiprotein complex proteins and photosynthetic activity under different light intensities in lettuce leaves (L.).International Journal of Molecular Sciences, 2014, 15(3): 4657-4670.
[4] JOSHI J, ZHANG G, SHEN S Q, SUPAIBULWATANA K, WATANABE C K A, YAMORI W.A combination of downward lighting and supplemental upward lighting improves plant growth in a closed plant factory with artificial lighting.Hortscience, 2017, 52(6): 831-835.
[5] KWON S Y, RYU S H, LIM J H.Design and implementation of an integrated management system in a plant factory to save energy.Cluster Computing, 2014, 17(3): 727-740.doi: 10.1007/s10586-013- 0295-2.
[6] ZHENG L, HE H M, SONG W T.Application of light-emitting diodes and the effect of light quality on horticultural crops: A Review.Hortscience, 2019, 54(10): 1656-1661.
[7] WU B S, HITTI Y, MACPHERSON S, ORSAT V, LEFSRUD M G.Comparison and perspective of converntional and LED lighting for photobiology and industry applications.Environmental and Experimental Botany, 2020, 171: 103953.
[8] PRATT L H, CORDONNIERPRATT M M, KELMENSON P M, LAZAROVA G I, KUBOTA T, ALBA R M.The phytochrome gene family in tomato (L.).Plant Cell and Environment, 1997, 20(6): 672-677.
[9] JUAN I C, EDMUNDO P, TOMÁS B A, SCOTT A.F, JORGE J C.Stem transcriptome reveals mechanisms to reduce the energetic cost of shade-avoidance responses in tomato.Plant Physiology, 2012, 160(2): 1110-1119.
[10] DIEGO A M, JAVIER F B.Manipulation of light environment to produce high-quality poinsettia plants.Hortscience, 2009, 44(3): 702-706.
[11] KUREPIN L V, EMERY R J N, PHARIS R P, REID D M.Uncoupling light quality from light irradiance effects inshoots: putative roles for plant hormones in leaf and internode growth.Journal of Experimental Botany, 2007, 58(8): 2145-2157.doi: 10.1093/jxb/ erm068.
[12] 杨有新, 王峰, 蔡加星, 喻景权, 周艳虹.光质和光敏色素在植物逆境响应中的作用研究进展.园艺学报, 2014, 41(9): 1861-1872.
YANG Y X, WANG F, CAI J X, YU J Q, ZHOU Y H.Recent advances in the role of light quality and phytochrome in plant defense resistance against environmental stresses.Acta Horticulturae Sinica, 2014, 41(9): 1861-1872.(in Chinese)
[13] 张晓梅, 胡超轶, 刘涛, 周艳虹.不同光质对黄瓜幼苗抗旱性的影响.浙江农业学报, 2017, 29(1): 58-63.doi: 10.3969/j.issn.1004-1524.2017.01.09.
ZHANG X M, HU C Y, LIU T, ZHOU Y H.Effects of light quality on drought resistance of cucumber seedlings.Acta Agriculturae Zhejiangensis, 2017, 29(1): 58-63.doi: 10.3969/j.issn.1004-1524.2017.01.09.(in Chinese)
[14] 张云婷, 宋霞, 叶云天, 冯琛, 孙勃, 王小蓉, 汤浩茹.光质对低温胁迫下草莓叶片生理生化特性的影响.浙江农业学报, 2016, 28(5): 790-796.doi:10.3969/j.issn.1004-1524.2016.05.13.
ZHANG Y T, SONG X, YE Y T, FENG C, SUN B, WANG X R, TANG H R.Effects of light quality on physiological and biochemical indexes in strawberry leaves under low temperature stress.Acta Agriculturae Zhejiangensis, 2016, 28(5): 790-796.doi:10.3969/j.issn.1004-1524.2016.05.13.(in Chinese)
[15] WANG F, GUO Z X, LI H Z, WANG M M, ONAC E, ZHOU J, XIA X J, SHI K, YU J Q, ZHOU Y H.Phytochrome A and B function antagonistically to regulate cold tolerance via abscisic acid-dependent jasmonate signaling.Plant Physiology, 2015, 170(1): 459-471.doi: 10.1104/pp.15.01171.
[16] 刘晓英, 常涛涛, 郭世荣, 徐志刚, 陈文昊.红蓝LED光全生育期照射对樱桃番茄果实品质的影响.中国蔬菜, 2010(22): 21-27.
LIU X Y, CHANG T T, GUO S R, XU Z G, CHEN W H.Effect of irradiation with blue and red LED on fruit quality of cherry tomato during growth period.China Vegetables, 2010(22): 21-27.(in Chinese)
[17] LI Q, KUBOTA C.Effects of supplemental light quality on growth and phytochemicals of baby leaf lettuce.Environmental and Experimental Botany, 2009, 67(1): 59-64.
[18] JIANG X C, XU J, LIN R, SONG J N, SHAO S J, YU J Q, ZHOU Y H.Light-induced HY5 functions as a systemic signal to coordinate the photoprotective response to light fluctuation.Plant Physiology, 2020, 184(2): 1181-1193.doi: 10.1104/pp.20.00294.
[19] ZHANG L, JIANG X, LIU Q, AHAMMED G J, LIN R, WANG L, SHAO S, YU J, ZHOU Y.The HY5 and MYB15 transcription factors positively regulate cold tolerance in tomato via the CBF pathway.Plant, Cell & Environment, 2020, 43(11): 2712-2726.doi: 10.1111/ pce.13868.
[20] XIA X J, HUANG L F, ZHOU Y H, MAO W H, SHI K, WU J X, ASAMI T, CHEN Z X, YU J Q.Brassinosteroids promote photosynthesis and growth by enhancing activation of Rubisco and expression of photosynthetic genes in.Planta, 2009, 230(6): 1185-1196.doi: 10.1007/s00425-009-1016-1.
[21] 王峰.PhyA、HY5和PIF4在光质调控番茄低温抗性中的机制研究[D].杭州: 浙江大学, 2017.
WANG F.Roles and mechanisms of PhyA-, HY5-, and PIF4- mediated light quality-regulated cold tolerance in tomato [D].Hangzhou: Zhejiang University.2017.(in Chinese)
[22] LIVAK K J, SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTMethod.Methods (San Diego, Calif), 2001, 25(4): 402-408.doi: 10.1006/meth.2001.1262.
[23] PARK S, LEE C M, DOHERTY C J, GILMOUR S J, KIM Y, THOMASHOW M F.Regulation of theCBF regulon by a complex low-temperature regulatory network.The Plant Journal, 2015, 82(2): 193-207.doi: 10.1111/tpj.12796.
[24] HANYU H, SHOJI K.Combined effects of blue light and supplemental far-red light and effects of increasing red light with constant far-red light on growth of kidney bean under mixtures of narrow-band light sources.Environment Control in Biology, 2000, 38: 25-32.
[25] DEMOTES M S, PÉRON T, COROT A, BERTHELOOT J, GOURRIEREC J L, PELLESCHI T S, CRESPEL L, MOREL P, HUCHÉ T L, BOUMAZA R, VIAN A, GUÉRIN V, LEDUC N, SAKR S.Plant responses to red and far-red lights, applications in horticulture.Environmental and Experimental Botany, 2016, 121: 4-21.
[26] PARK Y, RUNKLE E S.Far-red radiation promotes growth of seedlings by increasing leaf expansion and whole-plant net assimilation.Environmental and Experimental Botany, 2017, 136: 41-49.
[27] KUREPIN L V, JOO S H, KIM S K, PHARIS R P, BACK T G.Interaction of brassinosteroids with light quality and plant hormones in regulating shoot growth of young sunflower andseedlings.Journal of Plant Growth Regulation, 2012, 31(2): 156-164.doi: 10.1007/s00344-011-9227-7.
[28] CASAL J J.Photoreceptor signaling networks in plant responses to shade.Annual Review of Plant Biology, 2013, 64: 403-427.doi: 10.1146/annurev-arplant-050312-120221.
[29] 杨再强, 张继波, 李永秀, 彭晓丹, 张婷华, 张静.红光与远红光比值对温室切花菊形态指标、叶面积及干物质分配的影响.生态学报, 2012, 32(8): 2498-2505.
YANG Z Q, ZHANG J B, LI Y X, PENG X D, ZHANG T H, ZHANG J.Effects of red/far-red ratio on morphological index, leaf area and dry matter partitioning of cut chrysanthemum flower.Acta Ecologica Sinica, 2012, 32(8): 2498-2505.(in Chinese)
[30] 彭晓丹, 杨再强, 李伶俐, 张继波.红光与远红光比值对温室切花菊花‘神马’花芽分化进程的影响.生态学杂志, 2013, 32(6): 1471-1475.
PENG X D, YANG Z Q, LI L L, ZHANG J B.Effects of red and far-red light ratio on the flower bud differentiation of greenhouse cut chrysanthemum cultivar ‘Jingba’.Chinese Journal of Ecology, 2013, 32(6): 1471-1475.(in Chinese)
[31] OUEDRAOGO M, HUBAC C.Effect of far red light on drought resistance of cotton.Plant and Cell Physiology, 1982, 23(7): 1297-1303.doi: 10.1093/oxfordjournals.pcp.a076474.
[32] ZHANG C, XIE Q G, ANDERSON R G, NG G, SEITZ N C, PETERSON T, MCCLUNG C R, MCDOWELL J M, KONG D D, KWAK J M, LU H, AUSUBEL F M.Crosstalk between the circadian clock and innate immunity in.PLOS Pathogens, 2013, 9(6): e1003370.
Effects of Supplemental Far-Red Light on Growth and Abiotic Stress Tolerance of Pepper Seedlings
DONG SangJie1, JIANG XiaoChun1, WANG LingYu1, LIN Rui1, QI ZhenYu2, YU JingQuan1, ZHOU YanHong1*
1Department of Horticulture, College of Agriculture and Biotechnology, Zhejiang University/State Agriculture Ministry Key Laboratory of Horticultural Plant Growth and Development, Hangzhou 310058;2Agricultural Experimental Station, Zhejiang University, Hangzhou 310058
【Objective】This study analyzed the effects of supplementary far-red light (FR) on the growth and abiotic stress tolerance of pepper seedlings, aiming to provide a theoretical basis on precise light environments for cultivating high quality vegetable seedlings.【Method】In this study, Bola Hongshuai pepper cultivar was used as the research material.The 7-day-old seedlings were cultivated under two LED light environments, including the control spectrum (NL; R/B = 3/1, 150 μmol∙m-2∙s-1PPFD) and the NL with an extra 10 μmol∙m-2∙s-1far-red light (6% FR), 20 μmol∙m-2∙s-1far-red light (13% FR), and 30 μmol∙m-2∙s-1far-red light (20% FR).Chilling and drought were imposed when the seedlings were 21 days old.Biomass, resistance-related gene expression, antioxidant enzyme activity, hormone content, chlorophyll fluorescence parameters, and leaf relative electrolyte leakage (REL) were analyzed to explore the effects of supplemental FR on growth and abiotic stress tolerance of pepper seedlings.【Result】Compared with the control, the supplementation of 6% FR was beneficial to increase the height, stem thickness, dry weight, fresh weight and seedling indexes of pepper seedlings.Moreover, the supplementation of 6% FR significantly increased the expression of the cold response geneand antioxidant enzyme-related genes, such as-,,,andunder chilling stress.The activity of SOD, APX, DHAR, CAT and GR as well as the ABA content of pepper seedlings under low temperature increased by 25.2%, 53.6%, 55.8%, 72.7%, 33.4% and 69.5%, respectively, following the treatment with supplemental FR.The PSII maximum photochemical efficiency (Fv/Fm) of pepper leaves after supplementation of 6% FR under low temperature stress significantly increased compared with the control, while REL decreased obviously, indicating that supplementation of 6% FR alleviated the low temperature-induced PSII photoinhibition and damage in leaves and enhanced the cold tolerance of pepper seedlings.Under the drought stress condition, compared with the control, the supplementation of 6% FR improved the activity of SOD, GR, APX, CAT and DHAR by 13.7%, 38.0%, 37.2%, 27.6% and 23.7%, respectively.The ABA content and PSII actual photochemical efficiency (ΦPSII) were both increased while REL was decreased significantly.The results showed that the supplementation of 6% FR reduced the degree of PSII photoinhibition and membrane lipid peroxidation caused by drought stress, and improved the drought tolerance of pepper seedlings.【Conclusion】The study found that supplementation of 6% FR could not only improve the quality of pepper seedlings, but also enhance the resistance of pepper seedlings to low temperature and drought stresses by improving antioxidant defense and ABA homeostasis.
pepper (L.); far-red light; seedling index; low temperature stress; drought stress
2021-06-23;
2021-09-09
浙江省重点研发计划(2018C02010)、国家现代农业产业技术体系(CARS-24-B-01)
董桑婕,E-mail:dongsangjie@zju.edu.cn。通信作者周艳虹,E-mail:yanhongzhou@zju.edu.cn
(责任编辑 赵伶俐)

