人参皂苷Rh2 型联合氟化钠对变异链球菌生长及生物膜形成的抑制作用
方 圆, 刘晓璇, 王 瑞
(1. 吉林大学口腔医院口腔预防科,吉林 长春 130021;2. 吉林省牙发育及颌骨重塑与再生重点实验室,吉林 长春 130021)
龋病是一种发生于牙体硬组织的慢性感染性疾病,被世界卫生组织(World Health Organization,WHO)列为三大慢性非传染性疾病之一,其主要致病菌为变异链球菌[1]。变异链球菌为革兰阳性菌,具有较强的产酸和耐酸能力,其胞壁表面物质有助于细菌的黏附、定植和聚集,从而有助于形成生物膜,研究[2-3]表明:生物膜中的变异链球菌比浮游状态时更能抵抗抑菌药物及宿主的免疫功能,因此抑制变异链球菌的生长及生物膜形成是防龋工作的关键。目前氟化钠(sodium fluoride,NaF)是临床上使用范围最广和最有效的防龋物质,其能降低釉质溶解度、促进釉质再矿化及改变牙萌出后的形态和结构,还能对致龋菌的代谢产生影响,如抑制基质金属蛋白酶活性等[4-5],但NaF 使用不当易出现氟牙症和耐氟菌株等一系列不良反应[6]。而中药不仅能调节机体免疫功能,抑制细菌生长,还能延缓细菌的耐药性,因此中药抑菌现已成为研究热点之一[7]。人参皂苷作为我国传统中药材人参中的主要活性成分,近年来已有研究[8-9]证明其对多种细菌均有抑制作用。但人参皂苷联合NaF 是否能够增强抑菌效果国内外尚未见报道,因此本研究选择将人参皂苷Rh2 型(ginsenoside Rh2,GRh2)与NaF 联合应用于变异链球菌,探讨2 种药物是否具有协同抑菌作用,是否在减少NaF 使用剂量的同时增强对变异链球菌的抑制作用,为开发更有效的防龋产品提供科学依据。
1 材料与方法
1.1 细菌、主要试剂和仪器变异链球菌UA159由吉林大学口腔医院牙发育及颌骨重塑与再生重点实验室提供。G-Rh2(上海源叶生物科技有限公司),NaF(上海易恩化学技术有限公司),脑心浸出液肉汤(brain heart infusion,BHI)(赛默飞世尔科技公司),蔗糖(北京索莱宝科技有限公司),结晶紫染料(北京酷来博科技有限公司),戊二醛(北京雷根生物技术有限公司)。二氧化碳细胞恒温培养箱(日本SANYO 公司),酶标仪(美国Bio-Tek 公司),分光光度计(上海尤尼科有限公司),pH 值检测仪(上海雷磁新泾仪器有限公司),抽气式厌氧罐(上海坤科仪器设备有限公司)。
1.2 实验菌株和菌液制备将-80 ℃冻存的变异链球菌复苏后接种于BHI 琼脂板中,于37 ℃、5%CO2厌氧条件下培养24 h,扫描电镜鉴定为纯培养后挑取单菌落接种于含1%蔗糖的BHI 液体培养基中,继续培养至对数生长期以备后续实验使用。
1.3 半数最小抑菌浓度(half minimum inhibition concentration,MIC50)的测定通过微量稀释法分别测量G-Rh2 与NaF 对变异链球菌的MIC50值。分别将等量的菌液和不同浓度的药物加入96 孔细胞培养板中,菌液最终浓度为1×106CFU·mL-1,G-Rh2 的浓度为12.5、15.0、20.0、25.0、30.0 和40.0 mg·L-1, NaF 的 浓 度 为15.625、 31.250、62.500、 125.000、 250.000 和500.000 mg·L-1,于37 ℃、5% CO2条件下厌氧培养24 h,采用酶标仪在波长为600 nm 处测量吸光度(A)值,对照组A(600)值的1/2 所对应的浓度即为MIC50。MIC50定义为与空白对照组相比至少抑制50%细菌生长的最低药物浓度。
1.4 棋盘微量稀释法通过棋盘微量稀释法进行联合药敏试验,检测G-Rh2 和NaF 间是否具有协同抑制变异链球菌的作用。将100 μL 菌液依次加入96 孔细胞培养板中,再于96 孔细胞培养板的2~6 行和2~6 列中分别加入50 μL 不同浓度的G-Rh2和NaF, G-Rh2 的 最 终 浓 度 为3.125、 3.750、5.000、6.250 和7.510 mg·L-1,NaF 的 最 终 浓 度为3.90625、7.81250、15.62500、31.25000、62.50000 和125.00000 mg·L-1,菌液最终浓度为1×106CFU·mL-1,空白对照组内不含任何药物。各组混匀后厌氧培养24 h, 采用酶标仪检测A (600)值以观察实验结果。根据单独用药及联合用药时的结果计算分级抑菌浓度(fractional inhibitory concentration,FIC)指数,定量检测2 种药物之间是否具有协同作用。FIC 的计算公式:FIC=联合用药时A 药的MIC50值/单独应用A 药时的MIC50值+联合应用B 药时的MIC50值/单独应用B 药时的MIC50值。当FIC<0.5 时,表示2 种药物间有协同作用;当FIC 为0.5~1.0 和1.0~2.0 时分别表示相加作用和无关作用;当FIC>2.0 表示2 种药物间有拮抗作用。
1.5 生物膜形成量的测定采用结晶紫染色法定量检测G-Rh2 与NaF 单独和联合应用时变异链球菌生物膜的形成量,并检测药物半数最小生物膜抑制 浓 度 (half minimum biofilm inhibition concentration,MBIC50)。将等量的菌液和不同浓度的药物分别加入96 孔细胞培养板中,G-Rh2 最终 浓 度: 15.0、 20.0、 22.5、 25.0、 30.0 和40.0 mg·L-1;NaF 最 终 浓 度:15.625、31.250、62.500、 125.000、 250.000 和500.000 mg·L-1;检测G-Rh2 和NaF 单独与联合应用对变异链球菌生物膜形成量的影响时分组为MBIC50G-Rh2 组、MBIC50NaF 组 和MBIC50G-Rh2+MBIC50NaF 联 合组;空白对照组内不含任何药物。各组厌氧培养24 h 后吸出每孔中的液体,戊二醛固定,结晶紫染色,最后溶于95%酒精中,用酶标仪测定600 nm波长处的A值,定量检测MBIC50,对照组A(600)值的1/2 所对应的浓度即为MBIC50。MBIC50定义为与空白对照组相比至少抑制50%细菌生物膜形成时的最低药物浓度。
1.6 变异链球菌生长曲线的绘制分别将等量的菌液和不同分组的药物加入离心管中,药物分组为MIC50G-Rh2 组、 MIC50NaF 组 和MIC50G-Rh2+MIC50NaF 联合组,空白对照组内不含任何药物。各组混匀后置于厌氧环境中培养,每隔4 h 采用酶标仪测量A (600) 值,并绘制生长曲线,观察G-Rh2 和NaF 单独与联合应用时对变异链球菌生长变化的影响。
1.7 产酸实验检测G-Rh2 和NaF 单独与联合应用时对变异链球菌的产酸抑制率分别将等量的菌液和不同分组的药物加入离心管中,药物分组为MIC50G-Rh2 组、 MIC50NaF 组 和MIC50G-Rh2+MIC50NaF 联合组,空白对照组内不含任何药物。调整各管内初始pH 值,即pH0均为7.4,厌氧培养24 h 后取上清液,依次测量pH 值,记为pH1。计算pH 值的变化即ΔpH,ΔpH=pH0-pH1,并计算产酸抑制率,空白对照组产酸抑制率为0。产酸抑制率=(对照组ΔpH-实验组ΔpH)/对照组ΔpH×100%。ΔpH 值越小,产酸抑制率越高,表明抑制细菌产酸的作用越强。
1.8 扫描电镜观察各组变异链球菌形态、数量和生物膜结构将细胞爬片置于24 孔细胞培养板中,每孔分别加入等量的菌液和不同分组的药物,药物分 组 为 MBIC50G-Rh2 组、 MBIC50NaF 组 和MBIC50G-Rh2+MBIC50NaF 联合组,于厌氧环境下培养24 h 后吸出每孔中的液体,戊二醛固定、酒精梯度脱水、干燥、样本镀金,扫描电镜下观察变异链球菌形态、数量和生物膜结构。
1.9 统计学分析采用SPSS 22.0 统计软件进行统计学分析。各组生物膜形成量和ΔpH 值符合正态分布,以±s 表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验,计数资料以率(%)表示。所有实验均重复3 次。以P<0.05 为差异有统计学意义。
2 结果
2.1 微量稀释法检测不同浓度G-Rh2 和NaF 对变异链球菌的MIC50值随着浓度的升高,G-Rh2 和NaF 对变异链球菌的抑制作用逐渐增强,当G-Rh2浓度为25.0 mg·L-1,NaF 浓度为125.000 mg·L-1时可以抑制空白对照组50% 细菌的增长(P<0.05),因 此G-Rh2 的MIC50值 为25.0 mg·L-1,NaF 的MIC50值为125.000 mg·L-1。见图1。

图1 不同浓度G-Rh2 和NaF 对变异链球菌生长的抑制作用Fig.1 Inhibitory effects of different concentrations of G-Rh2 and NaF on growth of Streptococcus mutans
2.2 G-Rh2 和NaF 联合应用对变异链球菌的抑制作用当G-Rh2 与NaF 单 独 应 用 时,G-Rh2 的MIC50值 为 25.0 mg·L-1, NaF 的 MIC50值 为125.000 mg·L-1,而当G-Rh2 与NaF 联合应用时,G-Rh2 的MIC50值仅为5.00 mg·L-1,NaF 的MIC50值仅为31.25 mg·L-1,FIC=0.45,小于0.50,表明G-Rh2 与NaF 具有协同抑制变异链球菌的作用。
2.3 结晶紫染色法检测G-Rh2 和NaF 对变异链球菌的MBIC50值当G-Rh2 浓度为15.0 mg·L-1时可以抑制变异链球菌生物膜的形成,随着浓度的升高,抑制作用越强,生物膜的形成量越少,且G-Rh2 的MBIC50值为22.5 mg·L-1(P<0.05);NaF可以减少变异链球菌生物膜的形成量,且浓度越大生物膜的形成量越少,当NaF 浓度为62.5 mg·L-1时,变异链球菌生物膜形成量仅为空白对照组的1/2,因此NaF 的MBIC50值为62.500 mg·L-1(P<0.05)。见图2。

图2 不同浓度G-Rh2 和NaF 对变异链球菌生物膜的MBIC50值Fig.2 MBIC50 of Streptococcus mutans biofilm when treated with different concentrations of G-Rh2 and NaF
2.4 结晶紫染色法检测G-Rh2 和NaF 联合应用对变异链球菌生物膜的抑制作用本实验结果显示:与单组药物组和空白对照组比较,联合应用组A (600)值降低,见表1。结晶紫染色检测结果显示空白对照组生物膜较厚,着色较深;与空白对照组比较,MBIC50G-Rh2 组和MBIC50NaF 组变异链球菌生物膜形成受到抑制,生物膜着色相对较浅,而MBIC50G-Rh2+MBIC50NaF 联合组生物膜几乎不能着色,生物膜形成量明显减少并少于单独应用单组药物时。见图3。
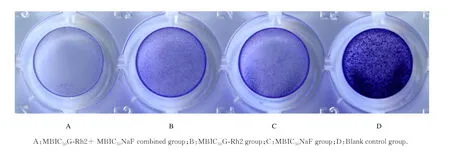
图3 结晶紫染色分析G-Rh2 和NaF 单独与联合应用时变异链球菌生物膜形成量Fig. 3 Biofilm formation amounts of Streptococcus mutans when treated with G-Rh2 and NaF alone or in combination analyzed by crystal violet staining
表1 G-Rh2 和NaF 单独与联合应用对变异链球菌生物膜的抑制作用Tab. 1 Inhibitory effects of G-Rh2 and NaF alone or in combination on Streptococcus mutans biofilm (n=3,±s)

表1 G-Rh2 和NaF 单独与联合应用对变异链球菌生物膜的抑制作用Tab. 1 Inhibitory effects of G-Rh2 and NaF alone or in combination on Streptococcus mutans biofilm (n=3,±s)
*P<0.01 compared with blank control group;△P<0.05 compared with MBIC50G-Rh2 group;#P<0.01 compared with MBIC50NaF group.
Group A(600)Blank control 3.298±0.0368 MBIC50G-Rh21.657±0.0321*MBIC50NaF 1.616±0.0326*MBIC50G-Rh2+MBIC50NaF combined 0.602±0.0440*△#
2.5 G-Rh2 和NaF 单独与联合应用时变异链球菌的生长曲线生长曲线图可见空白对照组的变异链球菌在0~12 h 内生长迅速,之后生长逐步缓慢,最后进入稳定期。与空白对照组比较,单独应用G-Rh2 或NaF 时变异链球菌的生长速度均降低(P<0.05),而联合应用G-Rh2 与NaF 时变异链球菌的生长速度明显降低,且低于单独药物组(P<0.05),表明2 种药物联合应用时对变异链球菌的抑制作用更优。见图4。

图4 G-Rh2 和NaF 单独与联合应用时变异链球菌生长曲线Fig. 4 Growth curves of Streptococcus mutans when treated with G-Rh2 and NaF alone or in combination
2.6 各组ΔpH 值和产酸抑制率空白对照组、MIC50G-Rh2 组、 MIC50NaF 组 和MIC50G-Rh2+MIC50NaF 联 合 组 ΔpH 值 为 2.627±0.048、1.457±0.026、 1.393±0.035 和 0.433±0.049。与空白对照组比较,MIC50G-Rh2 组、MIC50NaF 组和MIC50G-Rh2+MIC50NaF 联合组的ΔpH 值均降低,且MIC50G-Rh2+MIC50NaF 联合组ΔpH 值低于MIC50G-Rh2 组和MIC50NaF 组。结合实验结果由产酸抑制率计算公式可得,24 h 内单独应用G-Rh2 或NaF 的产酸抑制率分别为44.54%和47.00%,而联合应用G-Rh2 与NaF 时产酸抑制率高达83.51%。
2.7 扫描电镜下变异链球菌形态空白对照组变异链球菌的生物膜较厚,细菌之间紧密连接,形态规则,结构完整,并由致密的胞外基质包绕成三维立体结构;MIC50G-Rh2 组和MIC50NaF 组可见生物膜厚度降低,胞外基质量减少,细菌之间排列疏松;而MIC50G-Rh2+MIC50NaF 联合组生物膜结构消失,细菌数量减少且细菌形态发生变化,可见细菌表面较粗糙,有凹坑状结构存在。见图5。

图5 G-Rh2 和NaF 单独与联合应用时变异链球菌扫描电子显微镜图像(×20000)Fig. 5 Scanning electron microscope images of Streptococcus mutans when treated with G-Rh2 and NaF alone or in combination(×20000)
3 讨论
氟化物作为一种常用的防龋物质,使用不当会出现耐氟菌株、氟牙症和氟骨症等不良反应[10],短期内氟化物抑制变异链球菌产酸的能力可随时间的推迟而减弱[11],因此许多学者提出将氟化物与其他药物联合使用,以达到降低氟化物用量、弥补氟化物不足和增强防龋效果的目的[12]。人参皂苷具有抗氧化、调节免疫和提高机体抗感染能力等功能,其不仅可以抑制细菌生长还可以增强其他药物的抑菌性能[13-14]。因此本研究将G-Rh2 与NaF 联合应用,以期通过2 种药物间潜在的协同作用来降低单组药物的用量。
变异链球菌是公认的主要致龋菌,其可以利用葡糖基转移酶代谢蔗糖产生胞外多糖,从而有利于细菌黏附和生物膜形成[15],还可以利用碳水化合物产生乳酸等多种有机酸,使菌斑pH 值始终处于临界pH 值(5.5)之下,且变异链球菌具有较强的耐酸性,在酸性环境中可通过改变自身基因表达来提高生存能力,使其在牙菌斑致龋过程中发挥重要作用[16],因此减弱变异链球菌的黏附性、产酸性和耐酸性等致龋毒力因素是防龋的关键。
本研究结果显示:联合应用G-Rh2 与NaF 可以抑制变异链球菌生长、生物膜形成和产酸,且较单组药物应用时效果更好。棋盘微量稀释法检测结果显示:仅将5.0 mg·L-1G-Rh2 与31.250 mg·L-1NaF 联合应用就可以达到单独应用25.0 mg·L-1G-Rh2 或125.000 mg·L-1NaF 的效果;生 长曲线表明:与空白对照组和单组药物组比较,联合组对细菌生长的抑制作用更明显;结晶紫染色实验和扫描电镜检测结果显示:联合组较单独药物组更能抑制变异链球菌生物膜的形成,且联合组的产酸抑制率高于空白对照组和单独药物组,表明联合应用时能更好地抑制变异链球菌产酸。关于G-Rh2 和NaF抑制变异链球菌的相关机制,2 种药物均可通过降低变异链球菌胞外多糖水平,抑制葡糖基转移酶、乳酸脱氢酶和烯醇酶等糖酵解相关酶的活性等来影响生物膜形成和产酸[17-18]。除上述共同抑菌途径之外,NaF 还可抑制胞内多糖生长及抑制过氧化物酶和过氧化氢酶活性来影响变异链球菌生长及生物膜形成,且其能抑制F-ATPase 和H+ATPase 等质子转运酶的活性使细胞质酸化,降低变异链球菌的耐酸性[19-21],而G-Rh2 可以直接破坏细菌细胞壁、抑制磷酸转移酶和乙醛/乙醇脱氢酶等的活性、影响群体感应系统及抑制eDNA 释放[22],此外还可通过消除质粒和抑制β-内酰胺酶活性等途径来干预及逆转细菌耐药性[23]。
综上所述,将G-Rh2 与NaF 联合应用不仅可通过共同的抑菌途径发挥作用,还可通过各自的抑菌机制增强效果,降低变异链球菌耐药性的发生,但2 种药物协同抑制变异链球菌的具体机制,仍需要进一步的探讨研究。

