褪黑素对过氧化氢诱导人神经母细胞瘤SH-SY5Y细胞氧化应激的改善作用及其机制
周 阳, 米旭光, 蒲文星, 汪文涛, 景 猛, 孟繁凯
(1. 长春中医药大学临床医学院,吉林 长春 130117;2. 吉林省人民医院中心实验室,吉林 长春 130021;3. 吉林省人民医院神经外科,吉林 长春 130021)
重度脑损伤造成的神经功能缺失一直是临床治疗中的重点和难点,严重影响患者的生活质量和社会回归。氧化应激是活性氧类(reactive oxygen species,ROS)和氧自由基相对超负荷引起的细胞应激反应,是脑损伤发生发展的重要机制之一,也是神经元细胞死亡的主要原因。大脑耗氧量高,而且脑组织富含脂质,对氧化应激非常敏感[1]。研究[2-3]表明:当神经细胞内氧化/抗氧化的平衡被打破,神经细胞内过氧化物堆积,过量产生的ROS 直接攻击神经细胞生物膜,导致线粒体功能障碍、脂质过氧化以及蛋白质和DNA 的氧化,神经元细胞功能受损或发生凋亡。褪黑素主要由松果体分泌,是一种具有调节昼夜生理规律、抗炎、抗氧化、抗衰老和调节自身机体免疫等生理功能的胺类激素。研究[4-5]表明:褪黑素及其代谢衍生物具有很强的自由基清除特性,是ROS 和活性氮(reactive nitrogen species,RNS)的有效抗氧化剂。研究[6-8]显示:褪黑素抗氧化应激损伤与提高细胞自噬能力有关,神经细胞对细胞碎片和一些老化蛋白质的清除主要是通过自噬作用完成,细胞自噬功能障碍与神经细胞损伤进展密切相关,但机制尚不清楚。本研究主要以过氧化氢(hydrogen peroxide,H2O2) 诱导神经母细胞瘤株(SH-SY5Y) 细胞氧化应激损伤,检测细胞增殖、凋亡、ROS 水平和自噬情况,探讨褪黑素对H2O2诱导的SH-SY5Y 细胞氧化应激的研究损伤的影响,初步探讨其相关机制,为褪黑素改善中枢神经细胞氧化应激的研究提供实验和理论基础。
1 材料与方法
1.1 细胞、主要试剂和仪器SH-SY5Y 细胞(吉林省人民医院中心实验室保存);H2O2、褪黑素和2-苯基-N-乙酰色胺(Luzindole)(美国Sigma 公司),DMEM 培养基和胎牛血清(美国Gibco 公司),胰蛋白酶(+EDTA)和1%青霉素-链霉素溶液(100×)(北京全式金生物技术有限公司),细胞计数试剂盒-8(CCK-8)、Annexin Ⅴ-FITC 细胞凋亡试剂盒、ROS 检测试剂盒和SDS-PAGE 凝胶配制试剂盒(中国碧云天生物试剂公司),微管相关蛋白1 轻链3B(microtubule-associated protein 1 light chain 3B,LC3B)、GAPDH、Anti-mouse IgG和Anti-rabbit IgG (美国Cell Signaling Technology公司),单丹磺酰戊二胺(monodansylcadaverine,MDC)(中国阿拉丁试剂公司),4%多聚甲醛(福州飞净生物科技有限公司);CO2恒温培养箱(型号3111)和流式细胞仪(型号A24863)(美国Thermo Fisher公司),凝胶成像仪(型号5500Multi,上海天能科技有限公司),手动倒置显微镜(型号DMI3000B)和Leica数码摄像头(型号DFC495,德国Leica公司)。
1.2 细胞培养SH-SY5Y 细胞在含10% FBS 胎牛血清、1% 青霉素-链霉素溶液(10000 U·mL-1青霉素和10 g·mL-1链霉素) 的DMEM 完全培养基中进行培养,并置于37 ℃、5% CO2培养箱中。当细胞融合生长率达到80%~90%时使用0.25%胰蛋白酶(含EDTA)传代,取对数生长期生长状况良好的细胞进行后续实验。
1.3 CCK-8 法检测各组SH-SY5Y 细胞存活率将SH-SY5Y 细胞分为对照组、H2O2组、不同浓度褪黑素组和Luzindole 组。选择增殖活跃并处于对数生长期的SH-SY5Y 细胞,以1×104L-1的密度接种于96 孔细胞培养板上。对照组为正常培养的SH-SY5Y 细胞;H2O2组培养24 h 后,弃去旧培养基,加入100 μL 含有200 μmol·L-1H2O2的培养基,置于培养箱中培养24 h;不同浓度褪黑素组加入100 μL 含有不同浓度(1、5 和10 μmol·L-1)褪黑素的培养基预处理24 h 后,弃去旧培养基,加 入100 μ L 含 有200 μmol·L-1H2O2的 培 养 基,置于培养箱中培养24 h;Luzindole 组加入100 μL含有50 μmol·L-1Luzindole 的培养基处理1 h 后,加入含有100 μL 含有10 μmol·L-1褪黑素的培养基预处理24 h,弃去旧培养基,加入100 μ L 含有200 μmol·L-1H2O2的培养基,置于培养箱中培养24 h。每组设5 个复孔,检测前每孔加入CCK-8 试剂10 μL,置于37 ℃培养箱中培养2 h 后,使用酶标仪记录450 nm 波长处各孔的吸光度(A)值,计算各组细胞存活率。细胞存活率=处理组A 值/对照组A 值×100%。实验重复3 次。
1.4 DCFH-DA 荧光探针检测各组SH-SY5Y 细胞中ROS 水平SH-SY5Y 细 胞 以1×106L-1的 密度接种于6 孔细胞培养板中。按照“1.3”步骤中方法进行分组及给药,各组细胞处理完毕后,按照1∶1000 采用无血清培养液稀释DCFH-DA,使终浓度为10 μmol·L-1,各孔加入DCFH-DA 于37 ℃继续孵育30 min,每隔5 min 颠倒混匀,孵育结束收集悬浮细胞,采用无血清细胞培养液洗涤细胞3次,以充分洗去未进入细胞的DCFH-DA,再用500 μL无血清培养基重悬细胞,立即采用流式细胞仪检测。以相对平均荧光强度值表示细胞中ROS 水平。
1.5 流式细胞术检测各组SH-SY5Y 细胞凋亡率SH-SY5Y 细胞以1×106L-1的密度接种于6 孔细胞培养板中。按照“1.3”步骤中方法进行分组及给药,处理完毕后,各组细胞检测前采用4 ℃预冷的PBS 缓冲液洗涤2 次,随后加入不含EDTA的0.25%胰蛋白酶消化并且收集细胞。加入1×AnnexinⅤ结 合 缓 冲 液1 mL,500 r·min-1离 心5 min 后弃上清,加入结合缓冲液195 μL 重悬细胞。并在悬液中加入Annexin-Ⅴ-FITC 10 μL 和PI 5 μL,混匀后37 ℃避光孵育15 min,流式细胞仪检测细胞凋亡率。右下象限表示早期凋亡细胞(Annexin Ⅴ-FITC+/PI-),右上象限表示晚期凋亡细胞(Annexin Ⅴ-FITC+/PI+)。细胞凋亡率=早期凋亡率+晚期凋亡率。
1.6 Western blotting 法检测各组SH-SY5Y 细胞中微管相关蛋白轻链3-Ⅱ(microtubule-associated protein light chain3-Ⅱ,LC3-Ⅱ)蛋 白 表 达水平SH-SY5Y 细 胞 以1×106L-1的 密 度 接种 于6 孔细胞培养板中。按照“1.3”步骤中方法进行分组及给药,各组细胞处理完毕后,待检细胞加入RIPA细胞蛋白裂解液100 μL,提取细胞总蛋白,采用二辛可酸(bicinchoninic acid,BCA) 法测定蛋白浓度。制备12% SDS-PAGE 凝胶,经过上样、电泳、转膜和封闭,加入一抗过夜孵育。次日经TBST 洗脱抗体后,加入二抗室温下孵育2 h,再用TBST 漂洗3 次。最后将膜浸泡于显影液中显影曝光,凝胶成像分析仪中采集图像,采用Image Pro Plus 6.0 软件分析蛋白灰度值,计算LC3-Ⅱ蛋白表达水平。LC3-Ⅱ蛋白表达水平=LC3-Ⅱ蛋白条带灰度值/LC3-Ⅰ蛋白条带灰度值。
1.7 MDC 染色检测各组SH-SY5Y 细胞自噬泡荧光强度SH-SY5Y 细胞以1×106L-1的密度接种于6 孔细胞培养板中。按照“1.3”步骤中方法进行分组及给药,各组细胞处理完毕后,采用MDC(50 μmol·L-1)染色,37 ℃孵育30 min。孵育后,PBS 缓冲液洗涤1 次,4%多聚甲醛固定。固定后,采用荧光显微镜对样品进行观察分析,激发波长335 nm,发射波长525 nm。采用Image Pro Plus 6.0 软件分析各组SH-SY5Y 细胞自噬泡荧光强度,计算细胞自噬泡荧光强度。细胞自噬泡荧光强度=各组荧光值/对照组荧光平均值。
1.8 统计学分析采用Graphpad Prism Version 8.0 软件和Image Pro Plus 6.0 软件进行统计学分析。各组SH-SY5Y 细胞存活率和凋亡率、ROS 水平、LC3-Ⅱ蛋白表达水平及自噬泡荧光强度符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组SH-SY5Y 细胞存活率与对照组比较,H2O2组SH-SY5Y 细胞存活率降低(P<0.01)。与H2O2组比较,不同浓度褪黑素组细胞存活率均升高(P<0.05)。与10 μ mol·L-1褪 黑 素 组 比 较,1 μmol·L-1褪黑素组和Luzindole 组SH-SY5Y 细胞存活率降低(P<0.05)。见表1。
表1 各组SH-SY5Y 细胞的存活率Tab. 1 Survival rates of SH-SY5Y cells in various groups(n=5,±s,η/%)

表1 各组SH-SY5Y 细胞的存活率Tab. 1 Survival rates of SH-SY5Y cells in various groups(n=5,±s,η/%)
*P<0.01 vs control group;△P<0.05 vs H2O2 group;#P<0.05 vs 10 μmol·L-1 melatonin group.
Group Control H2O2 Melatonin 1 μmol·L-1 5 μmol·L-1 10 μmol·L-1 Luzindole Survival rate 100.00±2.8554.64±5.85*61.32±4.28△#65.93±1.10△67.72±2.29△57.72±2.48△#
2.2 各组SH-SY5Y 细胞中ROS 水平与对照组比较,H2O2组SH-SY5Y 细胞中ROS 水平升高(P<0.001)。与H2O2组比较,不同浓度褪黑素组细胞中ROS水平均降低(P<0.01)。与10 μmol·L-1褪 黑 素 组 比 较, 1 和5 μmol·L-1褪 黑 素 组 及Luzindole 组SH-SY5Y 细胞中ROS 水平明显升高(P<0.05 或P<0.01)。见图1 和表2。
表2 各组SH-SY5Y 细胞中ROS 水平Tab. 2 ROS levels in SH-SY5Y cells in various groups(n=3,±s,η/%)
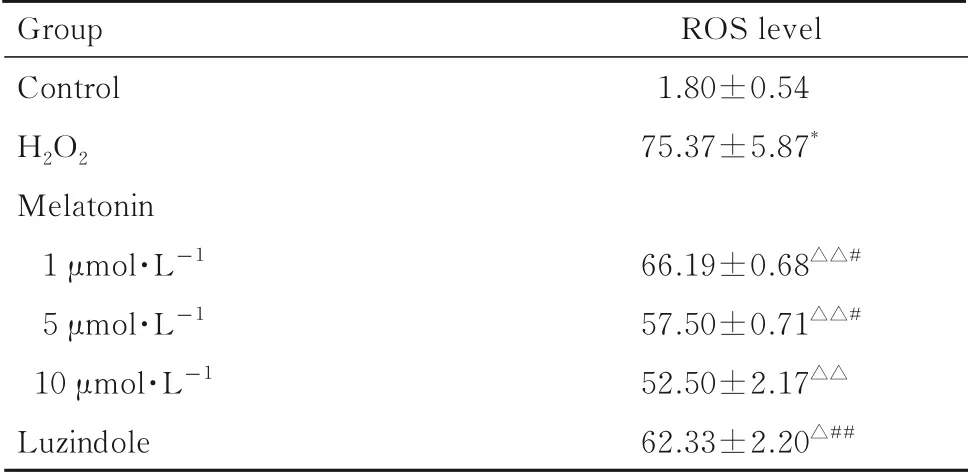
表2 各组SH-SY5Y 细胞中ROS 水平Tab. 2 ROS levels in SH-SY5Y cells in various groups(n=3,±s,η/%)
*P<0.01 vs control group;△P<0.05,△△P<0.01 vs H2O2 group;#P<0.05,##P<0.01 vs 10 μmol·L-1 melatonin group.
Group Control H2O2 Melatonin 1 μmol·L-1 5 μmol·L-1 10 μmol·L-1 Luzindole ROS level 1.80±0.5475.37±5.87*66.19±0.68△△#57.50±0.71△△#52.50±2.17△△62.33±2.20△##
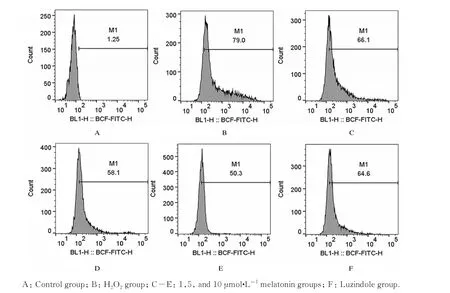
图1 流式细胞术检测各组SH-SY5Y 细胞中ROS 水平Fig.1 ROS levels in SH-SY5Y cells in various groups detected by flow cytometry
2.3 各组SH-SY5Y 细胞凋亡率与对照组比较,H2O2组SH-SY5Y 细 胞 凋 亡 率 升 高(P<0.01)。与H2O2组比较,不同浓度褪黑素组细胞凋亡率明显降 低(P<0.05 或P<0.01)。与10 μmol·L-1褪 黑 素 组 比 较, 1 和5 μmol·L-1褪 黑 素 组 及Luzindole 组SH-SY5Y 细胞凋亡率升高(P<0.05)。见图2 和表3。

图2 流式细胞术检测各组SH-SY5Y 细胞的凋亡率Fig.2 Apoptotic rates of SH-SY5Y cells in various groups detected by flow cytometry
表3 各组SH-SY5Y 细胞凋亡率Tab. 3 Apoptotic rates of SH-SY5Y cells in various groups(n=3,±s,η/%)
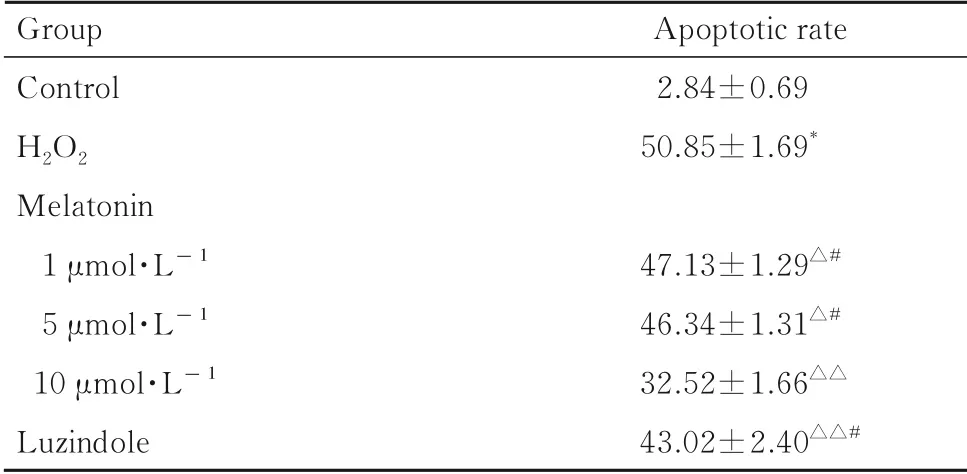
表3 各组SH-SY5Y 细胞凋亡率Tab. 3 Apoptotic rates of SH-SY5Y cells in various groups(n=3,±s,η/%)
*P<0.01 vs control group;△P<0.05,△△P<0.01 vs H2O2 group;#P<0.05 vs 10 μmol·L-1 melatonin group.
Group Control H2O2 Melatonin 1 μmol·L-1 5 μmol·L-1 10 μmol·L-1 Luzindole Apoptotic rate 2.84±0.6950.85±1.69*47.13±1.29△#46.34±1.31△#32.52±1.66△△43.02±2.40△△#
2.4 各组SH-SY5Y 细胞中LC3-Ⅱ蛋白表达水平与对照组比较,H2O2组SH-SY5Y 细胞中LC3-Ⅱ蛋白表达水平升高(P<0.01)。与H2O2组比较,不同浓度褪黑素组SH-SY5Y 细胞中LC3-Ⅱ蛋白表达水平升高(P<0.01)。与10 μmol·L-1褪黑素组比较,1 和5 μmol·L-1褪黑素组及Luzindole组SH-SY5Y 细胞中LC3-Ⅱ蛋白表达水平降低(P<0.05 或P<0.01)。见图3。

图3 Western blotting 法检测各组中SH-SY5Y 细胞中LC3-Ⅱ蛋白表达电泳图(A)和直条图(B)Fig. 3 Electrophoregram(A)and histogram(B)of LC3-Ⅱprotein expressions in SH-SY5Y cells in various groups detected by Western blotting method
2.5 各组SH-SY5Y 细胞自噬泡荧光强度与对照组比较,H2O2组SH-SY5Y 细胞荧光强度升高(P<0.05)。与H2O2组比较,10 μmol·L-1褪黑素组SH-SY5Y 细胞中荧光强度升高(P<0.05)。与10 μmol·L-1褪黑素 组比较,1 μmol·L-1褪黑 素组和Luzindole 组SH-SY5Y 细胞中荧光强度降低(P<0.05)。见图4 和表4。
表4 各组SH-SY5Y 细胞自噬泡荧光强度Tab. 4 Fluorescence intensities of autophagy vacuoles in SH-SY5Y cells in various groups (n=3,±s)

表4 各组SH-SY5Y 细胞自噬泡荧光强度Tab. 4 Fluorescence intensities of autophagy vacuoles in SH-SY5Y cells in various groups (n=3,±s)
*P<0.05 vs control group;△P<0.05 vs H2O2 group;#P<0.05 vs 10 μmol·L-1 melatonin group.
Group Control H2O2 Melatonin 1 μmol·L-1 5 μmol·L-1 10 μmol·L-1 Luzindole Fluorescence intensity 1.00±0.181.67±0.27*1.91±0.24*#2.46±0.51*2.69±0.43△1.89±0.21#

图4 各组SH-SY5Y 细胞自噬泡荧光强度(Bar=50 μm)Fig.4 Fluorescence intensities of autophagy vacuoles in SH-SY5Y cells in various groups(Bar=50 μm)
3 讨论
重度脑损伤会产生一定程度数量的ROS 及氧自由基,引起神经元细胞的氧化应激损伤或凋亡[9]。H2O2在细胞内可以进一步转变成活性更强的羟自由基,已被广泛用于多种不同类型的细胞中诱导氧化应激[10],通过破坏细胞内分子(DNA、蛋白质和脂质),导致神经元细胞凋亡和坏死[11]。褪黑素具有强亲脂性抗氧化和清除自由基的作用,可以有效地降低在自由基生成条件下引起的分子损伤[12-13]。研究[14]表明:褪黑素能逆转H2O2和1-甲基-4-苯基吡啶离子(1-methyl-4-pehnyl-pyridine,MPP+) 对SH-SY5Y 细胞活力毒性的影响,因此研究褪黑素抵抗神经细胞氧化应激损伤的机制具有重要意义。
本研究结果显示:加入H2O2后SH-SY5Y 细胞的存活率下降,并且H2O2加入后SH-SY5Y 细胞中ROS 水平明显升高。上述结果表明:H2O2通过诱导SH-SY5Y 细胞发生氧化应激损伤,降低细胞存活率。而褪黑素处理SH-SY5Y 细胞后,可恢复H2O2抑制的细胞存活率,且呈剂量依赖性。同时褪黑素可下调H2O2提高的ROS 水平和细胞凋亡率。上述结果表明褪黑素通过抑制H2O2引起氧化应激损伤,改善SH-SY5Y 细胞存活率。
目前普遍认为,ROS 和RNS 是维持细胞自噬的主要细胞内信号传感器,所有细胞来源的ROS均通过激活自噬和细胞凋亡等机制保证组织在氧化应激损伤中的存活[15-17]。自噬是一种细胞应对压力条件的溶酶体降解过程,可去除改变的蛋白质和功能失调的细胞器,以维持细胞稳态[18]。而在压力情况下,内质网环境受损导致蛋白质成熟受损,从而引起内质网应激。内质网应激源可以调节自噬,自噬反过来诱导细胞存活或死亡[19]。褪黑素具有抗氧化和抗炎作用,可以调节细胞凋亡和细胞自噬[20-21]。研究[22]显示:褪黑素可调节内质网应激过程的许多靶点,其除了起抗氧化和抗细胞凋亡作用以及抑制内质网应激外,还可诱导与兔出血性疾病病毒感染相关的自噬,减少并抑制病毒RNA 复制。在小鼠实验中,褪黑素能通过增强小鼠创伤性脑损伤后的自噬途径,减轻小鼠继发性脑损伤[23]。本研究结果显示:随着褪黑素浓度的增加,自噬关键蛋白LC3-Ⅱ表达水平逐渐升高,自噬泡荧光强度逐渐增加,表明褪黑素可激活SH-SY5Y 细胞自噬。
为了验证褪黑素是否通过自噬改善SH-SY5Y细胞存活率,本研究采用了一种非选择性褪黑素受体拮抗剂Luzindole。有研究[24]显示:褪黑素通过阻断ROS 积累和p53/ERK/p38 激活在铁过载诱导的成骨分化功能障碍及衰老过程中发挥保护作用,而这种保护作用可以被Luzindole 消除。另外,褪黑素通过激活SIRT6 和AMPK-PGC-1α-AKT 信号通路增强线粒体自噬,减轻糖尿病心肌病并降低心肌对缺血再灌注损伤的易感性,而Luzindole 能抑制褪黑素的保护作用[25]。本研究结果证实:加入Luzindole 后,褪黑素对SH-SY5Y 细胞的存活率升高、凋亡率降低、ROS 水平降低、自噬激活的作用均被减弱。这些结果表明:褪黑素通过激活SHSY5Y 细胞自噬,抵抗H2O2引起氧化应激损伤,改善SH-SY5Y 细胞存活率。
综上所述,褪黑素能促进H2O2诱导的SHSY5Y 细胞的增殖,降低细胞凋亡,提示褪黑素在神经元细胞氧化应激损伤过程中具有重要的保护作用,其机制可能与调节细胞中ROS 水平,提高神经细胞自噬水平有关。

