美洲大蠊肠道产7-木糖紫杉烷糖基水解酶菌株的筛选及鉴定
唐彬 刘文彬 李小波 王宁 金小宝
(广东药科大学生命科学与生物制药学院 广东省生物活性药物研究重点实验室,广州 510006)
紫杉醇(taxol)是一种二萜类抗癌化合物,已在临床上广泛应用于晚期卵巢癌、乳腺癌、非小细胞肺癌等的治疗[1-2]。紫杉醇市场需求大,但紫杉醇主要存在于资源有限、生长缓慢的红豆杉属植物的树皮中,且含量仅有0.01%-0.07%,导致紫杉醇原料药价格高昂,市场供不应求[3]。目前,紫杉醇的获得方法有天然植物提取法、化学全合成法、化学半合成法、植物体外细胞培养法、植物内生真菌提取培养法以及代谢工程等[4]。化学半合成是唯一得到应用的工业化生产方法。紫杉醇的半合成指以10-去乙酰巴卡亭Ⅲ(10-deacetylbaccatin III,10-DAB)为前体通过10步化学反应合成紫杉醇[5]。7-木糖紫杉烷类化合物属于紫杉醇母核类化合物,主要存在于红豆杉的根、茎、叶中,含量丰富,这类化合物包括:7-木糖-10-去乙酰基紫杉醇(7-β-xylosyl-10-deacetylpaclitaxel,7-XDT)、7-木糖-10-去乙酰基三尖杉宁碱、7-木糖-10-去乙酰基巴卡亭Ⅲ等,如7-XDT在红豆杉树皮中的含量高达0.5%,但是在传统的制备工艺中,这类化合物往往被当做副产物处理,没有得到有效利用[6-7]。
7-木糖紫杉烷糖基水解酶(7-β-xylosyltaxanes glycoside hydrolases,7-β-xyl) 是 一 种 β-木 糖 苷 酶(EC3.2.1.37)。研究报道放线菌Leifsonia shinshuensis产生的7-β-xyl可通过水解7-XDT的C7位的木糖基团生成10-去乙酰紫杉醇(10-deacetylpaclitaxel,10-DAT)和10-DAB[8]。10-DAT虽无法用于目前的紫杉醇的半合成,但在红豆杉中,10-去乙酰巴卡亭III 10 β-O-乙酰转移酶(10-deacetylbaccatin III-10-β-O-acetyltransferase,DBAT)可直接通过C-10位羟基乙酰化反应将10-DAT转化为紫杉醇[6]。蜚蠊、白蚁等蜚蠊目昆虫均有食木的习性,已有研究报道美洲大蠊肠道内生菌可产生高活性木聚糖酶[9],目前尚未见从美洲大蠊肠道内生菌中发现7-β-xyl的相关报道。课题组前期从美洲大蠊肠道分离获得159株放线菌和122株非放线菌[10]。本研究拟从美洲大蠊肠道内生菌中筛选高产7-β-xyl的菌株,旨在为7-β-xyl提供新的酶源。
1 材料与方法
1.1 材料
1.1.1 供试菌株 美洲大蠊肠道内生菌,为本课题组前期分离所得,保存于广东省生物活性药物研究重点实验室。
1.1.2 主要培养基 高氏合成I号培养基;木聚糖液体培养基:硫酸铵1.0 g/L,磷酸氢二钾7.0 g/L,磷酸二氢钾3.0 g/L,七水硫酸镁0.1 g/L,氯化钠0.5 g/L,木聚糖2.0 g/L,蒸馏水溶解并定容至1 L,调节pH为7.2-7.4;木聚糖琼脂培养基:在木聚糖液体培养基中加入1.5%的琼脂。
1.1.3 主要实验仪器 GelDoc XR+凝胶成像系统(美国Bio-Rad公司,美国);N-1300V-WB旋转蒸发仪(日本东京理化器械株式会社,日本);ZWY-1102C温控回旋立式双层摇床(上海智诚分析仪器制造有限公司,上海);2695-2996高效液相色谱仪(美国Waters公司,美国)。
1.1.4 主要实验试剂 7-XDT标准品(上海麦克林生化科技有限公司,Lot:C12006981);10-DAT标准品(上海源叶生物科技有限公司,Lot:MO1028SE13);10-DAB标准品(上海源叶生物科技有限公司,Lot:H11S9X70008);玉米芯木聚糖(上海源叶生物科技有限公司,Lot:Y04J11J117661);4-甲基伞形酮-β-D-木糖苷(上海源叶生物科技有限公司,Lot:K27D8B50806);刚果红(天津市福晨化学试剂厂)。
1.2 方法
1.2.1 产木聚糖酶菌株的筛选
1.2.1.1 刚果红透明圈法初筛产木聚糖酶菌株 用灭菌牙签挑选单菌落点接在以木聚糖为唯一碳源的木聚糖琼脂平板培养基上,于28℃培养7 d。0.1%的刚果红浸染30 min,再用1 mol/L的NaCl洗液脱色30 min。测量透明圈直径(D)、菌落直径(d),并计算透明圈直径与菌落直径的比值(D/d)[11]。
1.2.1.2 荧光显色法复筛产木聚糖酶菌株 木糖苷酶可水解4-甲基伞形酮-β-D-木糖苷的木糖苷键,生成小分子基团和荧光发色基团,在365 nm下可发出强烈荧光[12]。将4-甲基伞形酮-β-D-木糖苷喷洒于培养7 d具有透明圈的菌落上,静置1 h,在365 nm紫外灯照射下观察,同时拍照记录。
1.2.2 薄层色谱法筛选产7-β-xyl菌株 参照Wang等[13]的方法,选取D/d值较大且荧光显色的菌株作为受试菌株,挑取单个菌落接种于装有100 mL木聚糖液体培养基的300 mL摇瓶中,28℃、180 r/min培养3 d,进行菌株增菌培养。再将5 mL的种子菌悬液接种于50 mL木聚糖液体培养基,继续摇瓶发酵2 d,在发酵液中加入4 mL 0.5 mg/mL的7-XDT甲醇溶液,继续培养4 d。发酵液于4℃、8 000 r/min的条件下离心15 min,取上清液用等体积的乙酸乙酯萃取3次,萃取液减压浓缩。每50 mL发酵液萃取物用1.5 mL甲醇溶解,以氯仿-甲醇(9∶1,V/V)为展开剂进行薄层色谱法(thin layer chromatography,TLC)点板,5%硫酸乙醇溶液100℃加热显色。7-XDT、10-DAT、10-DAB标准品溶液采用甲醇配制,浓度为0.5 mg/mL。
1.2.3 高产7-β-xyl菌株WA11-2-9的鉴定
1.2.3.1 形态学和生理生化鉴定 菌株WA11-2-9接种于高氏合成Ⅰ号培养基,置于28℃培养5-7 d,观察菌落的形态特征,并通过革兰染色法观察菌体形态和颜色。根据《链霉菌鉴定手册》[14]测定生理生化特性。
1.2.3.2 分子生物学鉴定 使用细菌基因组DNA抽提试剂盒(生工生物工程股份有限公司,中国)提取菌株WA11-2-9的DNA,使用通用引物(27F :5′-AGAGTTTGATCCTGGCTCAG-3′;1492R :TACGGCTACCTTGTTACGACTT)对目标菌株的16S rDNA 基因进行扩增,取PCR扩增产物进行1%琼脂糖凝胶电泳分析,并送华大基因公司测序。将WA11-2-9的16S rDNA序列与NCBI与已知的序列进行同源性比对,将比对的结果利用Mega7.0软件构建系统发育树。同时将该菌株序列上传至NCBI的GenBank数据库,申请登录号(GenBank Accession)。
1.2.4 转化产物10-DAT转化率的测定
1.2.4.1 10-DAT标准曲线的制备 分成配制0.05、0.10、0.15、0.20、0.30、0.40 mg/mL 的 10-DAT溶液。高效液相色谱法(high performance liquid chromatography,HPLC)重复进样3次,测定10-DAT峰面积。绘制10-DAT浓度-峰面积标准曲线。
色谱条件:流动相为乙睛∶水(45∶55,V/V),检测波长230 nm,检测器PDA(光电二极管阵列),进样体积10 μL,流速0.8 mL/min,柱温室温,色谱 柱 YMC-Pack ODS-AQ C18柱(250 mm×4.6 mm ODS-5 μm,12 nm)。
1.2.4.2 菌株WA11-2-9转化率的测定 将从章节1.2.2得到转化产物样品进行HPLC分析,并与7-XDT、10-DAT、10-DAB三种标准品图谱进行比对。重复进样3次,测定转化产物峰面积。样品转化产物10-DAT峰面积代入10-DAT标准曲线的线性回归方程,计算转化产物10-DAT的浓度。样品转化率(%)=生成10-DAT摩尔数/转化前7-XDT摩尔数×100%。
1.2.5 7-β-xyl酶学性质的初步研究
1.2.5.1 最适反应温度和pH 最适反应温度:将粗酶液分别置于20、25、30、35、40、45和50℃水浴条件下反应后,测定β-木糖苷酶酶活,以最高酶活为100%,计算其相对酶活。最适反应pH:分别在 pH 为 3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0的条件反应后,测定β-木糖苷酶酶活,以最高酶活为100%,计算其相对酶活。β-木糖苷酶的酶活测定方法参考汤勇等[15]的方法。
1.2.5.2 温度稳定性、酸碱稳定性和金属离子稳定性 温度稳定性:将粗酶液分别在20、25、30、35、40、45和50℃提前孵育1 h,然后迅速冷却至4℃,并测定β-木糖苷酶酶活,以未处理的酶液酶活为100%,计算其相对酶活。酸碱稳定性:将粗酶液用不同的pH的缓冲液稀释10倍,4℃孵育1 h,并测定β-木糖苷酶酶活,以未处理的酶液酶活为100%,计算其相对酶活。金属离子稳定性:配制 0.1 mol/L不同金属离子溶液(Mg2+、Ca2+、Fe3+、Zn2+、Na+和K+),按 1 / 500 的体积比加入到酶液中,4℃孵育1 h,并测定β-木糖苷酶酶活,以未处理的酶液酶活为100%,计算其相对酶活。
2 结果
2.1 产木聚糖酶菌株的筛选
根据产透明圈和产荧光显色的指示,测试的178株美洲大蠊肠道内生菌中,55株菌具有木聚糖酶活性。如图1-A所示,55株菌中包含41株放线菌和14株非放线菌。41株放线菌分属于6个属,包含链霉菌属(Streptomyces)30 株、纤维菌属(Cellulomonas)4株、小单胞菌属(Micromonospora)3株、白蚁菌属(Isoptericola)2株、无色杆菌属(Achoromobacter)1株、戈登氏菌属(Gordonia)1株。如图1-B所示14株非放线菌包含3株巴氏菌(Pasteurella)、3株肠球菌(Enterococcus)、2株贪铜菌(Cupriavidus)、2株柠檬酸杆菌(Citrobacter)、2株嗜麦芽窄食单胞菌(Stenotrophomonas maltophilia)、1株克吕沃尔氏菌(Kluyvera)、1株摩根氏菌(Morganella)。刚果红水解圈结果如图2所示,透明圈直径(D)、菌落直径(d)以及透明圈直径与菌落直径比值(D/d)如表1所示,菌株荧光显色图如图3所示。

图3 产木聚糖酶菌株的荧光显色图Fig.3 Fluorescence color image of xylanase-producing strain
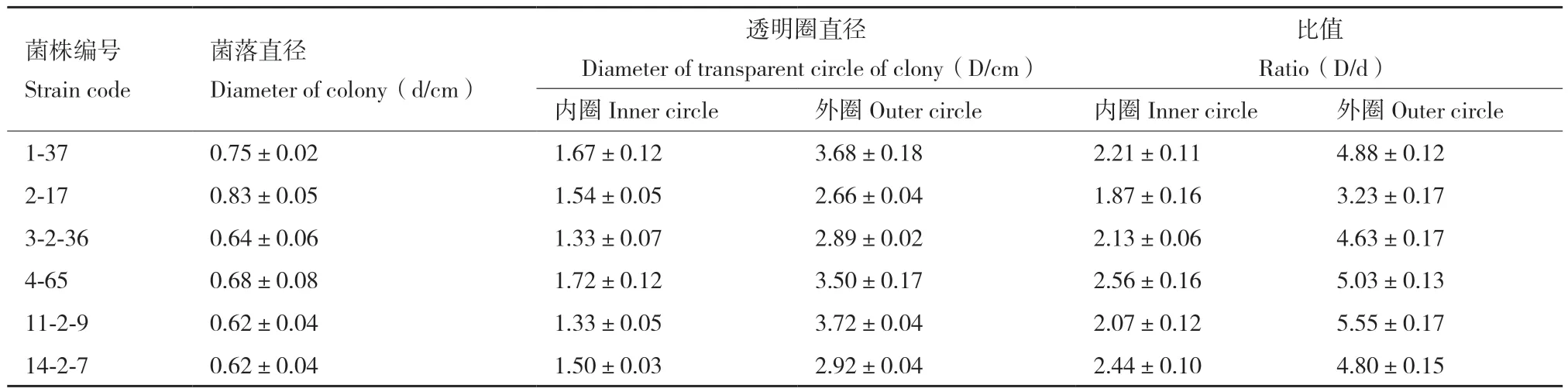
表1 产木聚糖酶菌株的菌落直径、刚果红透明圈直径及比值Table 1 Colony diameters,Congo red transparent circles and their ratios of xylanase-producing strains(n=3)
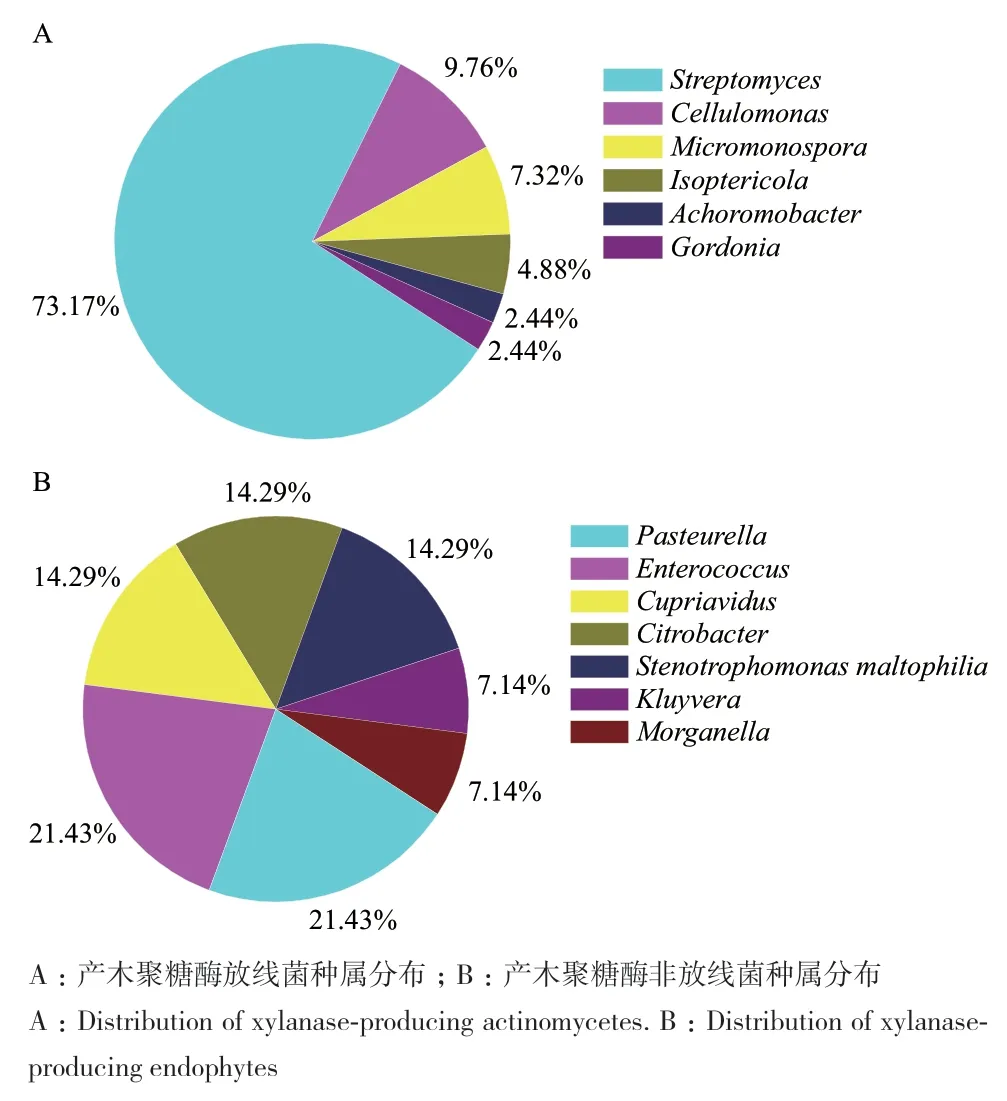
图1 产木聚糖酶菌株种属分布Fig.1 Distribution of xylanase-producing strains
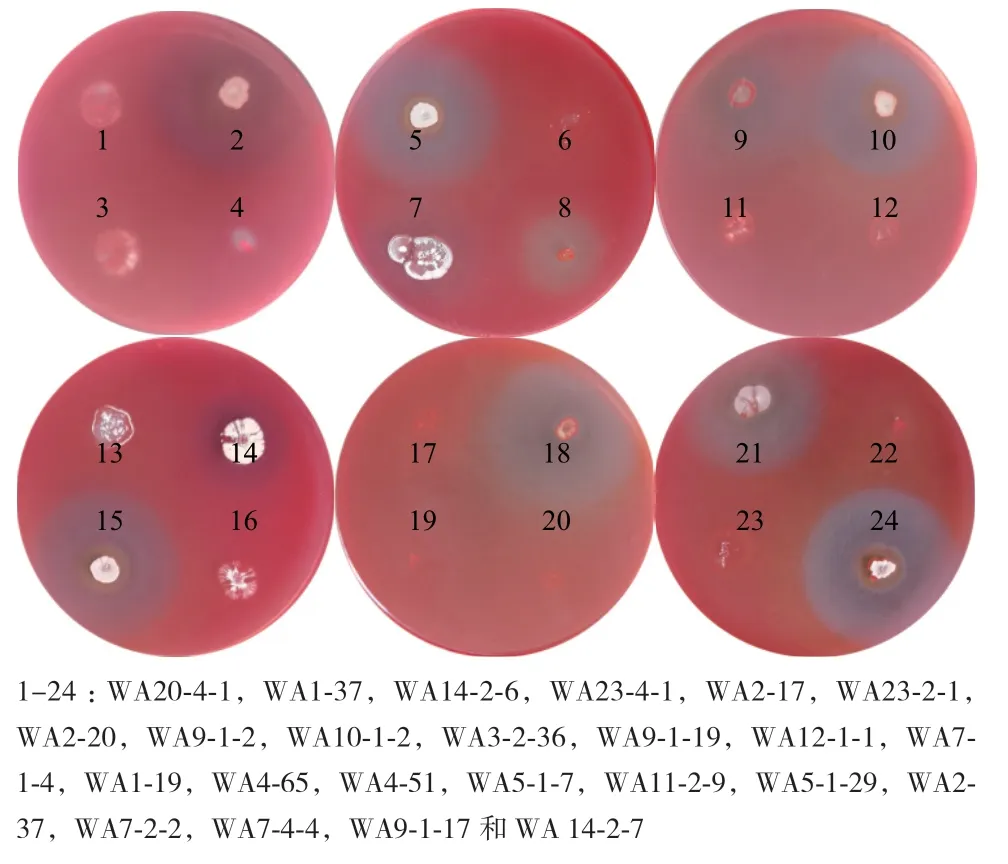
图2 产木聚糖酶菌株的刚果红水解圈Fig.2 Congo red transparent circles of xylanase-producing strains
2.2 产7-β-xyl菌株的筛选和转化产物的初步鉴定
TLC结果显示7-XDT的转化产物以10-DAT为主,未见明显10-DAB斑点。其中10株菌具有将7-XDT转化为10-DAT的能力,分别为8株链霉菌(WA 1-37、WA 2-17、WA 2-34、WA 3-2-36、WA 4-65、WA 11-1-1、WA 11-1-3和WA 11-2-9)和2株贪铜菌(WA 14-2-3和WA 14-2-7)。其中菌株WA11-2-9有较好的转化效果,故选取菌株WA11-2-9进行后续研究。转化产物TLC显色如图4所示。
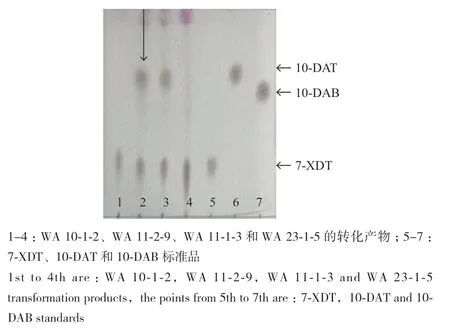
图4 菌株WA11-2-9转化产物TLC结果Fig.4 TLC result of transformed product of strain WA11-2-9
2.3 菌株WA11-2-9的鉴定
2.3.1 菌株WA11-2-9的形态学观察 菌株WA11-2-9菌落在高氏合成Ⅰ号培养基上呈圆形,灰白色,干燥无光泽,不透明,轻微隆起(图5-A)。革兰染色为阳性,菌体呈短杆形(图5-B)。基本符合链霉菌的形态特征。
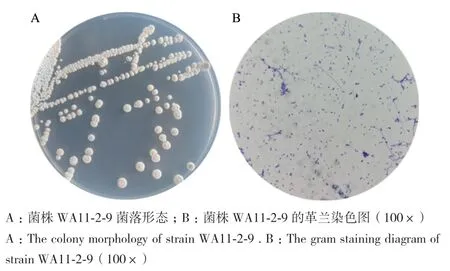
图5 菌株WA11-2-9的形态学特征Fig.5 Morphological characteristics of strain WA11-2-9
2.3.2 菌株WA11-2-9的生理生化鉴定 WA11-2-9生理生化试验结果如表2所示,结果基本符合Streptomyces enissocaesilis的生理生化特性。

表2 菌株WA11-2-9的生理生化特征Table 2 Physiological and biochemical characteristics of strain WA11-2-9
2.3.3 菌株WA11-2-9的分子生物学鉴定 将PCR反应产物进行1% 琼脂糖凝胶电泳,结果(图6-A)显示目的条带在1 000-2 000 bp之间。经测序、Blast同源性比对,结果(图6-B)表明该菌株与Streptomyces enissocaesilis strain NRRL B-16365处于同一分支,相似性高达100%。结合形态学、生理生化特性和分子生物学特征可将菌株WA11-2-9鉴定为Streptomyces enissocaesilis。将菌株WA11-2-9的16S rDNA通过 Bankit 向 GenBank 申请获得登录号为MZ411692。

图6 菌株WA11-2-9 分子生物学鉴定Fig.6 Molecular biology identification of strain WA11-2-9
2.4 转化产物10-DAT转化率的测定
2.4.1 10-DAT标准曲线的制备 以10-DAT浓度为横坐标,峰面积为纵坐标,绘制标准曲线。10-DAT标准曲线如图7所示。线性回归方程为y = 2 587x +45.60,R2= 0.999,线性拟合良好。
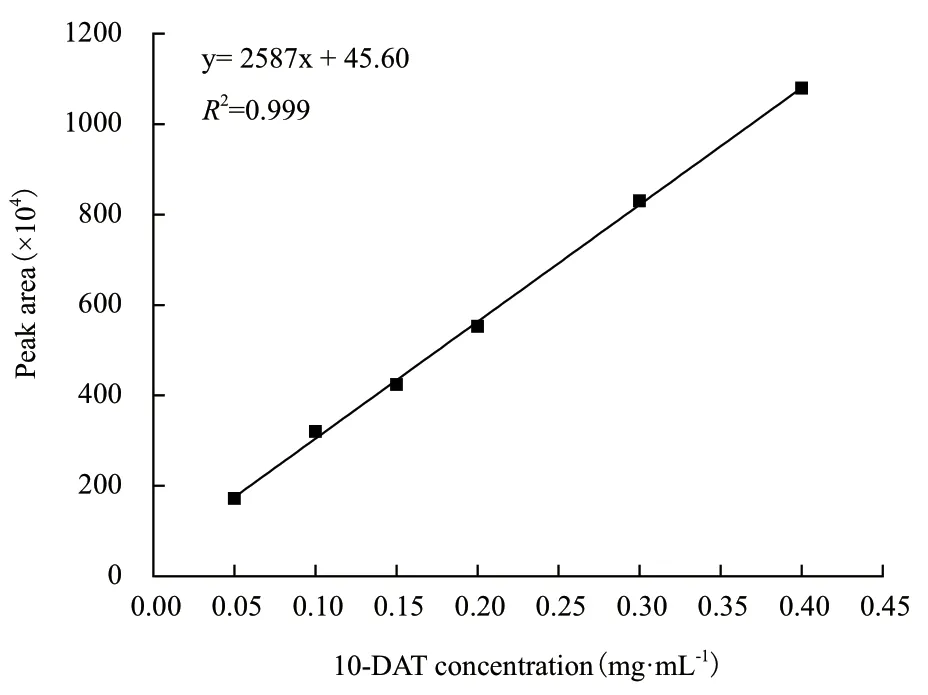
图7 10-DAT的标准曲线Fig.7 10-DAT standard curve
2.4.2 标准品和菌株WA11-2-9的HPLC分析图谱结果 由图8可知,7-XDT、10-DAT、10-DAB三种标准品保留时间分别为10.595 min、17.873 min和5.776 min。菌株WA11-2-9转化产物在10.595 min、17.852 min和5.762 min均有吸收峰,表明可WA11-2-9可将7-XDT转化为10-DAT和10-DAB,转化产物以10-DAT为主,经计算菌株WA11-2-9将7-XDT转化为10-DAT的转化率为21.52%。
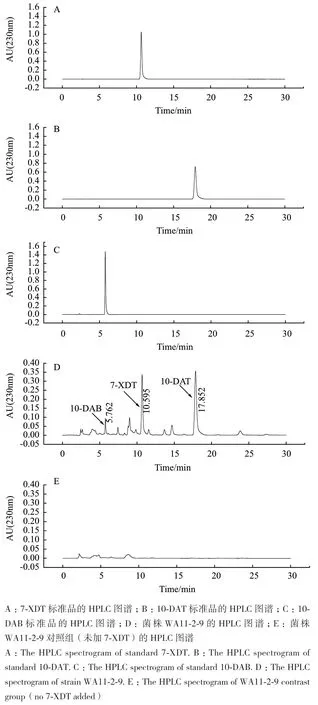
图8 菌株WA11-2-9转化产物的HPLC分析图谱Fig.8 HPLC analyzing spectrum of transformed product of strain WA11-2-9
2.5 7-β-xyl酶学性质的初步结果
2.5.1 最适反应温度和pH 7-β-xyl酶促反应最适反应温度是35℃(图9-A),最适反应pH为6.0(图9-B)。
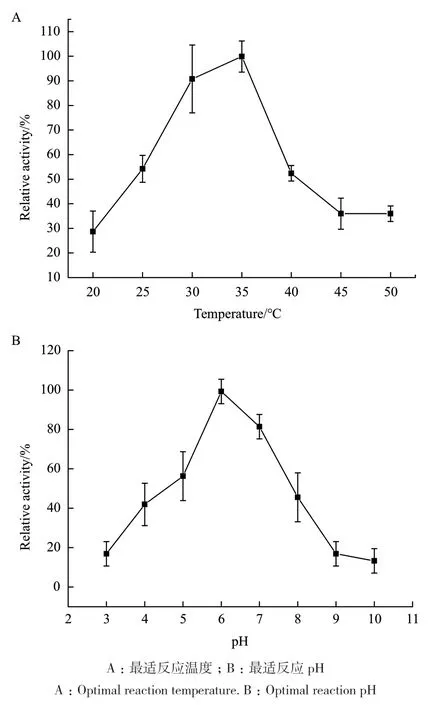
图9 7-β-xyl的最适反应温度和pHFig.9 Optimal reaction temperature and pH of 7-β-xyl
2.5.2 温度稳定性、酸碱稳定性、金属离子稳定性 7-β-xyl在20℃时最稳定,随着温度逐渐上升,稳定性逐渐下降(图10-A);7-β-xyl在pH 6-7范围内稳定性较强,酶活力超过70%(图10-B);金属离子的稳定性如图10-C所示,Ca2+、Zn2+、K+对酶活有促进作用,其中Ca2+作用最为显著,而Na+、Mg2+稍有抑制作用,Fe3+有较强的抑制作用。
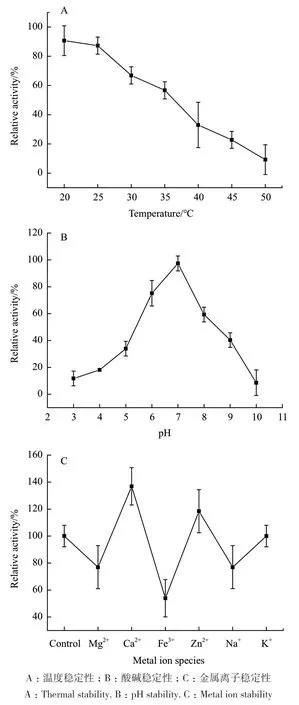
图10 7-β-xyl的温度稳定性、酸碱稳定性和金属离子稳定性Fig.10 Thermal stability,pH stability and metal ion stability of 7-β-xyl
3 讨论
β-木糖苷酶属于木聚糖酶,是木聚糖类半纤维素水解酶系的重要组成部分,主要催化水解木糖苷基团[16]。β-木糖苷酶主要存在于细菌、真菌、放线菌等微生物和部分高等植物中[17-18]。7-β-xyl是一种β-木糖苷酶,已在放线菌和细菌、真菌中发现[19]。美洲大蠊,俗称蟑螂,食性复杂,肠道生理生化环境
复杂特殊,肠道微生物菌群多样[20]。本研究通过筛选发现美洲大蠊肠道中链霉菌、纤维菌、小单胞菌、栖白蚁菌、无色杆菌、戈登氏菌等放线菌和巴氏菌、肠球菌、贪铜菌、柠檬酸杆菌、嗜麦芽窄食单胞菌、克吕沃尔氏菌、摩根氏菌等非放线菌均可产木聚糖酶。进一步研究发现其中美洲大蠊肠道内生链霉菌和贪铜菌均可产7-β-xyl。在此之前有其他学者已在链霉菌中发现了 7-β-xyl,如 Wang 等[13]和刘宇等[21]分别研究发现马特链霉菌、天蓝色链霉菌具有产生7-β-xyl的能力。
微生物转化法是利用微生物自身的酶类进行转化,与化学合成法相比具有反应条件温和且选择性强、环保无环境污染、副产物少、后处理简单等优势[22]。目前已有研究通过微生物转化法利用7-木糖紫杉烷类化合物或红豆杉树枝生产紫杉醇的半合成底物。李勇超等[23]发现用红豆杉枝条与菌株 Trichoderma sp.耦合发酵,可用于生产10-DAB;朱凤芝等[24]从污水处理厂污水中筛选中一株可将巴卡廷III高效转化为10-DAB的团泛菌(Pantoea agglomerans)。本研究中高产 7-β-xyl的菌株WA11-2-9鉴定为Streptomyces enissocaesilis,暂未看到Streptomyces enissocaesilis能产生β-木糖苷酶的报道。7-XDT的转化研究中显示WA11-2-9可将7-XDT转化为10-DAT和10-DAB,且以10-DAT为主。这说明7-XDT发生了C-7木糖水解反应生成了主要产物10-DAT,同时也发生了13位侧链水解反应产生了副产物10-DAB,结果同李建华[25]的一致。因此推测7-β-xyl有不同亚型,从而导致7-XDT酶解产物的多样化,如只产10-DAT、只产10-DAB、既产10-DAT又产10-DAB。文献报道7-XDT通过糖基水解酶LXYL-P1-2和DBAT相偶联,将7-XDT直接转化为紫杉醇[6],这提示我们在后续研究中可以通过基因工程技术在红豆杉细胞中过表达7-β-xyl基因,促进红豆杉中紫杉醇的表达。也可以通过在体外共表达7-β-xyl和DBAT,通过“一锅法”酶催化合成紫杉醇。
进一步研究显示WA11-2-9将7-XDT转化为10-DAT的转化率为21.52%。李建华等[26]从土壤微生物中筛选获得3株能够特异将7-XDT转化为10-DAT的微生物,但是转化率仅为5%。在张衡的研究中通过培养基优化,使ITM-1512菌株10-DAT的转化率可达到 40.66%±13.22%[27]。Li等[28]对嗜热细菌Dictyoglomus turgidum中的7-β-xyl进行了原核表达,获得的重组酶将7-XDT转化为10-DAT的转化率达到了98%。Dou等[29]从云南红豆杉的根际土壤中分离得到一株能产生7-β-xyl的Cellulosimicrobium cellulans菌株,并通过优化7-β-xyl粗酶的反应条件显著提高7-β-xyl的转化效率,3 h可以将98%的7-XDT转化为10-DAT。上述研究提示我们在后续的研究中,应通过优化产酶培养基、优化反应条件、酶学性质的研究等方法进一步提高WA11-2-9的7-β-xyl转化效率。
4 结论
从178株美洲大蠊肠道内生菌中筛选出55株菌产木聚糖酶,其中8株链霉菌和2株贪铜菌可产生7-β-xyl。高产菌株WA11-2-9经形态学特征、生理生化试验和16S rDNA序列分析鉴定为Streptomyces enissocaesilis。菌株WA11-2-9可将7-XDT转化为10-DAB和10-DAT,主要产物10-去乙酰紫杉醇的转化率为21.52%。

