辣椒根际促生菌筛选鉴定及其促生效应初探
张垚, 张芝, 王志刚, 徐伟慧
(1.齐齐哈尔大学 生命科学与农林学院,黑龙江 齐齐哈尔 161006; 2.黑龙江省农业微生物制剂产业化技术创新中心,黑龙江 齐齐哈尔 161006)
辣椒是世界上最主要的蔬菜作物之一,随着人民生活水平的不断提高,对辣椒周年供应的需求更加迫切[1]。由于经济效益的诱惑和化学肥料的增产作用显著,致使辣椒长期连作以及设施生产中过量施用化肥[2],从而带来了土壤酸化、板结、病原菌富集、微生物群落环境恶化等问题,使辣椒发病率增高,品质降低,严重影响辣椒产业的可持续发展[3-4]。因此,寻求一种绿色环保、科学高效并能减少或代替化学肥料的新型肥料是当代农业生产所必需的[5]。微生物肥料含有活的微生物制剂,具有特定肥效,因能增加作物产量、提高作物品质、拮抗病原菌、诱导植物抗性、保护作物健康而备受关注,逐步成为现代农业生产中的重要肥料[6-7]。
植物根际促生菌(plant growth-promoting rhizobacteria,PGPR)是一种附生于植物根系或栖于根际土壤的有益菌,可促进植物生长及营养元素的吸收和利用,拮抗有害微生物,是开发和利用微生物肥料的有效菌种资源[8]。不同作物根际蕴藏着不同的菌种资源,且在根际上的定殖能力与作物的基因型及根系成分密切相关[9]。考虑到菌株在根际上的定殖能力、稳定性及菌株地域性等特点,从特定作物根际筛选菌株,制备专用作物的微生物菌剂或微生物肥料,能更好地实现对作物的增产作用。本研究以黑龙江省齐齐哈尔龙江县辣椒根际土为供试材料,筛选解磷菌、溶磷菌、固氮菌等根际促生菌,并对其促生效应进行初步探究,为辣椒专用微生物肥料的开发和应用提供参考。
1 材料与方法
1.1 材料
供试土壤采自龙江县辣椒的根际,供试培养基种类和配方如下:
LB培养基(1 L):酵母膏5.0 g,NaCl 8.0 g,蛋白胨10.0 g,pH 7.0。
PKO无机培养基(1 L):葡萄糖10.0 g,MgSO4·7H2O 0.3 g,(NH4)2SO40.5 g,NaCl 0.3 g,Ca3(PO4)22.0 g,KCl 0.3 g,MnSO4·H2O 0.03 g,FeSO4·7H2O 0.036 g,琼脂20.0 g,pH 7.0。液体培养基不加琼脂。
蒙金娜有机培养基(1 L):葡萄糖10.0 g,MgSO4·7H2O 0.3 g,(NH4)2SO40.5 g,NaCl 0.3 g,FeSO4·7H2O 0.03 g,KCl 0.3 g,MnSO4·H2O 0.03 g,卵磷脂0.2 g,CaCO31.0 g,酵母粉1.0 g,pH值7.0。
无氮培养基(1 L):蔗糖10.0 g,KH2PO40.2 g,CaCO31.0 g,MgSO40.2 g,NaCl 0.12 g,琼脂20.0 g,pH值7.2。
CAS(chrome azurolsul phonate)培养基:每100 mL含20%蔗糖溶液1 mL,10%酸水解酪素3 mL,1 mmol·L-1CaCl2100 μL,1 mmoL·L-1MgSO42 mL,琼脂1.8 g,在约60 ℃时缓慢加入磷酸盐缓冲液和CAS染液各5 mL,即得CAS蓝色培养基。
1.2 方法
1.2.1 菌株的分离与鉴定
称取辣椒根际土壤10 g,置于含有90 mL无菌水和少量玻璃珠的三角瓶中,在25 ℃、140 r·min-1下振荡培养20 min。梯度稀释后,将10-4、10-5、10-6、10-7、10-8浓度的土壤悬液0.2 mL分别涂布到固态PKO、蒙金娜和无氮培养基上,以筛选溶磷菌、解磷菌和固氮菌,每个梯度重复3次。涂布后将平板置于30 ℃恒温箱中培养,定期观察,挑取营养圈明显的单菌落纯化,并多次传代后保藏。
使用Ezup柱式细菌基因组DNA抽提试剂盒提取细菌DNA。采用细菌通用引物27F和1492R进行16S rDNA的PCR扩增。
PCR反应体系(20 μL)。DNA模板0.5 μL,10×ExTaqbuffer 2.0 μL,2.5 mmol·L-1dNTP Mix 1.6 μL,正向引物(27F)0.8 μL,反向引物(1492R)0.8 μL,5U ExTaq0.2 μL,ddH2O 14.1 μL。
PCR反应程序。95 ℃ 5 min→95 ℃ 30 s→51/57 ℃ 30 s→72 ℃ 1 min,24个循环,72 ℃10 min。
PCR产物送至上海美吉公司测序,核酸序列在NCBI的GenBank数据库中进行Blast比对,采用MEGA 5.0软件构建系统发育树,鉴定菌株种属[10]。
1.2.2 菌株分泌激素、铁载体、溶磷能力及安全性评价
溶磷能力测定。参考Ji等[11]的方法。将菌株接种于液体PKO培养基,于30 ℃下120 r·min-1振荡培养。24、48、72 h后取菌液离心,取上清液定容至25 mL后加入显色剂,以无菌培养基为对照组,测定菌株溶磷能力,每组重复3次。
生长素(IAA)测定。参考刘国强等[12]的方法。采用Salkowski显色法测定吸光值D530,绘制标准曲线。将菌株接于LB液体培养基中,置于摇床培养(30 ℃,120 r·min-1)24 h,制备种子液,按1%的接种量将种子液接入含有200 mg·L-1色氨酸的液体LB培养基中,置于摇床培养(30 ℃,120 r·min-1)24、48、72 h后,采用Salkowski显色法定量测定IAA,每组重复3次。
铁载体测定及安全性评价。参考王欢等[13]的方法。配置CAS培养基。每100 mL含20%蔗糖溶液1 mL,10%酸水解酪素3 mL,1 mmol·L-1CaCl2100 μL,1 mmol·L-1MgSO42 mL,琼脂1.8 g,在60 ℃时缓慢加入磷酸盐缓冲液(0.1 mol·L-1,pH 6.8,稀释10倍使用)和CAS染液各5 mL,即得CAS蓝色培养基。将菌接种于蓝色固体培养基,倒置培养,如出现透明圈则表明有铁载体生成。
溶血试验。参考李煜等[14]的方法,将待测菌株接种于血琼脂平板,置于保温箱里培养18~24 h,观察有无溶血环产生。
赤霉素(GA)测定。参考徐伟慧等[15]的方法,将分析纯赤霉素溶于体积分数为70%的乙醇中,配置成赤霉素标准液,按照一定浓度梯度进行稀释,取各浓度的赤霉素溶液0.5 mL与4.5 mL浓硫酸充分混匀,置于冰浴中10 min,再置28 ℃水浴中1 h,取出置室温下放置15 min,测定D412吸光值,绘制标准曲线。将菌株接种于LB培养基中,置于摇床(30 ℃,120 r·min-1)上振荡培养24 h,制备种子液,按1%的接种量将种子液转接LB培养基中,摇床振荡(30 ℃,120 r·min-1)培养24、48和72 h后,分别取菌悬液离心(10 000 r·min-1,10 min),取上清测定菌株赤霉素浓度,每组重复3次,确定各菌株最大赤霉素分泌量。
1.2.3 促生实验
促生菌剂对辣椒种子的萌发。参考韩丽珍等[16]的方法,选取辣椒种子于55~60 ℃水中浸泡15~20 min,分别将NC1和NC3菌培养至D600=1,然后将辣椒种子置于稀释20倍的菌悬液中浸泡8 h,将浸泡后的种子放入铺有2层滤纸的无菌培养皿(Ф=9 cm)中,每个培养皿中为15粒种子,每处理重复3次,以相同浓度的LB培养基浸种为对照(CK),将其放入28 ℃、相对湿度60%的气候箱中培养,培养期间使用无菌水保持湿润状态,培养7~14 d,发芽结束后统计种子发芽率,计算种子的发芽及活力状况,测量辣椒种子胚根长。
发芽指数=∑不同时间的发芽数/发芽日数。
活力指数=发芽指数×规定日期内幼苗或幼根的长度或质量。
菌剂对辣椒幼苗的促生效应。辣椒幼苗长至4~5片叶时,用NC1、NC3的菌悬液(D600=1)稀释20倍对幼苗进行浇灌,每7~10 d浇灌1次,以浇灌相同浓度的LB培养基为对照,试验期间浇灌清水保持各处理的土壤墒情一致,每处理重复10株。在浇灌7次菌悬液后,测量植株茎粗、株高和干鲜重。
1.3 数据处理
采用Excel 2010进行数据整理,采用Origin 9.0 作图,应用SPSS软件系统进行数据处理及方差分析,采用DNAMAN软件进行序列间的两两比对。
2 结果与分析
2.1 菌株的分离和16S rRNA序列鉴定
在辣椒根际土壤分离到6株菌,包括1株溶磷菌(PC5L)、3株解磷菌(CJ1、CJ2、CJ3)和2株固氮菌(NC1、NC3)。根据16S rRNA测序结果和GenBank中已登录的核苷酸序列进行同源性比较发现,菌株PC5L与BacillusoryzaecorticisWJB118(KU877661.1)同源性较高,菌株NC3与BacillusmegateriymN1564-A29(JXD80182.1)同源性较高,菌株NC1与KlebsiellaaerogenesAY3(MT557012.1)同源性较高,菌株CJ3与Bacillussp.(in:Bacteria) CJKOP-125(MF537170.1)同源相似性高,菌株CJ2与Bacillussp.(in:Bacteria) 4B21(MZ277411.1)同源性较高,菌株CJ1与Bacillussp.(in:Bacteria) Y172001(MG914006.1)同源性较高,并采用MEGA 5.0软件构建菌株PC5L、NC3、NC1、CJ3、CJ2、CJ1的系统发育树(图1)。基于菌株的16S rRNA基因序列分析,将菌株PC5L、NC3、NC1、CJ3、CJ2、CJ1分别确定为Bacillusoryzaecorticis、Bacillusmegaterium、Klebsiellaaerogenes、Bacillussp.、Bacillussp.、Bacillussp.。经16S rRNA基因比对,菌株CJ1、CJ2、CJ3都属于Bacillussp.,通过DNAMAN软件进行两两间的序列比对分析,确定菌株CJ1、CJ2、CJ3非同种菌,只是亲缘关系较近。
2.2 菌株分泌IAA、GA和P的能力
由图2可知,24 h后,菌株溶磷能力依次是NC1>NC3>CJ3>CJ1>CJ2>PC5L,菌株NC1和NC3溶磷能力显著高于其他4个菌株;48 h后,菌株溶磷能力依次为NC3>NC1>PC5L>CJ3>CJ1>CJ2,菌株NC3溶磷能力显著高于其他菌株;72 h后,菌株溶磷能力依次是CJ3>NC1>CJ2>CJ1>PC5L>NC3。24和48 h后,供试菌株产生的赤霉素相差不大;72 h后,产生赤霉素含量最高的菌株是PC5L,其次是CJ2和CJ1。24 h后,菌株NC1与NC3分泌的IAA含量相近。48 h后,菌株分泌的IAA依次是CJ1>CJ3>CJ2>PC5L>NC1>NC3;在72 h供试菌株不分泌IAA。
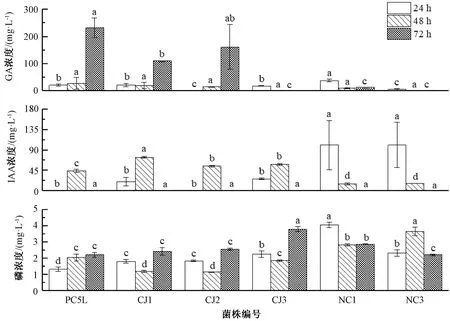
同一时间比较,柱上无相同小写字母表示组间差异显著(P<0.05)。
2.3 菌株产铁载体及溶血性评价
由表1可知,供试的6个菌株不产铁载体,也不具有溶血性。

表1 菌株产铁载体能力及溶血性评价
2.4 促生菌剂对辣椒种子萌发的影响
由于菌株NC1、NC3具有较高的溶磷能力和分泌IAA的能力,故选取菌株NC1、NC3分别对辣椒种子和幼苗进行处理,评估其对辣椒种子萌发和幼苗生长的影响。
由表2和图3可知,NC1菌悬液(D600=1)稀释20倍浸泡辣椒种子,对辣椒种子的萌发率影响不大,相比对照显著提高了辣椒种子的活力指数和主根长度,主根长度较对照提高88.3%。
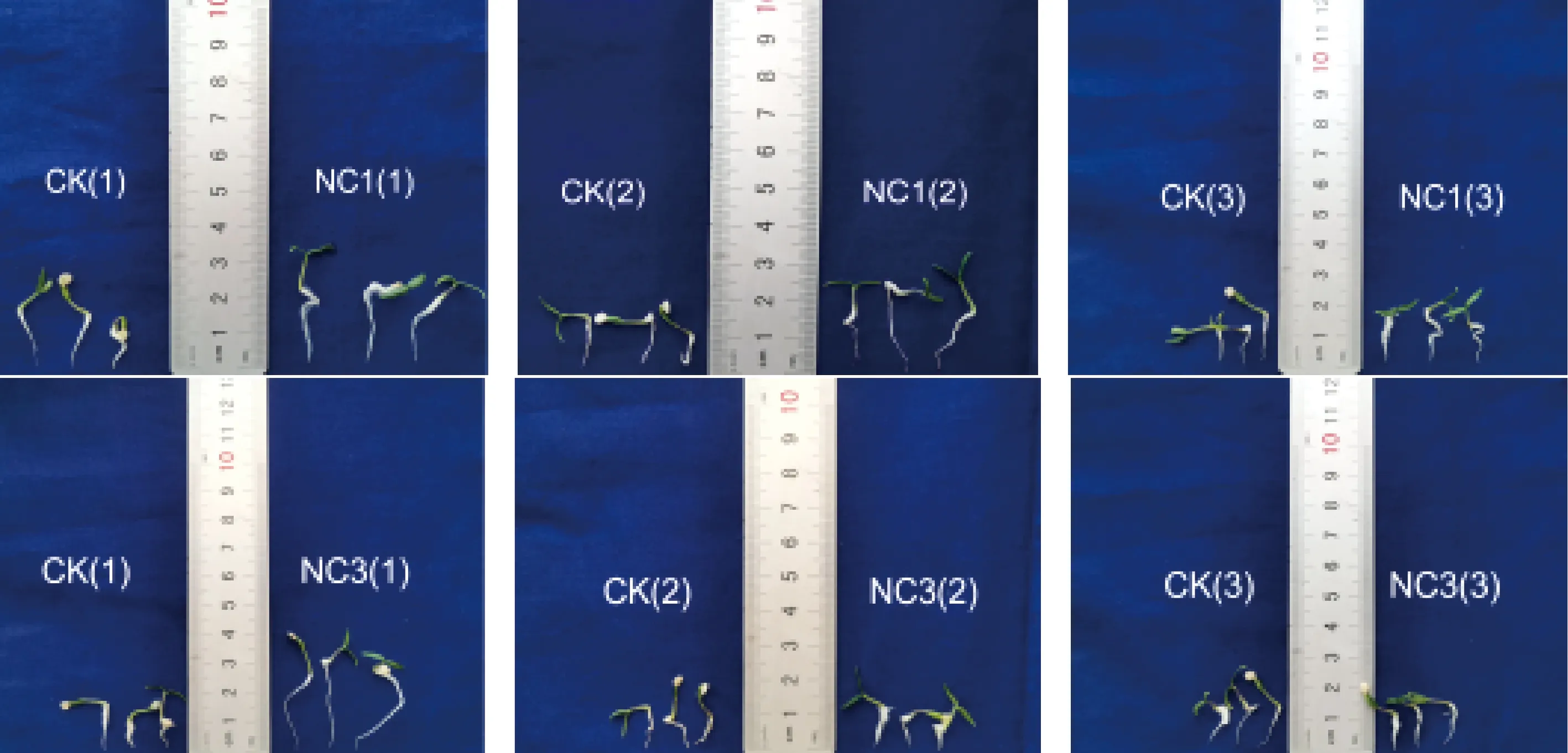
图3 NC1和NC3菌悬液处理后辣椒种子萌发形态

表2 NC1和NC3菌悬液处理对辣椒种子萌发的影响
2.5 促生菌剂对辣椒幼苗的促生的结果与分析
由表3和图4可知,2个菌株不同程度地促进了辣椒幼苗的生长,菌株NC1显著提高了辣椒的株高和干重,相比对照分别提高36.1%和58.8%;菌株NC3在株高和干重上分别比对照提高了19.3%和25.1%。可见在幼苗促生方面,菌株NC1优于菌株NC3。

图4 NC1和NC3菌悬液处理后辣椒幼苗形态

表3 NC1和NC3菌悬液对辣椒幼苗的促生效应
3 讨论
氮和磷在动植物生长过程中都是十分重要的营养元素,但在自然条件下,能被植物吸收利用的却很少。本研究筛选辣椒根际土壤中具有溶磷、解磷和固氮功能的菌株,共筛选出6株PGPR菌株,其中1株溶磷菌(PC5L),3株解磷菌(CJ1、CJ2、CJ3),2株固氮菌(NC1、NC3)。溶磷菌和解磷菌可通过产酸、整合、沉淀等方式直接或间接提高磷的利用率,促进作物增产,有效减少磷肥施用量[17-18],增加磷的利用率[19]。本研究结果表明,筛选出的6株菌都有不同程度的溶磷能力,且分离的2株固氮菌NC1和NC3也具备溶磷能力,可能与同一菌株具有不同功能有关。PGPR可通过产生植物激素、嗜铁素等物质促进植物生长[20]。本试验研究结果表明,PC5L菌株产赤霉素能力最强,NC1与NC3菌株产IAA能力最强,NC1菌株溶磷能力最强,6株菌都不产铁载体。
大部分PGPR可产生IAA,促进植物根系的生长发育[21]。王辰月等[22]研究也发现,产IAA的细菌对种子萌发有促进作用。一些PGPR自身不产植物激素,但可诱导宿主产生激素物质,促进其生长发育[23]。本研究以2种菌悬液的浸种萌发试验表明,菌株NC1、NC3对辣椒种子萌发和辣椒幼苗生长有不同程度的促进效应,原因可能是与2种菌株分泌IAA和赤霉素等有密切关系。根际促生菌能刺激侧生根的萌动、伸长、发育,影响根系形态,促进植物生长[24-26]。Sajeesh等[27]从茄子根际中筛选到溶磷菌,盆栽试验结果表明,接种溶磷菌的植株,其茎长、叶绿素含量、花果叶数量等均显著高于未接种溶磷菌的组别。本试验表明,菌株NC1和NC3能促进辣椒幼苗的生长,也可能与其提高了土壤中磷的利用率有关。
综上,本试验从辣椒根际筛选到6株PGPR,经16S rRNA碱基序列同源性分析,将6株菌分别鉴定为Bacillusoryzaecorticis、Bacillusmegaterium、Klebsiellaaerogenes、Bacillussp.、Bacillussp.、Bacillussp.。供试6株菌有不同的溶磷能力及产IAA和GA的能力,均无产铁载体的能力,不具有溶血性。种子萌发和促生试验表明,菌株NC1的菌悬液能促进辣椒种子的萌发和幼苗生长,菌株NC3菌悬液对辣椒幼苗生长有促进作用。

