蓝莓叶多酚对α-淀粉酶和α-葡萄糖苷酶的体外抑制活性研究
潘 玥,刘小莉,王 英,夏秀东,陶宁萍,吴 寒,刘思远,周剑忠,3*
1上海海洋大学食品学院,上海 201306;2江苏省农业科学院农产品加工研究所,南京 210014;3江苏大学食品与生物工程学院,镇江 212013
蓝莓是一种小浆果,甜酸适口,为鲜食佳品,属杜鹃花科,越橘属植物。在我国东北长白山、大兴安岭和小兴安岭林区有大量的野生蓝莓[1]。蓝莓富含糖类、萜类、氨基酸和大量多酚类等化合物,具有较高的营养价值和保健作用[2]。近年来,对其活性成分的研究日益增多。与蓝莓的果实和花相比,蓝莓叶的酚类物质含量更高[3]。目前蓝莓叶多酚在抗氧化能力[4]、降血压、抑菌[5]方面的研究较多,降血糖方面的研究很少。如今糖尿病已成为威胁人类健康的重大疾病之一[6]。α-淀粉酶和α-葡萄糖苷酶能够促进口腔、胃、肠道对食物的分解,释放葡萄糖进入血液,使血糖水平升高[7,8]。服用抑制剂类药物是目前治疗糖尿病的首选方式。市面上化学类药物容易引起胀气、消化不良等副作用[9],从天然物质中提取抑制剂更具安全性。已有研究报道植物提取物中多酚类、萜类衍生物[10]、多糖[11]、苯丙素类化合物[12]等具有良好的α-淀粉酶和α-葡萄糖苷酶抑制活性。多酚在预防和治疗糖尿病方面具有很大的潜力,Liu等[13]表明绿茶提取物中多酚具有抑制作用,能够抑制肠道上皮细胞Caco-2对葡萄糖的摄取和转运。Sun等[14]通过分子对接,探究出多酚能够与α-淀粉酶活性位点的氨基酸残基结合改变酶的分子构象,从而抑制其与底物结合。本文研究了蓝莓叶多酚对α-淀粉酶和α-葡萄糖苷酶的抑制作用和抑制类型,为蓝莓叶相关产品的开发提供理论依据。
2 材料与方法
1.1 材料与仪器
蓝莓叶2020年7月采自溧阳白露山生态农业发展有限公司蓝莓基地;AB-8大孔树脂(上海蓝季科技发展有限公司);无水乙醇(国药集团化学试剂有限公司);盐酸(成都市科龙化工试剂有限公司);氢氧化钠、酸二氢钠、磷酸氢二钠、碳酸钠、葡萄糖、苯酚和可溶性淀粉(西陇化工股份有限公司);没食子酸、福林酚试剂、对硝基苯基-α-D-吡喃葡萄糖苷(pNPG)和阿卡波糖(麦克林);α-淀粉酶(猪胰腺)(10 U/mg)和α-葡萄糖苷酶(上海源叶生物科技有限公司)。
Epoch酶标仪(美国Bioteck仪器有限公司);ML204/02电子分析天平、FE28-Meter台式pH计(梅特勒-托利多仪器有限公司);Deltal 2-24/LSC冷冻干燥机(德国Christ公司);3k15台式高速冷冻离心机(德国Sigma公司);RE-2000A旋转蒸发仪(上海亚荣生化仪器厂);KQ2 200DB数控超声波清洗器(昆山市超声仪器有限公司);DK-98-ⅡA电热恒温水浴锅(天津市泰斯特仪器有限公司)。
1.2 实验方法
1.2.1 蓝莓叶酚类物质的提取
参照Wu等[15]方法稍作改变,将新鲜蓝莓叶切片,按照料液比为1∶10(g/mL)加入酸化乙醇(含有0.5%盐酸的80%乙醇)匀浆2 min,超声辅助提取20 min,功率为800 W,超声结束后5 000 r/min离心10 min收集上清液。上述提取方法提取三次后合并溶剂。经40 ℃ 50 r/min旋转蒸发浓缩,得到蓝莓叶多酚粗提物,将其冻干后-20 ℃避光保存。
1.2.2 总酚含量的测定
参照Wu等[15]的方法,将蓝莓叶多酚冻干样配制成1 mg/mL溶液,取0.1 mL加入0.3 mL 10%乙醇稀释,再分别加入2.0 mL 0.5 mol/L福林酚试剂,摇匀,反应4 min,随后加入2 mL 75 g/L的饱和碳酸钠,摇匀,室温下暗反应2 h。用蒸馏水做空白对照,利用酶标仪在760 nm处测定吸光度。以没食子酸(GA)在760 nm处的吸光值绘制标准曲线,公式为y=1.744x+0.021(R2=0.990)。y为蓝莓叶多酚粗提液的吸光值,x表示总酚含量,mg GA/mg(DW),DW为干重。
1.2.3 蓝莓叶酚类物质的纯化
采用AB-8大孔吸附树脂对蓝莓叶多酚粗提物进行纯化,将100 mg粗提物溶于50 mL酸化乙醇中,经0.45 μm有机针膜过滤,按照Ma[16]方法进行纯化,合并洗脱液。在40 ℃旋转蒸发,蒸发至1/4体积停止,倒出溶液,-20 ℃下冻结溶液,冷冻干燥24 h,得到纯化后蓝莓叶多酚。
1.2.4 蓝莓叶多酚的鉴定
1.2.4.1 样品处理
将纯化后的蓝莓叶多酚冻干样用80%甲醇溶解,过0.22 μm有机滤膜,采用LC-MS鉴定。
1.2.4.2 液相色谱-质谱法(LC-MS)成分鉴定
样品采用LC-MS体系(G2-XS QTof,Waters)进行分析。将2 μL样品注入UPLC柱(2.1 mm×100 mm ACQUITY UPLC BEH C18柱,含有1.7 μm粒子),流速为0.35 mL/min。流动相A为0.1%甲酸水溶液,流动相B为 0.1% 甲酸乙腈水溶液。采用以下梯度程序:5% 流动相B,0.5 min;5%→40%流动相B,20 min;40%→95% 流动相B,2 min;95%流动相B,2 min。
质谱分析采用电喷雾源,正离子模式。MSe采集模式,选择质量范围50~1 200m/z。使用亮氨酸-脑啡肽(m/z556.277 1)校准质量。电离参数为:毛细管电压2.5 kV,样品锥 40 V,源温度120 ℃,脱溶剂气体温度为 400 ℃。使用Masslynx 4.1和Unifi 进行数据采集和处理。成分鉴定参照南京农业大学标准谱库,鉴定匹配度高于80%的化学成分。
1.2.5α-淀粉酶抑制实验
将蓝莓叶多酚浓度配制为2.5、5.0、7.5、10.0、12.5、15.0、17.5 μg/mL,阿卡波糖浓度配制为0、2.0、4.0、6.0、8.0、10.0、12.0 μg/mL。按照Tian[17]方法稍作改变,以阿卡波糖作为阳性对照,按照表1进行α-淀粉酶抑制实验,α-淀粉酶抑制率按下列公式计算。根据抑制率与蓝莓叶多酚浓度关系,通过GraphPad Prism 8软件拟合计算半抑制浓度IC50值。

表1 α-淀粉酶抑制活性测定

式中:ODA为实验组吸光值;ODa为实验空白组吸光值;ODB为对照组吸光值;ODb为空白组吸光值。
1.2.6α-葡萄糖苷酶抑制实验
将蓝莓叶多酚和阿卡波糖浓度配制为2、4、6、8、10、12、14 μg/mL,按照Tian[17]方法稍作改变,以阿卡波糖为阳性对照,按照表2进行α-葡萄糖苷酶抑制实验,α-葡萄糖苷酶抑制率按下列公式计算。根据抑制率与蓝莓叶多酚浓度关系,通过GraphPad Prism 8软件拟合计算半抑制浓度IC50值。
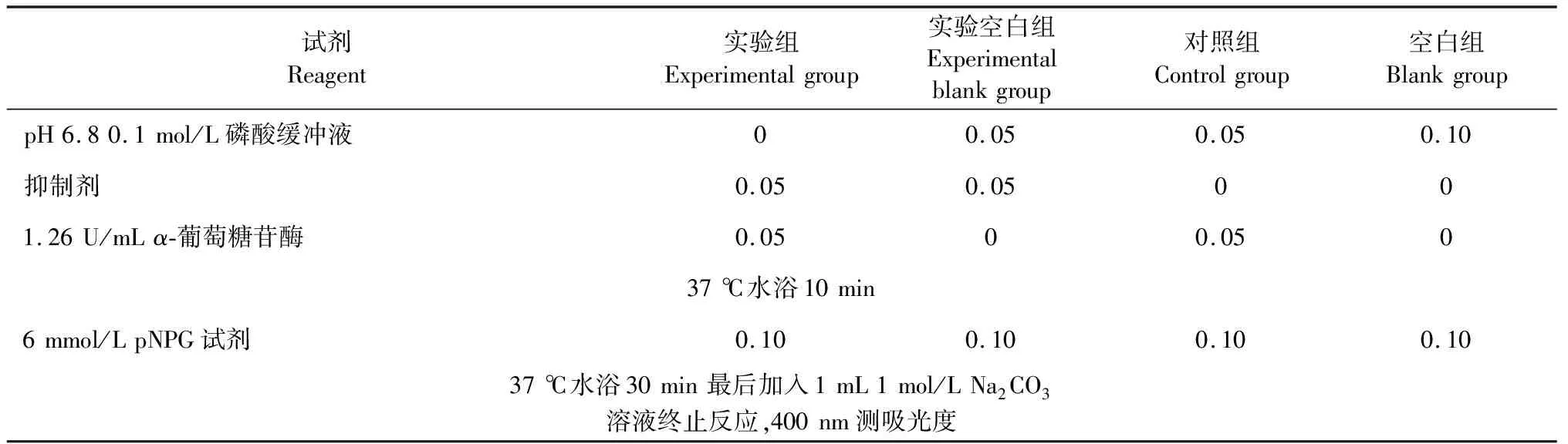
表2 α-葡萄糖苷酶抑制活性测定

式中:ODA为实验组吸光值;ODa为实验空白组吸光值;ODB为对照组吸光值;ODb为空白组吸光值。
1.2.7 蓝莓叶多酚稳定性研究
1.2.7.1 蓝莓叶多酚对温度的稳定性
将纯化后的蓝莓叶多酚配制成0.02 mg/mL溶液,分别在30、40、50、60、70、80、90 ℃水浴中保温30 min,迅速冷却至室温,测其α-淀粉酶和α-葡萄糖苷酶抑制活性,以温度为横坐标,以酶抑制活性为纵坐标,绘制曲线。
1.2.7.2 蓝莓叶多酚对pH的稳定性
将纯化后的蓝莓叶多酚配制成溶液,分别用不同pH(2、3、4、5、6、7、8、9、10、11、12)的PBS缓冲液溶解后于37 ℃保温4 h,用缓冲液回调pH至6.8和6.9,再将各个pH条件下处理的多酚稀释至相同浓度,测定其对α-淀粉酶和α-葡萄糖苷酶的抑制活性,以pH为横坐标,以酶抑制活性为纵坐标,绘制曲线。
1.2.8 抑制作用类型研究
1.2.8.1α-淀粉酶抑制动力学
将纯化后蓝莓叶多酚配制成浓度为0.02、0.04、0.06、0.08 mg/mL的溶液,α-淀粉酶溶液设置为0、0.15、0.3、0.45、0.6、0.75、0.9、1.05 mg/mL。计算酶促反应速率,绘制酶促反应速率与α-淀粉酶浓度的关系图。
将可溶性淀粉配制成0.25%、0.33%、0.5%、1.0%、2.0%,计算不同底物浓度和不同浓度蓝莓叶多酚下的酶促反应速率。绘制Lineweaver-Burk双倒数曲线图和Dixon图,分析确定蓝莓叶多酚对α-淀粉酶的抑制类型。
1.2.8.2α-葡萄糖苷酶抑制动力学
将纯化后蓝莓叶多酚配制成浓度为0.005、0.010、0.015、0.020 mg/mL的溶液,α-葡萄糖苷酶溶液设置为0、0.506、1.012、1.26、1.518、2.024 U/mL。计算酶促反应速率,绘制酶促反应速率与α-葡萄糖苷酶浓度的关系图。
将pNPG配制成2.5、3.3、5、10、20 mmol/L,计算不同底物浓度和不同浓度蓝莓叶多酚下的酶促反应速率。绘制Lineweaver-Burk双倒数曲线图和Dixon图,分析确定蓝莓叶多酚对α-葡萄糖苷酶的抑制类型。
1.3 数据处理
由Origin 2019软件绘制,所有实验重复测定3次,采用IBM SPSS Statistics 21.0软件整理及统计分析。
2 结果与分析
2.1 纯化前后蓝莓叶多酚含量及抑制活性的变化
为确定纯化前后蓝莓叶多酚含量和抑制活性,将纯化前后蓝莓叶提取物冻干样配制成相同浓度,按照“1.2.2”“1.2.5”和“1.2.6”方法分别测定并计算纯化前后总酚含量、α-淀粉酶和α-葡萄糖苷酶抑制活性的变化。通过图1蓝莓叶粗提物经纯化后的总酚含量可知纯化后蓝莓叶多酚纯度为36%,较纯化前提高了44.00%,α-淀粉酶抑制率提高了138.70%,α-葡萄糖苷酶抑制率提高了12.42%。纯化前后对α-淀粉酶抑制和α-葡萄糖苷酶活性提升极显著(P< 0.01),同等浓度下蓝莓叶多酚对α-葡萄糖苷酶抑制率高于α-淀粉酶。接下来的实验选择对纯化后蓝莓叶多酚,对其成分、温度和pH的稳定性、半抑制浓度IC50值及其抑制类型进行探究。
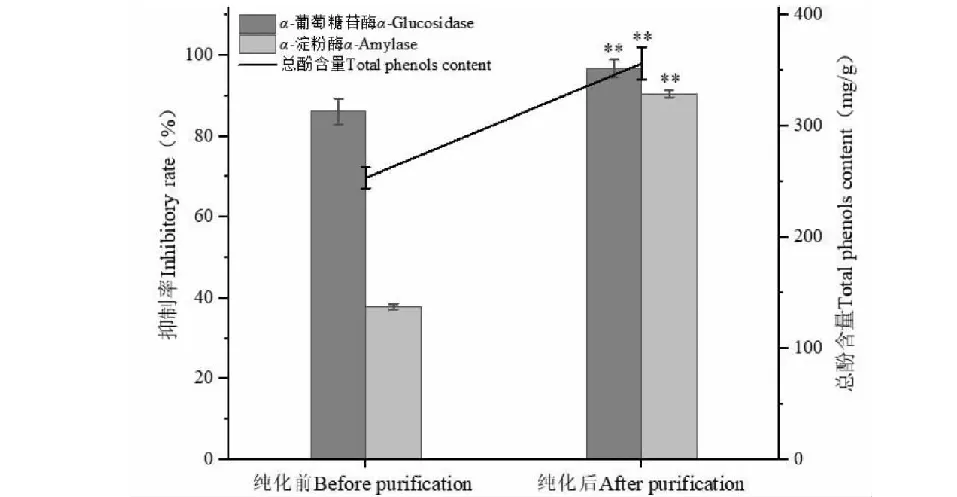
图1 蓝莓叶多酚纯化前后总酚含量和抑制活性的变化
2.2 蓝莓叶纯化后的多酚物质鉴定分析
从表3 LC-MS分析结果可以看出蓝莓叶提取物中多酚主要有绿原酸、5,6,7,3′,4′-五氢化二异黄酮、槲皮素、原花青素、3′-羟基染料木素、槲皮素-4′-O-葡萄糖苷、1,5-二阿魏酰奎宁酸等11种多酚物质,其中绿原酸含量最高。有研究表明,绿原酸是蓝莓叶中含量最高的酚类物质[18],其中绿原酸、阿魏酸、槲皮素、原花青素等,已被证明具有较强的α-淀粉酶和α-葡萄糖苷酶的抑制活性[19]。由“2.1”结果可知蓝莓叶多酚提取物中总酚含量与对α-淀粉酶和α-葡萄糖苷酶的抑制活性成正相关。结果表明,蓝莓叶提取物中多酚类化合物是其抑制α-淀粉酶和α-葡萄糖苷酶的主要物质基础。
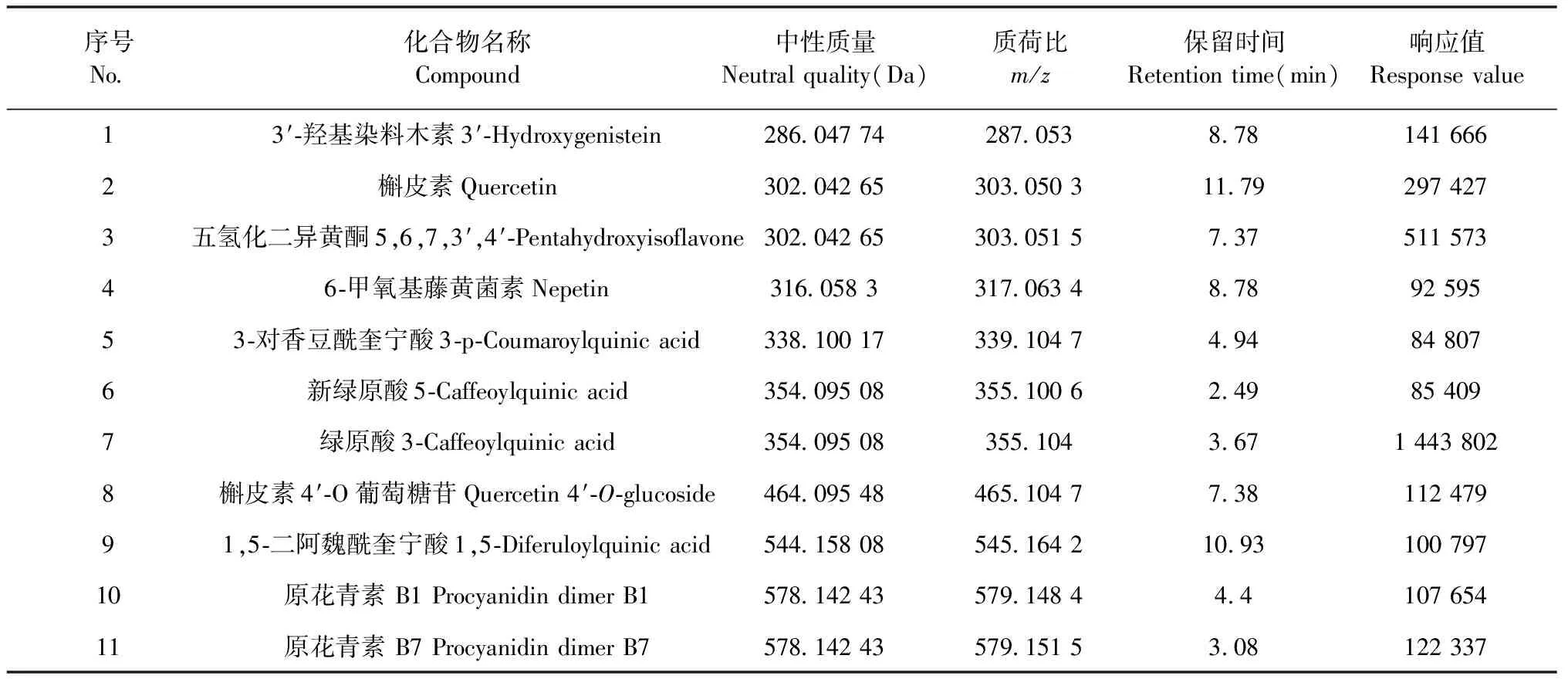
表3 蓝莓叶提取物成分分析结果
2.3 蓝莓叶多酚对温度的稳定性研究
由图2可知温度对蓝莓叶多酚抑制α-淀粉酶和α-葡萄糖苷酶的抑制活性的影响趋势大致相同。当温度在30 ℃和40 ℃时,蓝莓叶多酚对α-淀粉酶的抑制率无显著性差异(P> 0.05);40 ℃之后随温度升高,抑制率呈缓慢下降趋势,80 ℃作用30 min,抑制剂活性较40 ℃失去了19.38%;90 ℃作用30 min后,蓝莓叶多酚完全失活。温度在30~80 ℃时,蓝莓叶多酚对α-葡萄糖苷酶的抑制率呈下降趋势;当温度在80 ℃时,相比30 ℃抑制率失去了14.75%;90 ℃作用30 min后,蓝莓叶多酚几乎完全失活。以上实验结果说明提取物中有效活性成分容易受高温影响发生氧化反应,从而导致抑制率下降。
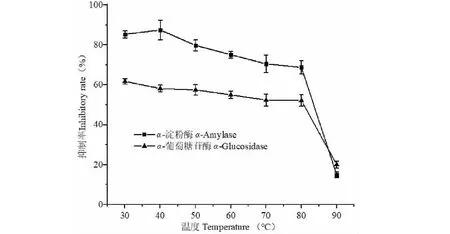
图2 温度对蓝莓叶多酚抑制活性的影响
蓝莓叶多酚对酶的抑制活性受温度影响较小。在37 ℃具有较高的抑制活性,说明其在人体内能够保持良好的效果;但当温度达到90 ℃时对α-淀粉酶和α-葡萄糖苷酶的抑制活性明显降低。在产品开发应用中应注意加工温度对其活性成分的影响,不宜高温。
2.4 蓝莓叶多酚对pH的稳定性研究
由图3可知蓝莓叶多酚经pH 2.0~8.0环境处理后能够保持其对α-淀粉酶的抑制活性,抑制率都超过了90%。当pH > 8.0时抑制率呈缓慢下降趋势,当pH为12.0时抑制率骤降至46.50%,说明蓝莓叶多酚经过碱性条件处理后对α-淀粉酶抑制活性影响较大。蓝莓叶多酚抑制α-葡萄糖苷酶活性受pH的影响较大,pH 2.0~5.0呈上升趋势,pH 5.0时,抑制率最大,达到73.06%。在pH 5.0之后,随着pH升高,α-葡萄糖苷酶抑制率逐渐降低。pH 7.0~8.0抑制率较pH 7.0骤降了45.49%,pH 8.0~11.0趋于稳定,pH 12.0时完全失去抑制活性。蓝莓叶多酚经pH 3.0~5.0处理后,对α-葡萄糖苷酶的抑制活性比较稳定,在强酸和碱性条件下不稳定。

图3 pH对蓝莓叶多酚抑制活性的影响
综上所述,蓝莓叶多酚在偏酸性条件下比较稳定,能够保持较高的抑制活性。而人体胃酸pH低于2,肠道pH在7.5左右[20],说明蓝莓叶多酚添加到食物中,在胃肠道消化环境下,仍能保持其抑制活性。在产品的开发研究中,将蓝莓叶多酚添加至酸性食品中,能够最大程度保持其功能活性。
2.5 蓝莓叶多酚对α-淀粉酶和α-葡萄糖苷酶的抑制活性研究
由图4可以看出随着蓝莓叶多酚和阿卡波糖对α-淀粉酶和α-葡萄糖苷酶的抑制作用随浓度增大而增大,且无限趋于100%,这表明蓝莓叶多酚和阿卡波糖对α-淀粉酶和α-葡萄糖苷酶的抑制作用与其活性成分含量有关。对其添加浓度(X)与抑制率(Y)之间的关系建立线性回归方程,并计算IC50值(见表4)。蓝莓叶多酚对α-淀粉酶的IC50值(10.926 μg/mL)大于α-葡萄糖苷酶的IC50值(7.276 μg/mL),表明蓝莓叶多酚对α-葡萄糖苷酶的抑制率达到50%所需浓度低于对同等酶活下的α-淀粉酶抑制率达到50%所需浓度,即在此范围内,蓝莓叶多酚对α-葡萄糖苷酶的抑制活性高于同等浓度的α-淀粉酶的抑制活性。

表4 蓝莓叶多酚和阿卡波糖对α-淀粉酶和α-葡萄糖苷酶抑制作用(IC50)比较

图4 蓝莓叶多酚和阿卡波糖对α-淀粉酶(A)和α-葡萄糖苷酶(B)的抑制作用
阿卡波糖对α-淀粉酶和α-葡萄糖苷酶的IC50值低于蓝莓叶多酚的,可知蓝莓叶多酚抑制效果不及阿卡波糖,这可能与蓝莓叶多酚提取纯度不高有关。由“2.1”结果可知,纯化后蓝莓叶多酚纯度为36%,远低于阿卡波糖纯度(98%)。本文采用的纯化方法只粗略除去了水溶性杂质,而洗脱剂的选择、吸附流速、样品液浓度、洗脱流速等因素对纯化效果有一定的影响。为提高蓝莓叶多酚的体外降血糖活性,还需进一步优化纯化条件和方法。阿卡波糖应用于临床,患者服用此药物会有类似腹胀、腹泻的情况[9]。而从蓝莓叶中提取的多酚是一种天然植物活性物质,用于降血糖食品药品研发更具安全性。
2.6 蓝莓叶多酚对α-淀粉酶和α-葡萄糖苷酶的抑制类型
最后通过紫外光谱法研究了蓝莓叶多酚对α-淀粉酶和α-葡萄糖苷酶的抑制动力学,探究蓝莓叶多酚浓度、酶浓度与酶解速率之间的关系,判断抑制作用是否可逆。如图5A和5D所示,所有直线都基本过原点。随着蓝莓叶多酚浓度增加,直线斜率逐渐下降,说明蓝莓叶多酚对α-淀粉酶和α-葡萄糖苷酶的抑制作用是可逆性的[21]。
为确定蓝莓叶多酚对α-淀粉酶和α-葡萄糖苷酶的可逆抑制类型,按照Lineweaver-Burk和Dixon双倒数曲线作图法,探究蓝莓叶多酚浓度、底物浓度与酶解速率之间的关系,确定抑制类型和抑制常数。由图5B、5C、5E和5F可知,反应体系中随着抑制剂浓度降低,α-淀粉酶和α-葡萄糖苷酶的酶解反应速率明显升高。随着底物浓度的增加,酶解反应速率也在增加,并逐渐接近最大反应速率Vmax。这一结果说明蓝莓叶多酚能够竞争底物,优先与酶相结合形成复合物,从而使酶失活[22]。通过Lineweaver-Burk图监测米氏常数Km和最大酶解速率Vmax值的变化,斜率为Km和Vmax的比值,y轴截距为1/Vmax值,直线斜率随蓝莓叶多酚浓度增大而增大。通过Dixon图可以看出随着蓝莓叶多酚浓度增大,x轴截距减小,y轴截距增大,即Vmax值减小,Km增大。不同浓度多酚直线分别相交于第二象限和第三象限的一点,交点接近y轴,这种特征符合混合型抑制,蓝莓叶多酚属于混合型抑制剂。随着抑制剂浓度增加,由于α-淀粉酶和α-葡萄糖苷酶被抑制改变了Vmax和Km值,表明蓝莓叶多酚对酶具有完整且单一的抑制位点或单一类别的抑制位点[23],从而更容易与酶结合改变酶的活性中心构象,抑制α-淀粉酶与淀粉生成葡萄糖,α-葡萄糖苷酶与对硝基苯酚-α-D-葡萄糖苷(pNPG)生成葡萄糖和对硝基苯酚(pNP)。这与阿卡波糖对α-淀粉酶和α-葡萄糖苷酶的抑制效果是相同的[24]。根据Zhang[25]中所述,Lineweaver-Burk图中交点横坐标绝对值为竞争性抑制常数Kic值,而Dixon图中交点横坐标绝对值为非竞争性抑制常数Kiu。通过计算得出蓝莓叶多酚对α-淀粉酶的Kic为1.041 5 mg/mL,Kiu为0.150 4 mg/mL。对α-葡萄糖苷酶的Kic为0.222 9 mg/mL,Kiu为0.004 1 mg/mL。其竞争性常数>非竞争性常数,说明蓝莓叶多酚对α-淀粉酶和α-葡萄糖苷酶都是竞争性大于非竞争性的混合可逆性抑制类型。而Kic和Kiu值越低,1/Kic和1/Kiu值越高,表明抑制剂与酶的结合越强。α-淀粉酶的Kic和Kiu值比α-葡萄糖苷酶的高,则说明蓝莓叶多酚与α-葡萄糖苷酶结合力比α-淀粉酶结合力强。
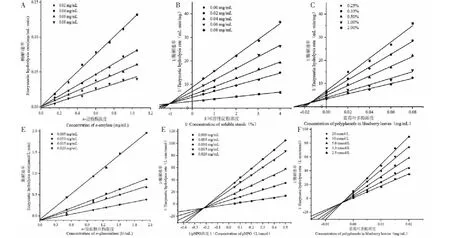
图5 蓝莓叶多酚对α-淀粉酶和α-葡萄糖苷酶的抑制动力学
3 结论
本文研究的蓝莓叶多酚提取物中主要成分有绿原酸、5,6,7,3′,4′-五氢化二异黄酮、槲皮素、原花青素等。体外降血糖活性评价显示,蓝莓叶多酚具有较好的α-淀粉酶和α-葡萄糖苷酶抑制作用,且抑制活性与总酚含量成正相关。通过探究温度和pH对蓝莓叶多酚抑制活性的影响,可知蓝莓叶多酚在低温(30~50 ℃)和偏酸性(pH 2.0~8.0和3.0~5.0)环境下比较稳定,能够保持较高的α-淀粉酶和α-葡萄糖苷酶抑制活性。蓝莓叶多酚对α-淀粉酶和α-葡萄糖苷酶的半抑制浓度IC50分别为10.926和7.276 μg/mL,此外动力学研究结果,发现其对两个酶的抑制类型均为竞争性大于非竞争性的混合性可逆抑制。
综上所述,蓝莓叶中多酚含量丰富,具有较好的体外α-淀粉酶和α-葡萄糖苷酶抑制作用,揭示了蓝莓叶多酚具有潜在的降血糖作用,为蓝莓叶相关产品研发提供了一定的理论基础。

